10.E: Reacciones de Adición Nucleofílica de Carbonilo (Ejercicios)
- Page ID
- 72355
P10.1: Dibujar un mecanismo que muestre la formación de un enlace imina entre una cadena lateral de lisina y a-cetobutirato (este es el primer paso en la degradación de lisina, EC 1.5.1.8).
P10.2: Dibujar cuatro posibles isómeros hemicetales cíclicos del compuesto a continuación.
P10.3: Un intermedio aguas abajo en la vía de degradación de lisina se somete a hidrólisis de imina para liberar dos productos de aminoácidos (EC 1.5.1.1). Dibujar un mecanismo para esta reacción de hidrólisis, y mostrar las estructuras de los dos productos formados.
P10.4: A continuación se muestra la estructura de la lactosa, el azúcar que se encuentra en los productos lácteos.
La lactosa es un disacárido de galactosa y glucosa. Las personas que son intolerantes a la lactosa no producen suficiente lactasa -la enzima que hidroliza el enlace glicosídico que une a los dos monosacáridos- para poder digerir completamente los productos lácteos.
- Dibujar un intermedio de carbocatión probablemente estabilizado en la reacción de hidrólisis catalizada por lactasa.
- Dibuje, en la conformación de la silla, la estructura de lo que predices sería la forma más abundante del monosacárido de galactosa en solución acuosa.
- ¿La galactosa es una aldosa o una cetosa?
- Dibujar, mostrando la esteroquímica, la forma de cadena abierta de galactosa.
P10.5: Probablemente sepas que el ácido ascórbico (vitamina C) actúa como antioxidante en el cuerpo. Cuando la vitamina C hace su trabajo, termina siendo oxidada a deshidroascobato, que generalmente se dibuja como se muestra a continuación, en la llamada forma tricarbonilo.
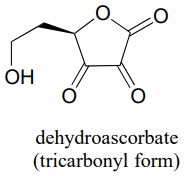
La evidencia sugiere, sin embargo, que la forma más importante de deshidroascorbato en un contexto fisiológico es aquella en la que uno de los grupos cetónicos está en su forma hidratada, y la otra es un hemicetal intramolecular (ver Chemical and Engineering News, 25 de agosto de 2008, p. 36). Mostrar la estructura de esta forma de ácido deshidroascórbico.
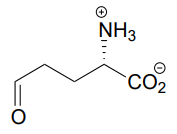
P10.6: El siguiente compuesto es el producto de una etapa de hidrólisis de imina de apertura de anillo en la vía de degradación de prolina, uno de los aminoácidos. Dibujar la estructura del compuesto de partida.
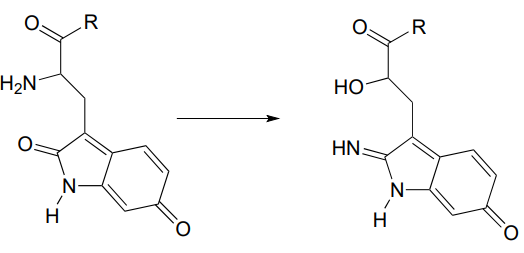
P10.7: Se propuso el reordenamiento a continuación para proceder a través de la formación de imina seguida de sustitución nucleofílica. Proponer un mecanismo que se ajuste a esta descripción. (J. Biol. Chem. 280, 12858, esquema 2 parte 2).
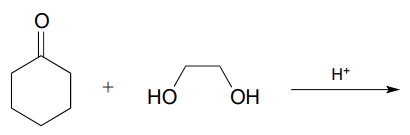
P10.8: Las reacciones bioquímicas formadoras de acetales que aprendimos en este capítulo requieren la activación del hemiacetal a través de la fosforilación. En el laboratorio de síntesis orgánica, las reacciones formadoras de acetales no enzimáticas se llevan a cabo con una cantidad catalítica de ácido fuerte, que sirve para activar el hemiacetal. Predecir el producto de la siguiente reacción formadora de acetal y proponer un mecanismo razonable para la reacción. Recuerde que la reacción se lleva a cabo en condiciones ácidas, lo que significa que el estado de protonación de los intermedios será diferente al de las reacciones bioquímicas que ocurren en neutro\(pH\).
Los problemas 9-15 involucran variaciones y combinaciones de los pasos de adición nucleofílica que estudiamos en este capítulo. Aunque los reactivos y/o productos pueden verse algo diferentes de los aldehídos, acetales, iminas, etc. más simples que usamos como ejemplos en el capítulo, los pasos clave aún involucran esencialmente los mismos patrones mecanicistas. Antes de intentar estos problemas, es posible que desee revisar las reacciones de tautomerización en la sección 7.6.
P10.9: El paso final en la biosíntesis de monofosfato de inosina (IMP, precursor tanto de AMP como de GMP), es una reacción de cierre de anillo en la que se forma un nuevo enlace nitrógeno-carbono (indicado por una flecha en la estructura a continuación). Predecir el sustrato de partida para esta reacción y proponer un mecanismo que implique una ligera variación en la formación típica de imina. (EC 3.5.4.10)
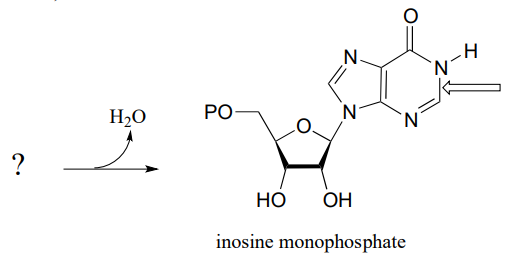
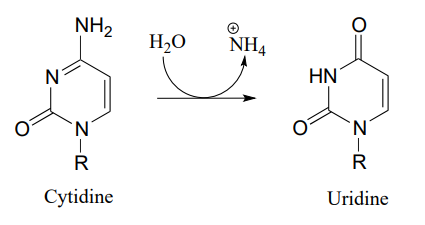
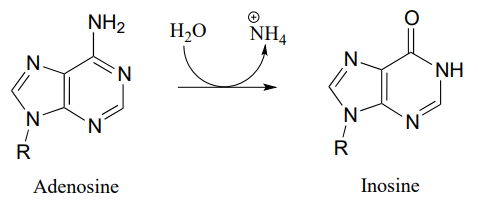
P10.10: Proponer un mecanismo para estas etapas en el metabolismo de nucleótidos:
- (EC 3.5.4.5)
- (EC 3.5.4.4)
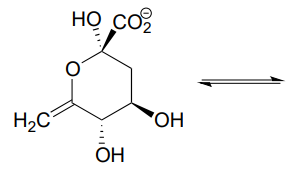
P10.11
- Dibujar la estructura (incluyendo la estereoquímica) del compuesto que resulta cuando el hemicetal cíclico que se muestra a continuación se convierte en un compuesto de cadena abierta con dos grupos cetónicos.
- El compuesto que se muestra a continuación se somete a una reacción de apertura de anillo para formar una especie que puede describirse tanto como enol como enamina. Dibujar la estructura (incluida la estereoquímica) de este producto, y un mecanismo probable para su formación. (EC 5.3.1.24)
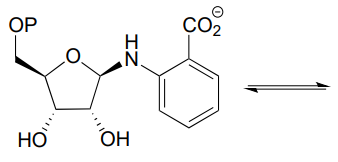
P10.12: El tetrahidrofolato (\(THF\)) es una coenzima que sirve como donante de carbono único en muchas reacciones bioquímicas. A diferencia de la\(S\) -adenosilmetionina (SAM, ver sección 8.8), el carbono que se transfiere en una reacción\(THF\) dependiente suele ser parte de un carbonilo. A continuación se muestra una reacción en la vía de degradación de histidina (EC 3.5.3.8). Se cree que el mecanismo involucrado es una transiminación, seguida de una tautomerización imina-a-imina, seguida de una hidrólisis de imina. Proponer un mecanismo razonable que se ajuste a esta descripción. Pista: primero identificar el átomo de carbono que se está transfiriendo.
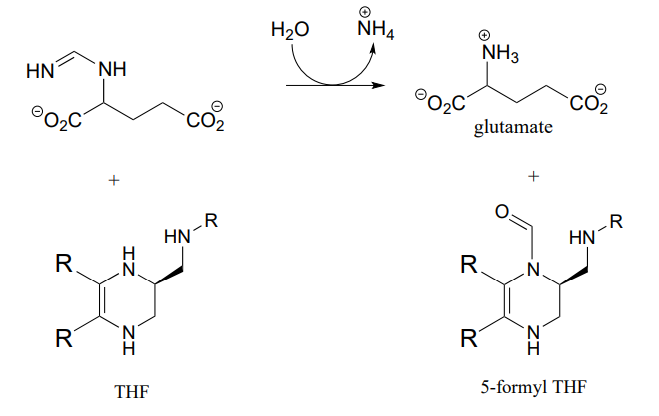
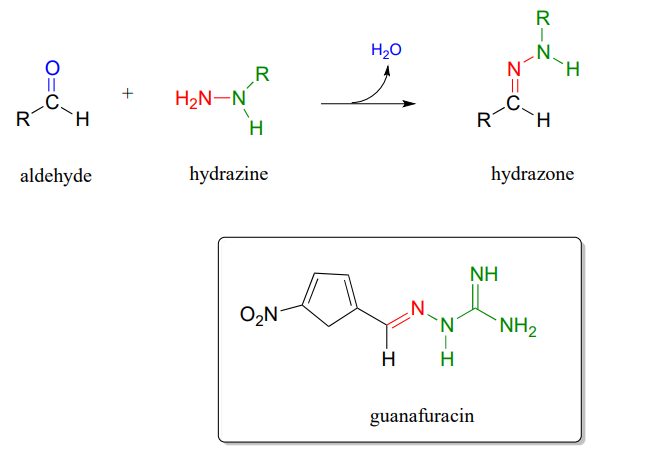
P10.13: Las hidrazonas son parientes cercanos de las iminas, formadas en reacciones entre aldehídos/cetonas e hidrazinas, un grupo funcional que contiene un enlace nitrógeno-nitrógeno. El mecanismo para la formación de hidrazona es análogo al de la formación de imina.
La guanafuracina, un conocido compuesto antibiótico, es una hidrazona, y se puede preparar fácilmente en el laboratorio combinando cantidades equimolares del aldehído e hidrazina apropiados en agua (no se requiere catalizador de calor o ácido, y la reacción se completa en segundos).
Determinar los materiales de partida requeridos para la síntesis de guanafuracina y proponer un mecanismo probable para la reacción.
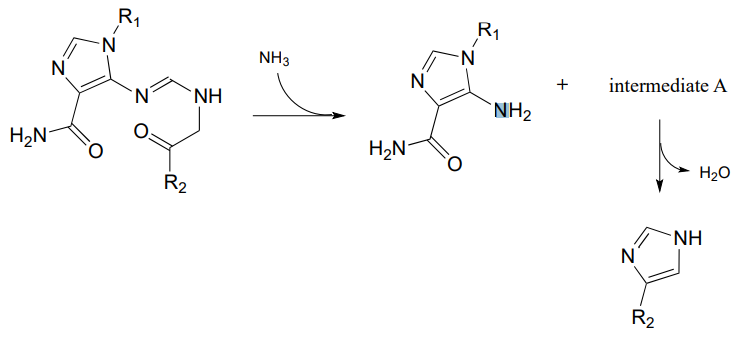
P10.14: Proponer mecanismos razonables para los siguientes pasos de la ruta de biosíntesis de histidina, y predecir la estructura del intermedio A (que es de cadena abierta, no cíclica).
¡Los últimos problemas son bastante desafiantes!
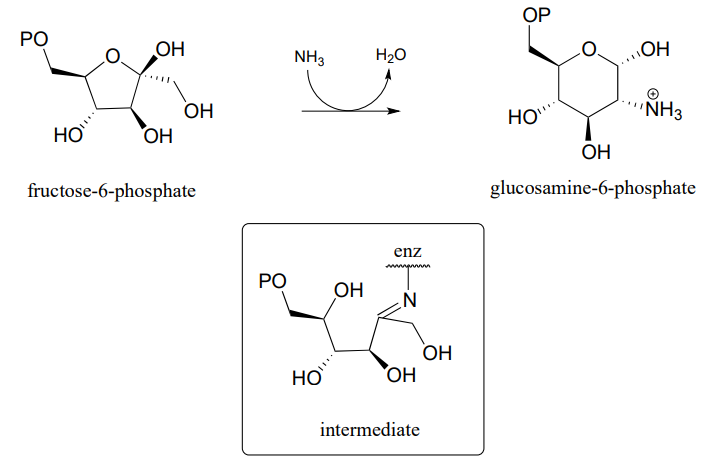
P10.15: Proponer un mecanismo probable para la síntesis de 6-fosfato de glucosamina a partir de fructosa-6-fosfato. Se muestra uno de varios intermedios. (EC 2.6.1.16.)
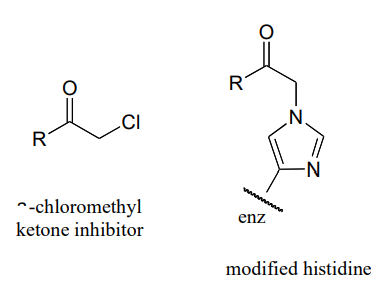
P10.16:\(\alpha \) -clorometil cetonas (estructura abajo) son inhibidores irreversibles eficaces de enzimas proteolíticas (ruptura de enlaces peptídicos) como la quimotripsina. En estas enzimas, una serina nucleofílica juega un papel clave en la reacción. Se cree que el mecanismo de inactivación de la a-quimotripsina implica, como primer paso, el ataque nucleofílico por parte de la serina del sitio activo sobre el carbonilo del inhibidor. Sin embargo, cuando se analiza la enzima inactivada, se encuentra que el inhibidor modifica covalentemente una histidina del sitio activo en lugar de la serina. A continuación se muestra la estructura de la histidina modificada. Se piensa que el mecanismo de inactivación involucra un epóxido intermedio - con esto en mente, proponer un mecanismo razonable de inactivación.
P10.17: Una enzima en bacterias E. coli cataliza la hidrólisis de a-glucosa-GDP a glucosa.
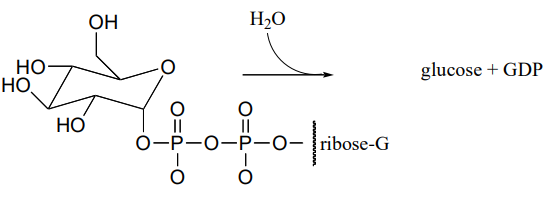
\(^1H-NMR\)el análisis de la reacción en curso mostró la aparición inicial de un doblete a 4.64 ppm con J = 7.9 Hz (el espectro también contenía otras señales, por supuesto). Después de 20 minutos (momento en el que la reacción de hidrólisis se ha completado desde hace algún tiempo), otro doblete comenzó a aparecer ligeramente campo abajo, este con J = 4.0 Hz. Con el tiempo, la intensidad de la señal de campo abajo aumentó gradualmente y la de la señal de campo alto disminuyó gradualmente, hasta que se estabilizaron a niveles constantes.
Dibuje un mecanismo para la reacción de hidrólisis enzimática y correlacione su mecanismo con los\(NMR\) datos (incluyendo la aparición del segundo doblete).
P10.18: La arginina desaminasa, una enzima en la vía de degradación de la arginina, cataliza la transformación de (\(L\)) -arginina a (\(L\)) -citrulina a través de un intermedio sustrato covalente-cisteína.
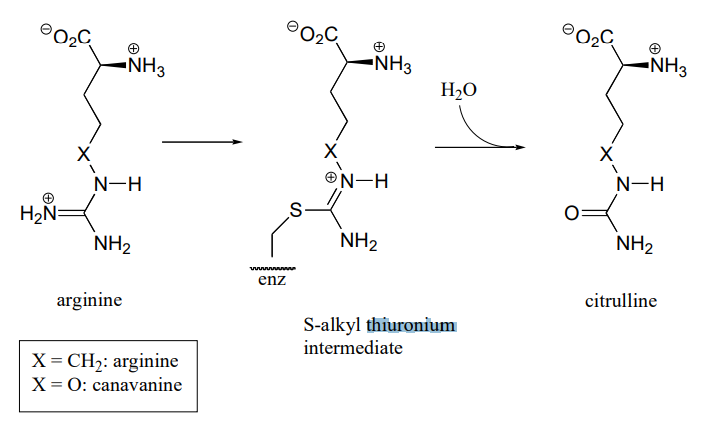
Esta enzima es la diana para el desarrollo de fármacos para el cáncer y enfermedades inmunológicas como la artritis. Sin embargo, en lugar de apagar completa y permanentemente la enzima (por ejemplo, con un inhibidor irreversible), los investigadores están buscando una manera de “rechazar” temporalmente la actividad de la enzima. Una estrategia que recientemente se ha reportado involucra el uso de un análogo de arginina que contiene oxígeno, llamado canavanina, que reacciona de la misma manera que la arginina excepto que la segunda etapa (hidrólisis) es muy lenta. Si bien la enzima se une covalentemente al inhibidor (en la etapa\(S\) -alquil tiuronio), se inactiva.
- Mostrar un mecanismo para la reacción catalizada por arginina desaminasa.
- Explicar cómo el efecto electrónico del sustituyente de oxígeno ralentizaría la etapa de hidrólisis de la reacción, y por qué la velocidad de la etapa de hidrólisis se ve más afectada por la sustitución de oxígeno que la etapa de\(S\) formación de -alquiltiuronio.


