11.3: El Mecanismo de Sustitución Nucleofílica de Acilo
- Page ID
- 72134
El hecho de que uno de los átomos adyacentes al carbono carbonilo en los derivados de ácido carboxílico sea un heteroátomo electronegativo —más que un carbono como en las cetonas o un hidrógeno como en los aldehídos— es crítico para comprender la reactividad de los derivados de ácido carboxílico. La diferencia más significativa entre una cetona/aldehído y un derivado de ácido carboxílico es que este último tiene un grupo potencial de salida -lo que estamos llamando el 'grupo acilo X'- unido al carbono carbonilo.
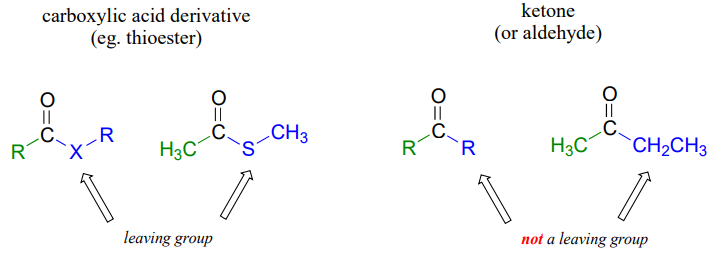
Como resultado, los derivados de ácido carboxílico experimentan reacciones de sustitución de acilo nucleofílico, en lugar de adiciones nucleofílicas como cetonas y aldehídos.
Una reacción de sustitución de acilo nucleófilo inicia con ataque nucleofílico en el carbonilo, conduciendo a un intermedio tetraédrico (paso 1 a continuación). En la etapa 2, el intermedio tetraédrico colapsa y el grupo acilo X es expulsado, aceptando generalmente un protón de un ácido enzimático en el proceso.
Mecanismo para una reacción de sustitución de acilo nucleófilo:
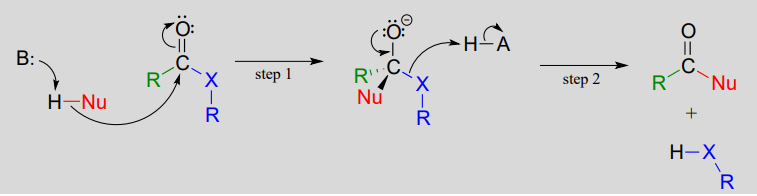
Observe que en el producto, el nucleófilo se convierte en el nuevo grupo acilo X. Es por ello que a este tipo de reacción se le denomina sustitución acilo nucleofílica: un grupo acilo X se sustituye por otro. Por ejemplo, en la reacción siguiente, un alcohol 'grupo X' (metanol), sustituye por otro alcohol 'grupo X' (3-metil-1-butanol) como un éster se convierte en otro.
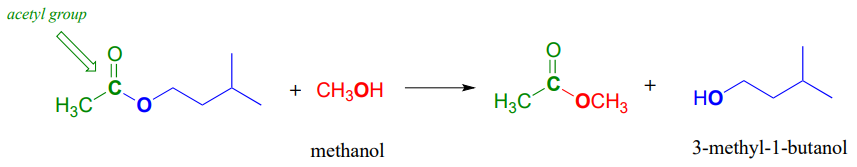
Otra forma de observar esta reacción es imaginar el grupo acilo siendo transferido de un grupo acilo X a otro: en el ejemplo anterior, el grupo acetilo (en verde) se transfiere de 3-metil-1-butanol (azul) a metanol (rojo). Por esta razón, las sustituciones de acilo nucleofílicas también se denominan comúnmente reacciones de transferencia de acilo.
Las enzimas que catalizan reacciones de sustitución de acilo nucleofílico han desarrollado formas de estabilizar el intermedio tetraédrico cargado negativamente, disminuyendo así la energía de activación de la primera etapa determinante de la velocidad (ataque nucleofílico). El estado de transición tardía del primer paso se asemeja al intermedio tetraédrico que resulta: recordemos del capítulo 6 que el postulado de Hammond nos dice que cualquier cosa que estabilice al intermedio tetraédrico también estabilizará el estado de transición. En muchos casos, por ejemplo, los residuos de aminoácidos enzimáticos se posicionan en el sitio activo para proporcionar interacciones estabilizantes donadoras de enlaces de hidrógeno con el oxígeno cargado negativamente. Esta disposición se denomina a veces en la literatura bioquímica como un agujero de oxanión. La siguiente figura muestra un intermedio tetraédrico estabilizado por donación de enlaces de hidrógeno a partir de dos átomos de nitrógeno de la cadena principal (amida).



