11.7: Hidrólisis de Tioésteres, Ésteres y Amidas
- Page ID
- 72123
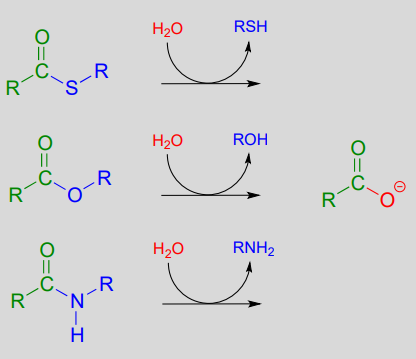
Hasta el momento hemos estado analizando la formación de tioésteres, ésteres carboxílicos y amidas, a partir de carboxilatos. En las reacciones de sustitución de acilo hidrolíticas, el agua nucleofílica es el nucleófilo entrante y un grupo carboxilato es el producto final. Debido a que los carboxilatos son los menos reactivos entre los derivados de ácido carboxílico, estas reacciones de hidrólisis son termodinámicamente favorables, siendo la hidrólisis tioéster la más favorable de las tres.
Hidrólisis de tioéster, éster carboxílico y amida:
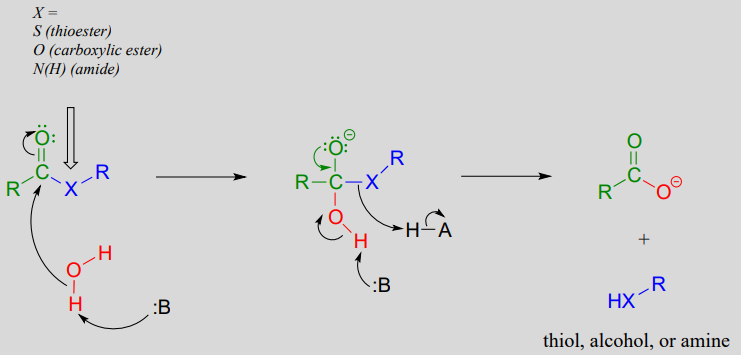
Mecanismo:
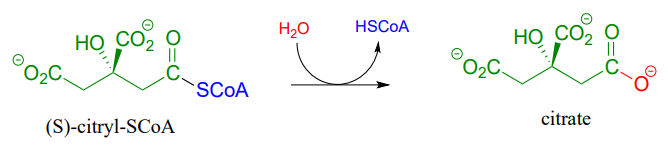
En el ciclo del ácido cítrico (Krebs), (S) -citril-CoA se hidroliza a citrato (EC 2.3.3.8):
La acetilcolinesterasa (EC 3.1.1.7), enzima presente en la sinapsis, cataliza la hidrólisis del grupo éster en la acetilcolina, un neurotransmisor que desencadena la contracción muscular.
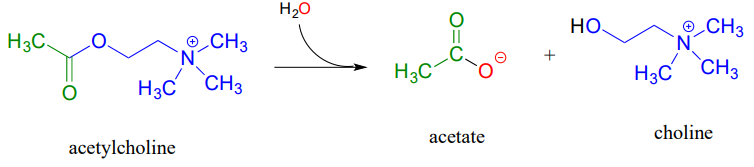
Al igual que muchas otras enzimas hidrolíticas, la reacción de acetilcolinesterasa procede en dos fases: primero, se forma un intermedio enzima-sustrato covalente cuando el grupo acilo de la acetilcolina se transfiere a una serina de sitio activo en la enzima (una reacción de transesterificación). Un nucleófilo de agua entonces ataca este éster, expulsando el acetato y completando la hidrólisis.
Con base en la descripción anterior, dibujar la estructura del intermedio enzima-sustrato covalente en la reacción de acetilcolinesterasa.
Si se inhibe la acción de la acetilcolinesterasa, la acetilcolina en la sinapsis no se hidroliza y así se acumula, resultando en parálisis y muerte en casos severos. El gas nervioso sarín es un potente inhibidor de la acción de la acetilcolinasterasa. Algunas víctimas del ataque de sarín del metro de Tokio en 1995 que estuvieron expuestas a bajos niveles del gas informaron que inicialmente se dieron cuenta de que algo andaba mal cuando notaron lo oscuro que parecía todo a su alrededor. Esto se debió a la contracción incontrolada de sus pupilas. Se le invitará a considerar el mecanismo de inhibición por sarín en el problema 11.6.4.
Los enlaces peptídicos (amida) en proteínas y polipéptidos están sujetos a hidrólisis espontánea (no enzimática) en agua.
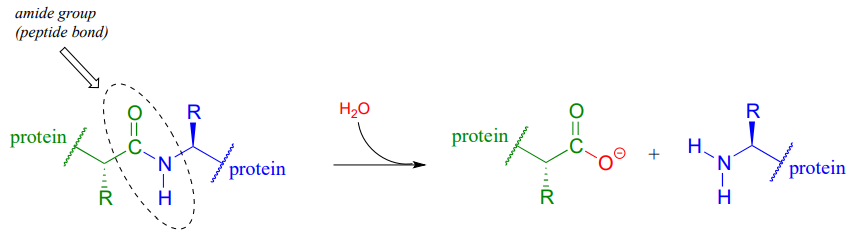
Aunque esta conversión de amida a carboxilato es termodinámicamente una reacción cuesta abajo, los enlaces peptídicos son cinéticamente muy estables (reaccionan lentamente) a pH neutro. De hecho, la vida media para la hidrólisis no catalizada de un enlace peptídico en agua a pH 7 es, en algunas estimaciones, tan alta como 1000 años. (Ann. Rev. Biochem. 2011, 80, 645.)
La estabilidad de los enlaces peptídicos tiene un buen sentido fisiológico: ¡todos estaríamos en problemas si nuestras enzimas, receptores y proteínas estructurales se hidrolizaran mientras dormíamos! Dicho esto, también es cierto que la hidrólisis controlada y específica de enlaces peptídicos, catalizada por una clase grande y diversa de enzimas llamadas proteasas, es un tipo de reacción bioquímica crítica que puede ocurrir muy rápidamente, en muchos contextos biológicos diferentes. Por ejemplo, muchas proteínas solo se vuelven activas después de haber sido 'procesadas', es decir, hidrolizadas en una ubicación específica de aminoácidos por una proteasa específica.
Aunque todas las proteasas catalizan esencialmente la misma reacción, hidrólisis de amidas, diferentes subfamilias de proteasas han desarrollado diferentes estrategias catalíticas para lograr el mismo resultado. La proteasa del VIH es el objetivo de algunos de los fármacos anti-VIH más recientemente desarrollados. Desempeña un papel crítico en el ciclo de vida si el virus VIH, hidrolizando enlaces peptídicos específicos de proteínas virales esenciales para convertirlos a sus formas activas. La proteasa del VIH es un miembro de la subfamilia aspartil proteasa, así llamada debido a los dos residuos de aspartato localizados en los sitios activos de estas enzimas. La proteasa del VIH también es, como probablemente ya sabe, el objetivo de los medicamentos inhibidores de la proteasa del VIH, que son un componente del tratamiento más efectivo disponible actualmente para la infección por VIH.
En la proteasa del VIH y otras aspartil proteasas, los dos restos enzimáticos de aspartatos (gris sombreado y abreviados 'Asp1' y 'Asp2 'en la figura siguiente) trabajan en concierto para activar el grupo electrófilo, nucleófilo y saliente en la reacción.
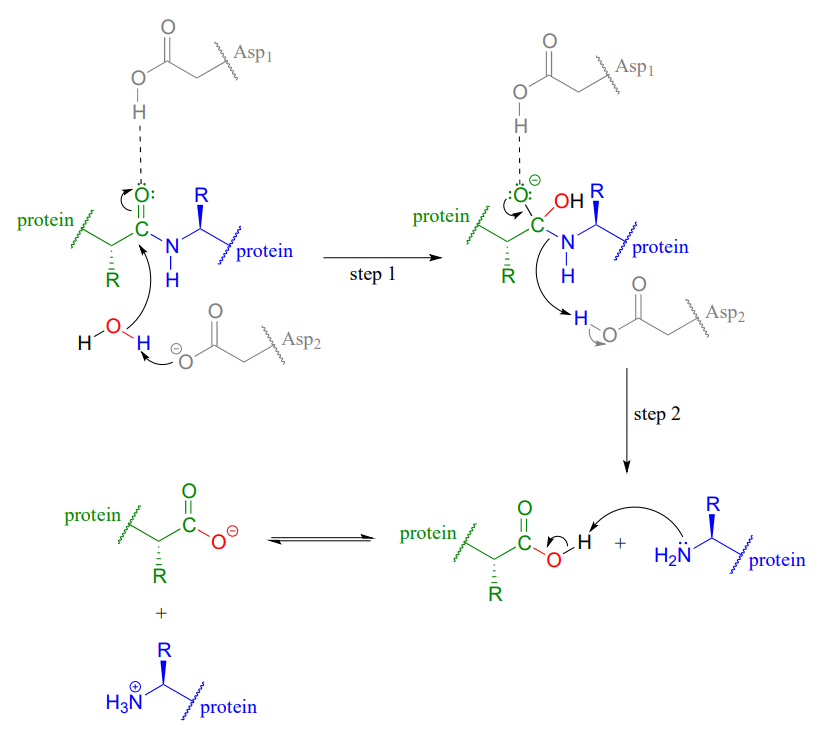
Exactamente cómo funciona esto es tema de cierto debate y los detalles bien pueden variar según la enzima en cuestión, pero un mecanismo probable se ilustra en la figura anterior, donde Asp1, que inicialmente se encuentra en su forma protonada, aporta un enlace de hidrógeno para alejar la densidad electrónica del carbonilo carbono, haciéndola más electrofílica. Al mismo tiempo, Asp2, que inicia el ciclo de reacción en su forma aniónica, desprotona la molécula de agua para hacerla más nucelófila. En el paso 2, Asp2 dona un protón de nuevo al nitrógeno, convirtiéndolo en un mejor grupo saliente.
Los inhibidores de la proteasa del VIH cierran esta reacción, lo que impide que el virus procese las proteínas que utiliza para unirse a las células hospedadoras.
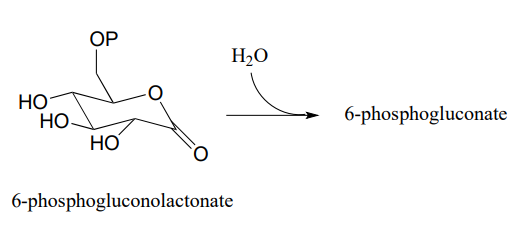
La lactonasa (EC 3.1.1.17), la segunda enzima en la rama oxidativa de la vía de la pentosa fosfato, cataliza la hidrólisis del grupo lactona (éster cíclico) en la 6-fosfogluconolactona. Dibujar la estructura del 6-fosfogluconato, producto de esta reacción.
Dr aw el producto de la hidrólisis\(\beta \) de penicilina catalizada por lactamasa como se describe en la sección 11.6.
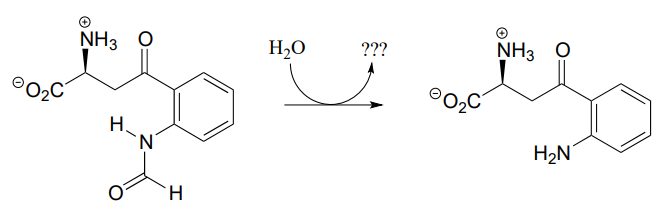
¿Cuál es el producto que falta (designado a continuación por signos de interrogación) en la reacción a continuación, que es parte de la vía de degradación del aminoácido triptófano? ¿Cómo podría describir esta reacción en la terminología de química orgánica?
- Contestar
-
Agrega el texto de respuesta aquí y automáticamente se ocultará si tienes una plantilla de “AutoNum” activa en la página.


