15.2: Oxidación y Reducción de Compuestos Orgánicos - Una Visión General
- Page ID
- 72229
Indudablemente ya estás familiarizado con la idea general de oxidación y reducción: aprendiste en química general que cuando un compuesto o elemento se oxida pierde electrones, y cuando se reduce gana electrones. También sabes que las reacciones de oxidación y reducción ocurren en tándem: si una especie se oxida, otra debe reducirse al mismo tiempo, de ahí el término 'reacción redox”.
La mayoría de las reacciones redox que has visto anteriormente en química general probablemente involucraron el flujo de electrones de un metal a otro, como la reacción entre el ion cobre en solución y el zinc metálico:
\[Cu^{+2}_{(aq)} + Zn_{(s)}\rightarrow Cu_{(s)}+ Zn^{+2}_{(aq)}\]
Al leer la reacción anterior de izquierda a derecha, ¿qué especies químicas se oxidan? ¿Cuál se está reduciendo?
Cuando hablamos de la oxidación y reducción de compuestos orgánicos, lo que nos preocupa principalmente es el número de enlaces carbono-heteroátomo en el compuesto en comparación con el número de enlaces carbono-hidrógeno. (Recuerde que el término 'heteroátomo' en la química orgánica generalmente se refiere al oxígeno, nitrógeno, azufre, o un halógeno).
- La oxidación de un compuesto orgánico da como resultado un aumento en el número de enlaces carbono-heteroátomo y/o una disminución en el número de enlaces carbono-hidrógeno.
- La reducción de un compuesto orgánico resulta en una disminución en el número de enlaces carbono-heteroátomo y/o un aumento en el número de enlaces carbono-hidrógeno.
A continuación se presentan una serie de transformaciones comunes de grupos funcionales que se clasifican como redox.
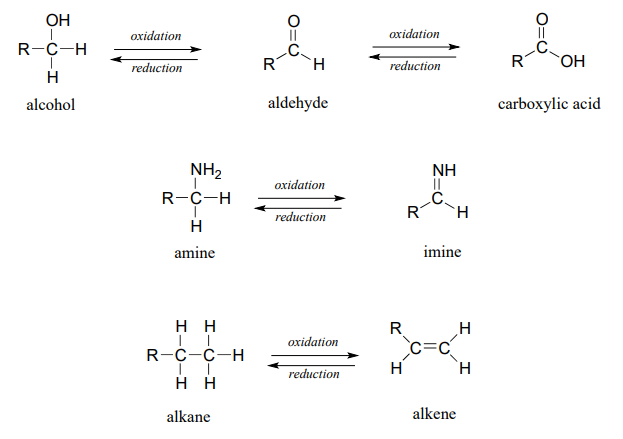
Los heteroátomos como el oxígeno y el nitrógeno son más electronegativos que el carbono, por lo que cuando un átomo de carbono gana un enlace a un heteroátomo, pierde densidad electrónica y así se oxida. Por el contrario, el hidrógeno es menos electronegativo que el carbono, por lo que cuando un carbono gana un enlace a un hidrógeno, está ganando densidad electrónica, y por lo tanto se reduce.
La hidratación de un alqueno a un alcohol no se clasifica como una reacción redox. Explique.
En su mayor parte, cuando se habla de reacciones redox en química orgánica se trata de un pequeño conjunto de transformaciones de grupos funcionales muy reconocibles. El concepto de estado de oxidación puede ser útil en este contexto. Cuando un compuesto tiene muchos enlaces carbono-hidrógeno, se dice que está en un estado de oxidación más bajo, o un estado más reducido. Por el contrario, si contiene muchos enlaces carbono-heteroátomo, se dice que se encuentra en un estado de oxidación superior.
Comenzaremos con una serie de compuestos de carbono único como ejemplo. El metano, en el que el carbono tiene cuatro enlaces con el hidrógeno, es el miembro más reducido del grupo. Los compuestos se oxidan cada vez más a medida que avanzamos de izquierda a derecha, con cada paso ganando un enlace con el oxígeno y perdiendo un enlace con el hidrógeno. El dióxido de carbono, en el que los cuatro enlaces del carbono están con el oxígeno, se encuentra en el estado de oxidación más alto.
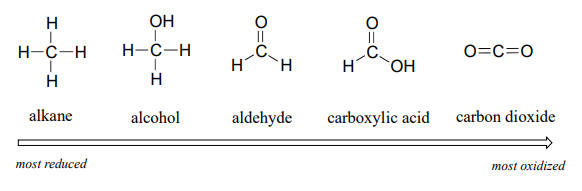
De manera más general, podemos clasificar el estado de oxidación de los grupos funcionales comunes:
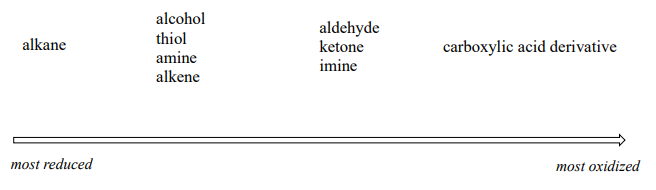
El estado de oxidación de alcanos es el más reducido. Los alcoholes, tioles, aminas y alquenos están todos en el mismo estado de oxidación: por lo tanto, una reacción que convierte uno de estos grupos en otro -una conversión de alcohol en alqueno, por ejemplo- no es una reacción redox. Los aldehídos, sin embargo, están en un estado de oxidación más alto que los alcoholes, por lo que una conversión de alcohol a aldehído es una oxidación. Asimismo, una conversión de imina a amina es una reducción, pero una conversión de imina a cetona no es una reacción redox.
Es importante tener en cuenta que la oxidación y reducción siempre ocurre en tándem: cuando un compuesto se oxida, otro compuesto debe reducirse. A menudo, los químicos orgánicos usarán los términos agente oxidante y agente reductor para referirse a especies que son comúnmente utilizadas, por químicos humanos o por naturaleza, para lograr la oxidación o reducción de una variedad de compuestos. Por ejemplo, trióxido de cromo (\(CrO_3\)) is a laboratory oxidizing agent used by organic chemists to oxidize a secondary alcohol to a ketone, in the process being reduced to \(H_2CrO_3\). Sodium borohydride (\(NaBH_4\)) is a laboratory reducing agent used to reduce ketones (or aldehydes) to alcohols, in the process being oxidized to \(NaBH_3OH\).
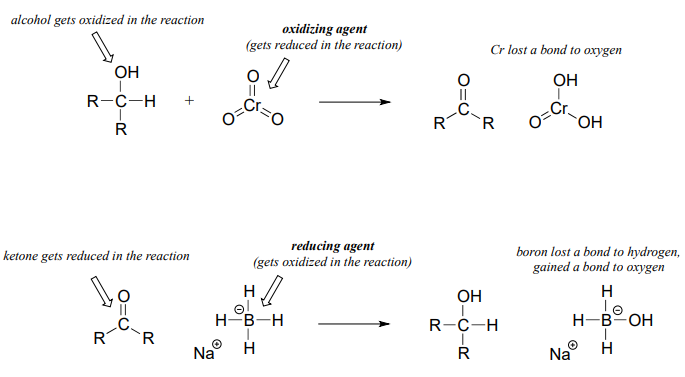
There is a wide selection of oxidizing and reducing agents available for use in the organic chemistry laboratory, each with its own particular properties and uses. For example, while sodium borohydride is very useful for reducing aldehyde and ketone groups to alcohols, it will not reduce esters and other carboxylic acid derivatives. If you take a course in synthetic organic chemistry, you will learn about the use of many of these agents.
In this book, of course, we are concerned primarily with the organic chemistry that occurs within a living cell. A large part of this chapter will be spent looking at the action of two very important classes of coenzymes - the nicotinamides and the flavins - that serve as biochemical oxidizing and reducing agents. We also consider the oxidation and reduction of sulfur atoms in thiol groups, especially the thiol group on the side chain of cysteine residues in proteins.
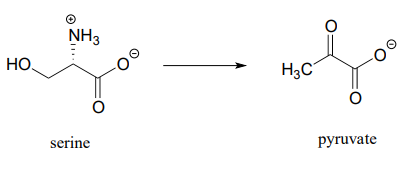
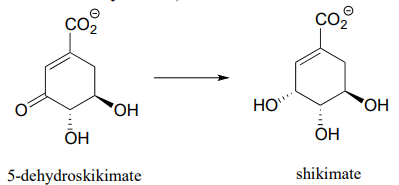
Each of the biochemical transformations shown below is a step in amino acid metabolism. For each, state whether the substrate is being oxidized, reduced, or neither oxidized nor reduced.
- (from aromatic amino acid biosynthesis)
- (from the biosynthesis of arginine and proline)
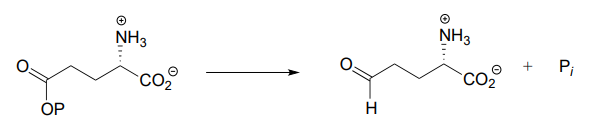
- (from the catabolism of lysine)
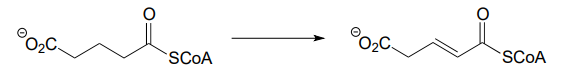
- (from the catabolism of tryptophan)
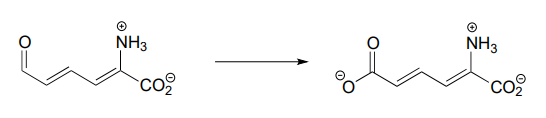
- (from the catabolism of serine)