15.3: Oxidación y Reducción en el Contexto del Metabolismo
- Page ID
- 72205
Piensa de nuevo en la química redox que aprendiste en tu curso de química general. Un experimento común en un laboratorio de química general es instalar una celda galvánica que consiste en un electrodo de cobre sumergido en una solución acuosa de nitrato de cobre, conectado por un cable a un electrodo de zinc sumergido en una solución acuosa de nitrato de zinc.
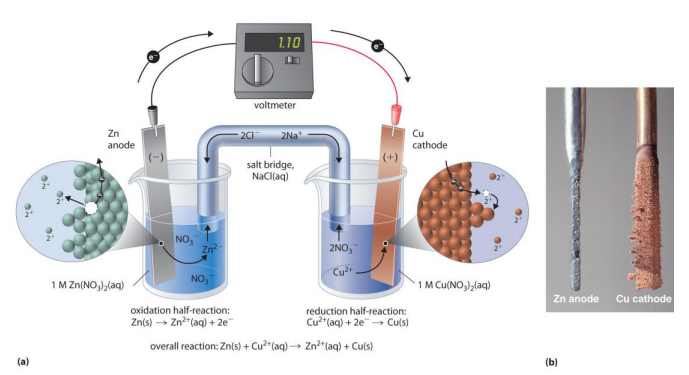
Cuando la celda se completa con un puente de sal, comienza a fluir una corriente eléctrica; lo que tenemos es una batería simple (figura a arriba). Con el tiempo, el electrodo de cobre se vuelve más pesado a medida que el cobre metálico se deposita sobre el cátodo de cobre, mientras que el ánodo de zinc se disuelve lentamente en solución (figura b anterior). La reacción redox que se produce aquí es:
\[\ce{Cu^{+2}(aq) + Zn(s) \rightarrow Cu (s) + Zn^{+2} (aq) + energy}\]
Electrons flow from zinc metal to copper cations, creating zinc cations and copper metal: in other words, zinc metal is being oxidized to zinc cation and copper cation is being reduced to copper metal, as expressed by the two relevant half-cell reactions:
\[\ce{Cu^{+2} (aq) + 2e^{-} \rightarrow Cu^{0} (s)}\]
\[\ce{Zn^{0}(s) \rightarrow Zn^{+2}(aq) + 2e^{-}}\]
We can predict before we set up the cell that the spontaneous flow of electrons will go in the zinc to copper direction, just by looking at a table of standard reduction potentials (such a table was no doubt in your general chemistry text).
| Reduction half-reaction | Reduction potential (volts) |
|---|---|
| \(\ce{Ag^{+1} (aq) + e^{-} \rightarrow Ag^{0}(s)}\) | 0.800 |
| \(\ce{Cu^{+2}(aq) + 2e^{-} \rightarrow Cu^0(s)}\) | 0.337 |
| \(\ce{H^{+1}(aq) + 2e^{-} \rightarrow H2(g)}\) | 0 (Standard) |
| \(\ce{Pb^{+2}(aq) + 2e^{-} \rightarrow Pb^{0}(s)}\) | -0.126 |
| \(\ce{Fe^{+2}(aq) + 2e^{-} \rightarrow Fe^{0}(s)}\) | -0.441 |
| \(\ce{Zn^{+2}(aq) + 2e^{-} \rightarrow Zn^0(s)}\) | -0.763 |
Copper ion (\(Cu^{+2}\)) has a higher standard reduction potential than zinc ion (\(Zn^{+2}\)), meaning that, under identical conditions, more energy is released by reducing one mole of \(Cu^{+2}\) ion to \(Cu^0\) metal than is released by reducing one mole of \(Zn^{+2}\) ion to \(Zn^0\) metal.. Another way to think about this is to imagine that the copper ion 'wants' to gain electrons more than the zinc ion does. Conversely, zinc metal 'wants' to lose electrons more than the copper metal does. Therefore, transfer of two electrons from zinc metal to \(Cu^{2+}\) is a thermodynamically downhill process, whereas the reverse process - transfer of two electrons from copper metal to \(Zn^{2+}\) - is thermodynamically uphill.
\[\ce{Cu^{+2}(aq) + Zn(s) \rightarrow Cu(s) + Zn^{+2}(aq) + energy}\]
\[\ce{Cu(s) + Zn^{+2}(aq) + energy \rightarrow Cu^{+2}(aq) + Zn(s)}\]
Let's now extend the idea of redox reactions to the context of metabolism in living things. When we 'burn' glucose for energy, we transfer (by a series of enzyme-catalyzed reactions) electrons from glucose to molecular oxygen (\(O_2\)), oxidizing the six carbon molecules in glucose to carbon dioxide and at the same time reducing the oxygen atoms in \(O_2\) to water. The overall chemical equation is:
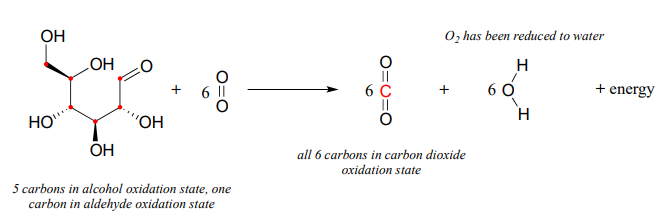
La transferencia de electrones de la glucosa a\(O_2\) es un proceso de liberación de energía termodinámicamente descendente, al igual que la transferencia de electrones del metal zinc al ion cobre. Y si bien podrías haber usado la energía liberada por la reacción redox zinc/cobre para encender una pequeña bombilla, tus células utilizan la energía liberada por el proceso redox de glucosa/oxígeno para llevar a cabo una amplia variedad de actividades que requieren energía, como caminar a tu conferencia de química orgánica.
En su experimento de química general cobre/zinc, ¿fue posible revertir la reacción para que corra en dirección cuesta arriba, es decir, para oxidar el cobre y reducir el zinc?
\[\ce{Zn^{+2}(aq) + Cu(s) + energy \rightarrow Zn(s) + Cu^{+2}(aq)}\]
Solo hazte la pregunta: ¿es posible que el agua fluya cuesta arriba? Por supuesto que lo es - ¡pero solo si suministras una bomba y algo de energía!
La misma idea se aplica al 'bombeo' de electrones cuesta arriba en su celda electroquímica de cobre-zinc: todo lo que necesita hacer es proporcionar algo de energía en forma de una corriente eléctrica externa para bombear el flujo de electrones en dirección ascendente. Estás recargando tu batería.
Pensando de nuevo en un contexto bioquímico: las plantas son capaces, mediante un proceso llamado fotosíntesis, de reducir el dióxido de carbono y oxidar el agua para formar glucosa y oxígeno molecular: esencialmente recargar la batería bioquímica del ecosistema utilizando la energía del sol.
\[\ce{6CO_2 + 6H_2O + energy \rightarrow C_6H_{12}O_6 + 6O_2}\]
A escala global, la oxidación de los carbonos en la glucosa\(CO_2\) por organismos no fotosintéticos (como las personas) y la posterior síntesis reductiva de glucosa a partir\(CO_2\) de las plantas es lo que los ecologistas llaman el 'ciclo del carbono'.
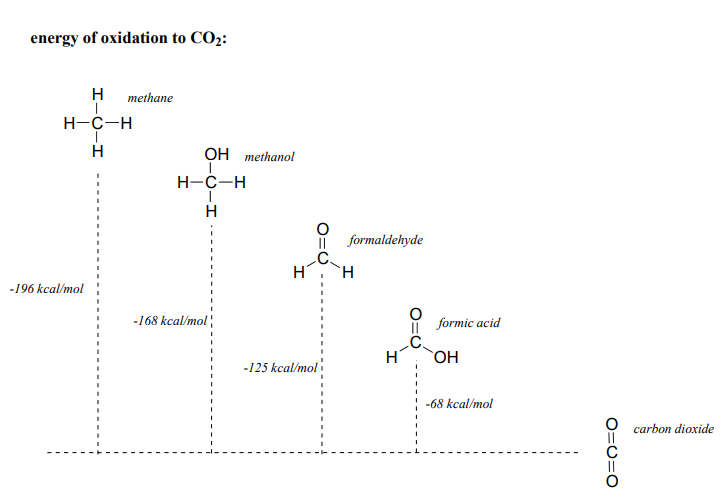
En general, cuanto más reducida es una molécula orgánica, más energía se libera cuando se oxida a\(CO_2\). Volviendo a nuestros ejemplos de un solo carbono, vemos que el metano, el compuesto más reducido, libera la mayor cantidad de energía cuando se oxida a dióxido de carbono, mientras que el ácido fórmico libera menos:
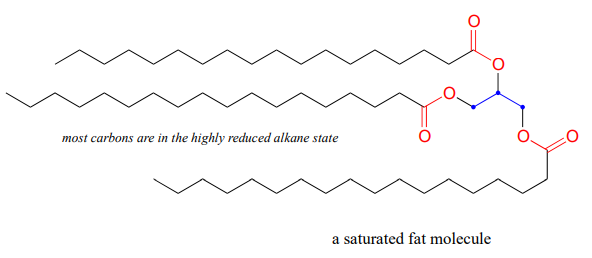
Una molécula lipídica (grasa), donde la mayoría de los carbonos están en el estado alcano altamente reducido, contiene más energía por gramo que la glucosa, donde cinco de los seis carbonos están en el estado de alcohol más oxidado (mira de nuevo la estructura de glucosa que vimos solo un par de páginas atrás).
Después de descomponer y oxidar las moléculas de azúcar y grasa para obtener energía, usamos esa energía para construir moléculas grandes y complejas (como el colesterol o el ADN) a partir de precursores pequeños y simples. Muchas vías biosintéticas son reductoras: los carbonos en los productos de biomoléculas grandes están en un estado reducido en comparación con los precursores pequeños. Observa la estructura del colesterol en comparación con la del acetato, la molécula precursora de la que se derivan todos sus átomos de carbono; se puede ver que el colesterol es en general una molécula más reducida.
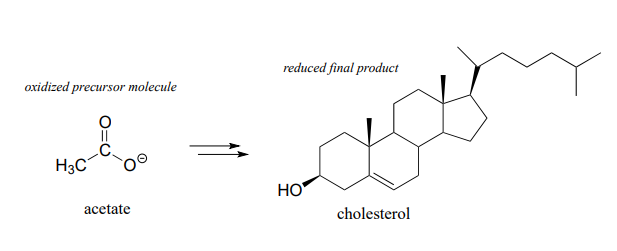
Si bien nos centramos aquí en los detalles mecanicistas de las reacciones redox orgánicas individuales involucradas en el metabolismo, si tomas un curso de bioquímica aprenderás mucho más sobre el panorama general de cómo todas estas reacciones encajan en los sistemas vivos.


