15.5: Hidrogenación de alquenos y Deshidrogenación de Alcanos
- Page ID
- 72179
Pasamos a continuación a reacciones en las que se agrega una molécula de hidrógeno al doble enlace de un alqueno, formando un alcano -y a la inversa, en la que\(H_2\) se elimina de un alcano para formar un alqueno. Muchas reacciones bioquímicas de este tipo involucran\(\alpha\), tioésteres\(\beta\) insaturados.
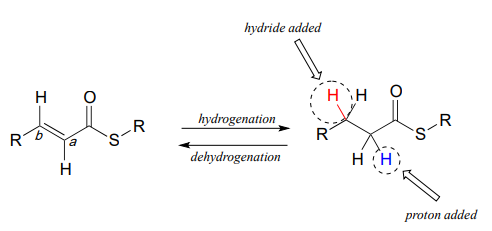
Hidrogenación alqueno
En la célula, la hidrogenación de alquenos ocurre con mayor frecuencia en las posiciones a y b con respecto a un carbonilo. Este tipo de hidrogenación de alqueno es esencialmente una adición conjugada (sección 11.4) de hidrógeno, con un ion hidruro (a menudo de\(NAD(P)H\)) acting as the nucleophile in the first step.
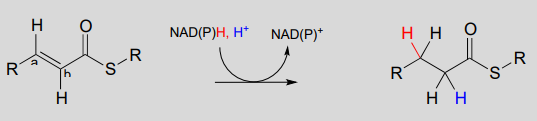
\(NAD(P)H\)-dependent hydrogenation (reduction) of an \(\alpha\), \(\beta\)-conjugated alkene:
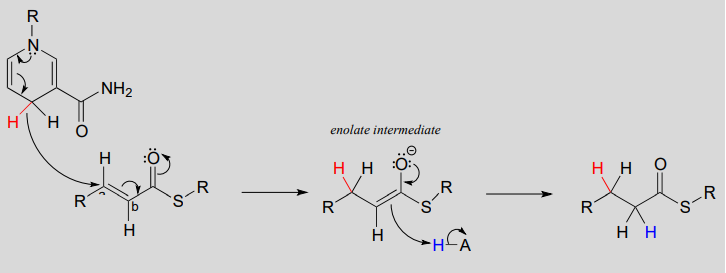
Mechanism:
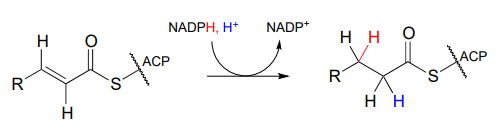
As part of the fatty acid synthesis pathway, a double bond between the a and b carbons of a fatty acid is reduced to a single bond by hydrogenation (EC 1.3.1.10). The fatty acid is attached to an acyl-carrier protein via a thioester linkage (section 11.5).
Puede ser fácil de olvidar pero importante recordar que hay mucha estereoespecificidad inherente a las reacciones bioquímicas, incluida esta, aunque no hay centros quirales involucrados. Primero, observe que el sustrato contiene un alqueno trans (E). A continuación, agreguemos algunos datos nuevos sobre la proquiralidad:
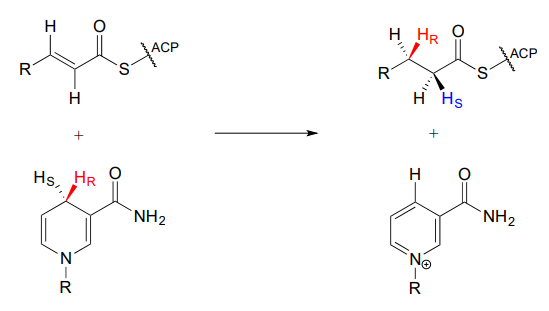
Observe que en esta reacción particular es específicamente el hidruro Pro-R en\(NADPH\) that is delivered to the substrate. Also notice that the hydride and proton are added to the same side of the alkene, and become the pro-R and pro-S hydrogen atoms, respectively, on the substrate. This level of stereospecificity, you should recall from previous discussions, stems from the highly precise positioning of substrate and cofactor within the active site of the enzyme.
Other hydrogenase enzymes are known to deliver the pro-S hydride of \(NADH\) or \(NADPH\) to their substrate, and there are many examples of biochemical conjugate addition reactions in which the nucleophile and proton are added from opposite sides. Always keep in mind that stereochemistry is a key element in the amazing diversity of biological organic reactions.
Flavin-dependent alkane dehydrogenation
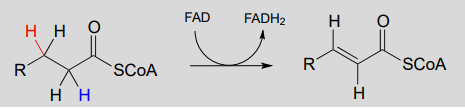
Next let's consider an alkane dehydrogenation reaction (EC 1.3.99.3) in the fatty acid degradation pathway. Here, a double bond is introduced between the \(\alpha\) and \(\beta\) carbons, with concurrent loss of a hydride ion and a proton.
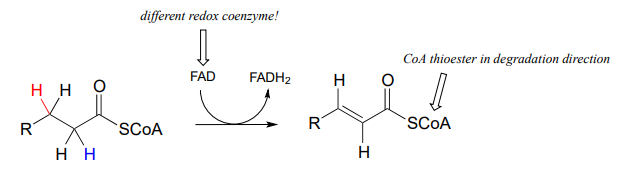
Esta reacción claramente no es lo contrario de la reacción de hidrogenación que acabamos de ver a partir de la biosíntesis de ácidos grasos. En primer lugar, debes notar que el enlace tioéster es a la coenzima A en lugar de a la proteína portadora de acilo (\(ACP\)). Más importante para esta discusión, si bien el donante de hidruro en la reacción de hidrogenación biosintética es\(NADPH\), la coenzima relevante en la dirección catabólica no es\(NAD^+\) o\(NADP^+\) -más bien, es una coenzima flavina.
El dinucleótido de flavina adenina (\(FAD\)) se compone de tres componentes: el sistema de flavina de tres anillos, fosfato de ribosa y AMP. Una forma alternativa, a la que le falta el componente AMP, se llama mononucleótido de flavina (\(FMN\)).
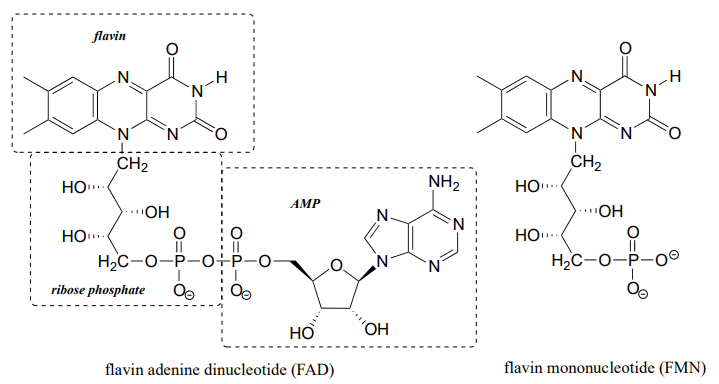
La parte reactiva de la coenzima es el grupo flavina, por lo que generalmente el resto de la molécula se abrevia con 'R'.
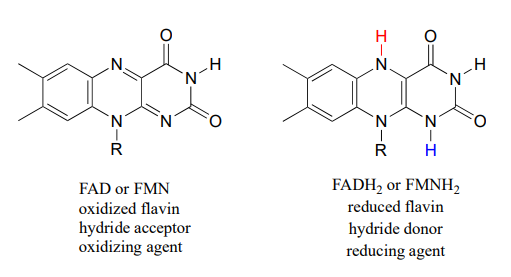
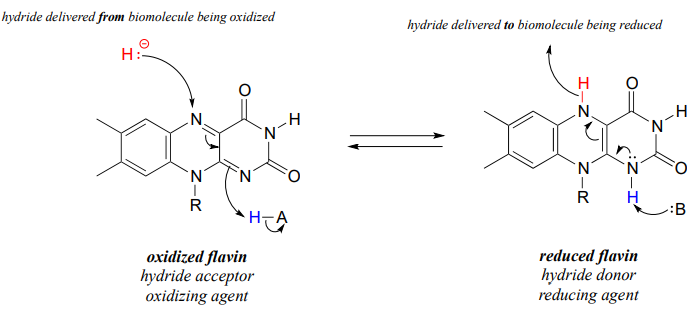
\(FAD\) and \(FMN\) are the oxidized form of flavin. The reduced (hydrogenated) forms of these cofactors are abbreviated \(FADH_2\) and \(FMNH_2\).
Las coenzimas flavinas se sintetizan en humanos a partir de riboflavina (vitamina\(B_2\)), que obtenemos de nuestra dieta (la estructura de la riboflavina es la misma que la de\(FMN\), excepto que la riboflavina carece del grupo fosfato). Observe el sistema p conjugado extendido en los tres anillos fusionados: el sistema flavina absorbe la luz en las longitudes de onda visibles y tiene un color amarillo intenso distintivo - es riboflavina, y en cierta medida\(FAD\) y\(FMN\), que le dan a la orina su color.
Al igual que las coenzimas de nicotinamida, la flavina sirve como donante o aceptor de hidruro. \(FAD\)y\(FMN\) son capaces de aceptar un ion hidruro (y un protón),\(FADH_2\) y\(FMNH_2\) a su vez pueden servir como donantes de hidruro en las reacciones de hidrogenación.
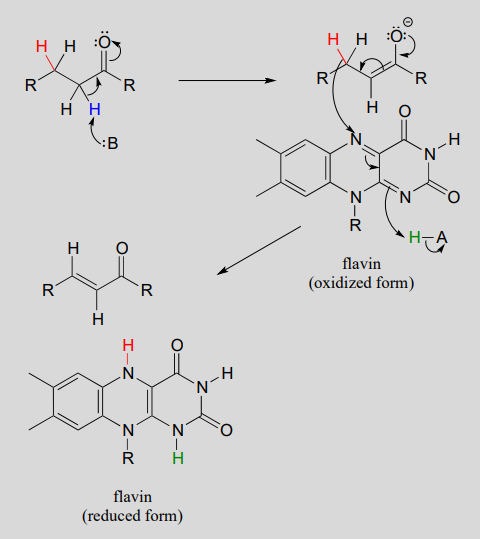
A continuación se muestra un mecanismo general para la deshidratación de un alqueno en el\(\alpha\), \(\beta \) position - notice that it is mechanistically an E1cb elimination of \(H_2\).
\(\alpha\), \(\beta\) dehydrogenation (oxidation) of an alkane:
Mechanism:
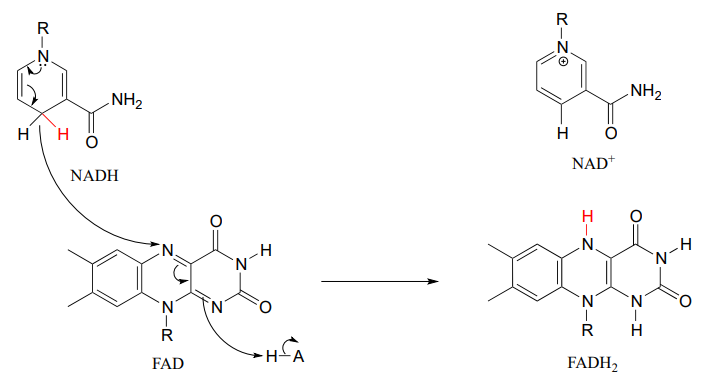
In many enzymatic reactions in which \(FADH_2\) acts as the reducing agent, the reaction cycle is completed when \(FAD\), rather than being released from the active site, is recycled back to \(FADH_2\) with the concomitant oxidation of \(NADH\).
La transferencia de iones hidruro con coenzimas flavina o nicotinamida es un proceso redox de dos electrones. Sin embargo, a diferencia de los cofactores de nicotinamida, las flavinas también son capaces de funcionar en mecanismos de transferencia de electrones simples (radicales). Volveremos brevemente a esta idea en el capítulo 16.
El fumarato se forma en una reacción de deshidrogenación de alcanos (EC 1.3.5.1) que forma parte del ciclo del ácido cítrico:
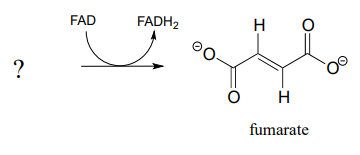
- Predecir la estructura del sustrato de partida en esta reacción
- Dibujar la estructura del intermedio enolado
La flavina reducida puede servir como donante de hidruro en algunas reacciones de hidrogenación. La degradación de la base de ARN uracilo comienza con la hidrogenación de un grupo alqueno conjugado por una enzima hidrogenasa dependiente de flavina (EC 1.3.1.2). Predecir el producto de este paso y dibujar flechas curvas para el primer paso mecanicista.


