15.4: Hidrogenación de grupos carbonilo e imina
- Page ID
- 72180
A continuación, veremos los mecanismos químicos reales involucrados en la oxidación y reducción de biomoléculas catalizadas por enzimas.
Una visión general de la hidrogenación y deshidrogenación
Muchas de las reacciones redox que encontrarás al estudiar las vías metabólicas centrales se clasifican como reacciones de hidrogenación o deshidrogenación. La hidrogenación es simplemente la adición neta de una molécula de hidrógeno (\(H_2\)) a un compuesto, en forma de un ion hidruro (\(H^-\), un protón más un par de electrones) y un protón. La hidrogenación corresponde a la reducción. Las reacciones de deshidrogenación son el proceso inverso: pérdida de un hidruro y un protón. La deshidrogenación corresponde a la oxidación.

Las reacciones de hidrogenación y deshidrogenación también se pueden llamar reacciones de transferencia de hidruro, porque un ion hidruro se transfiere de la molécula que se oxida a la que se está reduciendo. En las próximas secciones, aprenderemos sobre dos clases importantes de moléculas de coenzima que sirven aceptores de iones hidruro (agentes oxidantes) y donantes de iones hidruro (agentes reductores) en reacciones redox bioquímicas.
Tenga cuidado de no confundir los términos hy drogenación y dehy drogenación con hidratación y deshidratación - estos últimos términos se refieren a la ganancia o pérdida de agua, mientras que los primeros términos se refieren a la ganancia o pérdida de hidrógeno.
Muchos patrones mecanicistas de los que ya hemos aprendido en capítulos anteriores volverán a entrar en juego en esta discusión, siendo la única variación que aquí, un ion hidruro actuará como nucleófilo (en la dirección de hidrogenación) o como grupo saliente (en la dirección de deshidrogenación). La clave para entender estas reacciones será entender cómo un hidruro puede actuar como nucleófilo o grupo de salida.
Dinucleótido de nicotinamida adenina - una coenzima de transferencia de hidruro
Aunque aquí estamos hablando de hidruros que actúan como nucleófilos y grupos salientes, ya se sabe que los iones hidruro literales son demasiado inestables para existir como intermedios discretos en las reacciones orgánicas de las células vivas (la\(pK_a\) of \(H_2\), the conjugate acid of hydride, is about 35: a very weak acid, meaning hydride is a very strong base and not a reasonable species to propose for a biochemical reaction). As was alluded to earlier, biochemical hydrogenation/dehydrogenation steps require the participation of a specialized hydride transfer coenzyme. The most important of these is a molecule called nicotinamide adenine dinucleotide. The full structure of the oxidized form of this coenzyme, abbreviated \(NAD^+\), is shown below, with the active nicotinamide group colored blue. Because the redox chemistry occurs specifically at the nicotinamide ring (in blue in the figure below), typically the rest of the molecule is simply designated as an 'R' group.
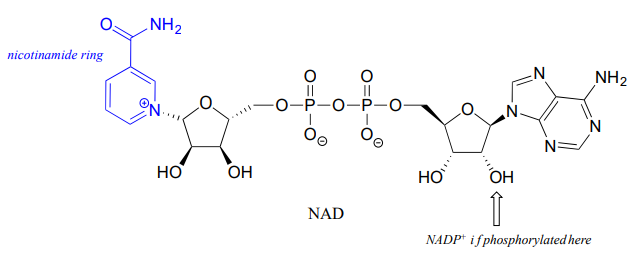
Si el grupo hidroxilo indicado por la flecha está fosforilado, se llama a la coenzima\(NADP^+\). El fosfato se encuentra lejos del anillo de nicotinamida y no participa directamente en la función de transferencia de hidruro del cofactor. Sin embargo, es importante en un contexto metabólico más amplio: como regla general, las enzimas redox involucradas en el catabolismo (la descomposición de moléculas grandes) suelen utilizar la coenzima no fosforilada, mientras que las involucradas en el anabolismo (biosíntesis de moléculas grandes a partir de precursores pequeños) utilizan la fosforilada coenzima.
\(NAD^+\)y\(NADP^+\) ambos funcionan en reacciones redox bioquímicas como aceptores de hidruro: es decir, como agentes oxidantes. Las formas reducidas de la coenzima, abreviadas\(NADH\) y\(NADPH\), sirven como donantes de hidruro: es decir, como agentes reductores.
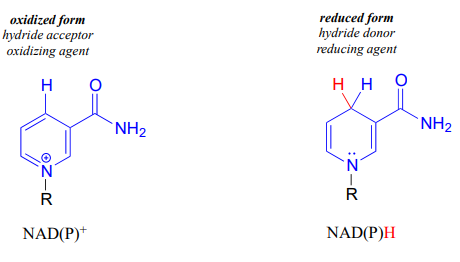
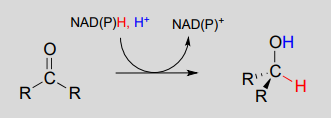
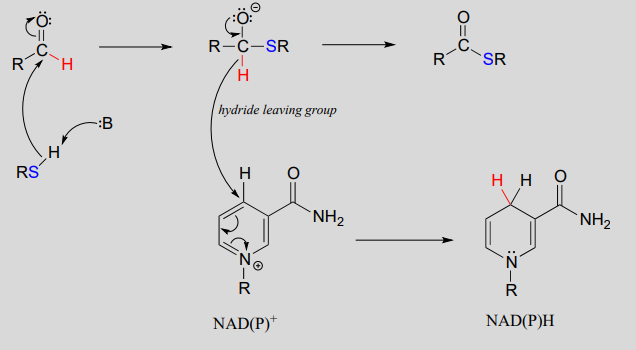
Para entender cómo funcionan las coenzimas de nicotinamida en la transferencia de hidruro, veamos un panorama general de una conversión redox reversible de una cetona a un alcohol secundario. Mecanísticamente, la reacción que estamos a punto de ver puede describirse como una adición nucleofílica a un carbonilo -un tipo de mecanismo que estudiamos en el capítulo 10- con la torsión de que la especie nucleofílica es un ion hidruro. Al inicio del ciclo de reacción, tanto el sustrato de cetona como el\(NADH\) cofactor se unen en el sitio activo de la enzima, y el carbono #4 del anillo de nicotinamida se coloca muy cerca del carbono carbonilo de la cetona.
\(NAD(P)H\)-hidrogenación dependiente (reducción) de una cetona
Mecanismo:
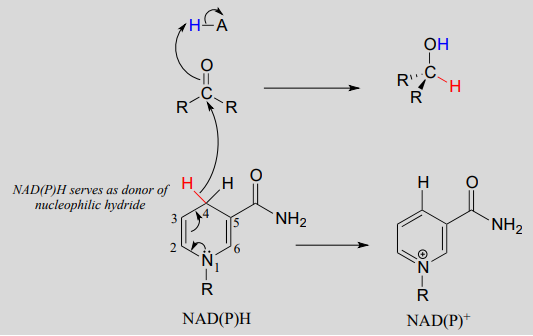
A medida que un grupo enzimático transfiere un protón al oxígeno de la cetona, el carbono carbonilo pierde densidad electrónica y se vuelve más electrófilo, y es atacado por un hidruro de\(NADH\). Debido a que el carbono #4 de\(NADH\) está unido en una proximidad tan cercana al electrófilo, este paso puede ocurrir sin generar un intermedio de ion hidruro libre; los dos electrones de hidruro se pueden representar como cambiando de un carbono a otro. Tenga en cuenta los productos de esta reacción: la cetona (que aceptó un hidruro y un protón) se ha reducido a un alcohol, y el\(NADH\) cofactor (que donó un hidruro) se ha oxidado a\(NAD^+\).
La deshidrogenación de un alcohol\(NAD^+\) es simplemente la inversa de una hidrogenación de cetona:
\(NAD(P)^+\)-dependiente de deshidrogenación (oxidación) de un alcohol
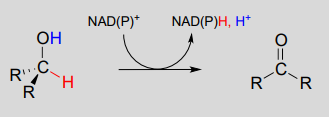
Mecanismo:
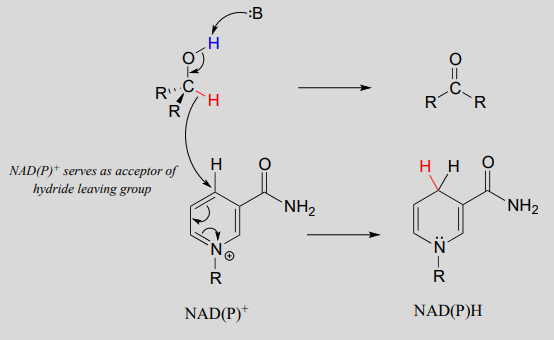
Una base enzimática posicionada por encima del carbonilo elimina un protón, y los electrones en el\(O-H\) enlace se desplazan hacia abajo y empujan hacia fuera el hidruro, que se desplaza al carbono #4 de\(NAD^+\). Tenga en cuenta que el mismo proceso con un alcohol primario produciría un aldehído en lugar de una cetona.
Dibujar mecanismos generales para:
- hidrogenación de una imina
- deshidrogenación de una amina
Acabamos de ver que cuando el nucleófilo en una etapa de adición de carbonilo nucleófilo es un ion hidruro de\(NADH\), el resultado es una reacción de hidrogenación de cetona/aldehído. Como revisión: ¿qué tipo de paso de reacción resulta cuando el nucleófilo en este proceso no es un ion hidruro sino a) un alcohol, o b) un carbono enolato?
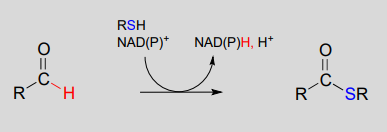
Las coenzimas nicotinamida también sirven como donadores/aceptores de hidruro en las reacciones redox que interconvierten derivados de ácidos carboxílicos y aldehídos. Obsérvese que estas reacciones pueden ser consideradas como reacciones de sustitución de acilo nucleofílico (capítulo 11) en las que el grupo nucleófilo o saliente es un ion hidruro.
Hidrogenación (reducción) dependiente de NAD (P) H de un tioéster a un aldehído:
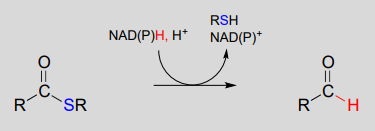
Mecanismo:
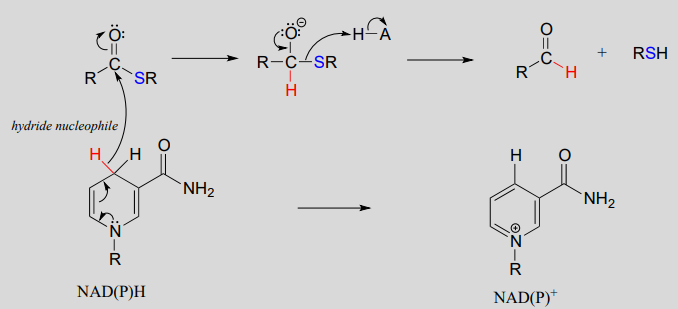
\(NAD(P)^+\)-deshidrogenación (oxidación) dependiente de un aldehído a un tioéster:
Mecanismo:
Para simplificar las cifras, a menudo se dibujan reacciones de hidrogenación y deshidrogenación con el papel de la coenzima abreviado:
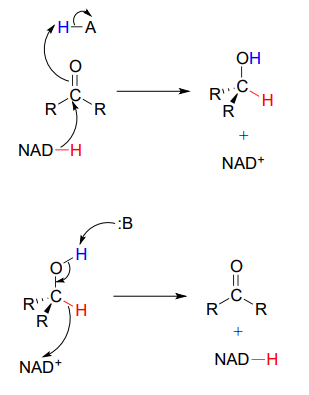
No obstante, es muy importante asegurarse de que se pueda recordar y extraer el mecanismo completo, incluido el papel de la coenzima, en este tipo de reacciones.
Un error muy común que cometen los estudiantes al aprender a dibujar mecanismos redox bioquímicos es mostrar incorrectamente las coenzimas de nicotinamida que actúan como ácidos o bases. Recuerda:\(NADH\) and \(NADPH\) are hydride donors, NOT proton donors. \(NAD^+\) and \(NADP^+\) are hydride acceptors, NOT proton acceptors.
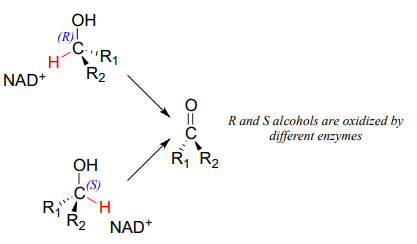
Stereochemistry of ketone hydrogenation
It should not surprise you that the stereochemical outcomes of enzymatic hydrogenation / dehydrogenation steps are very specific. Consider the hydrogenation of an asymmetric ketone: In the hydrogenation direction, attack by the hydride can occur from either the re or the si face of an asymmetric ketone (see section 10.1), leading specifically to the S or R alcohol.
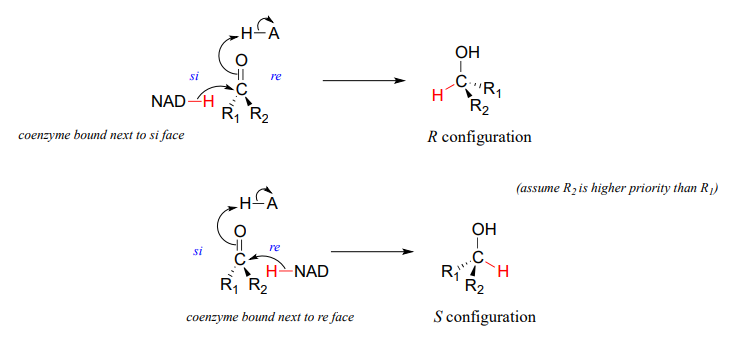
La configuración estereoquímica del producto depende de qué lado del sustrato cetónico se une la\(NAD(P)H\) coenzima en el sitio activo. Cualquier enzima dada catalizará su reacción con uno de estos dos resultados estereoquímicos, no ambos.
Las consideraciones estereoquímicas también se aplican en la dirección de la deshidrogenasa: en general, las enzimas catalizan específicamente la oxidación de un alcohol R o S, pero no de ambos.
Durante un entrenamiento intenso, el ácido láctico se forma en el tejido muscular como resultado de la reducción enzimática de un grupo cetona en la molécula precursora (EC 1.1.1.27). Es el lactato al que puedes culpar por los músculos doloridos que sientes al día después de un entrenamiento.
- ¿Qué cara de la cetona está posicionada la coenzima junto al sitio activo de la enzima?
Ejemplos de hidrogenación bioquímica de carbonilo/imina
Ahora que hemos cubierto lo básico, veamos algunos ejemplos reales de reacciones de hidrogenación y deshidrogenación.
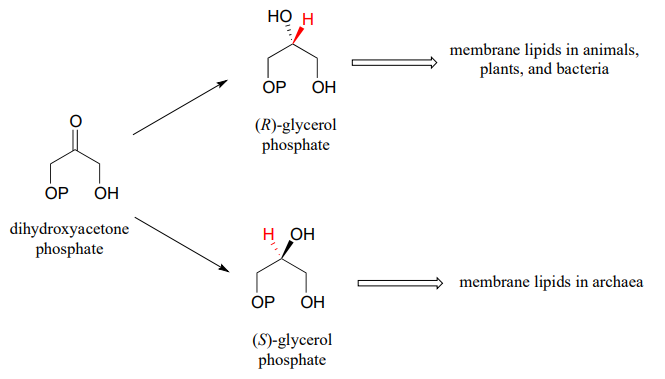
La glicerol fosfato deshidrogenasa (EC 1.1.1.8) cataliza una de las etapas químicas finales en la descomposición de las moléculas de grasa. La enzima oxida específicamente (R) -glicerol fosfato a dihidroxiacetona fosfato. El fosfato de (S) -glicerol no es un sustrato para esta enzima. J. Mol. Biol. 200 6, 357, 858 (estructura cristalina humana)
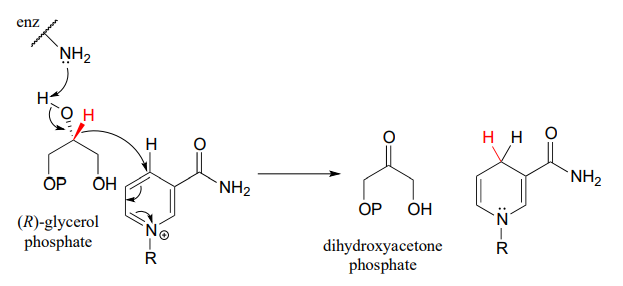
La reacción inversa (catalizada por la misma enzima) convierte el fosfato de dihidroxiacetona en fosfato de (R) -glicerol, que sirve como punto de partida para la biosíntesis de moléculas lipídicas de membrana (ver sección 1.3).
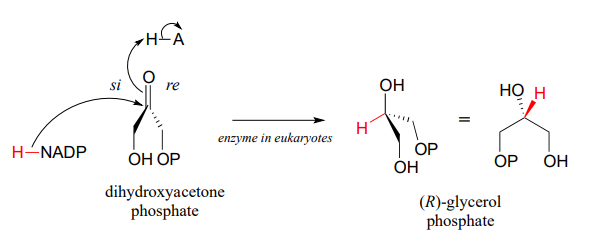
Los experimentos de cristalografía de rayos X revelan que en el sitio activo de la glicerol fosfato deshidrogenasa, un catión de zinc (\(Zn^{+2}\)) is coordinated to the oxygen atom of the carbonyl/alcohol group. How does this contribute to catalysis of the reaction?
While the cell membranes of animals, plants, and bacteria are made from lipids with the R stereochemistry exclusively, archaeal microbes (the so-called 'third kingdom of life) are distinguished in part by the S stereochemistry of their membranes.
higo 27
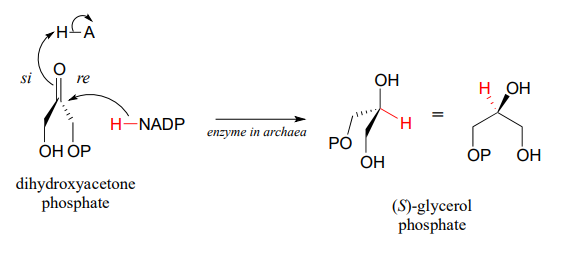
Las arqueas tienen una enzima que cataliza la hidrogenación de la dihidroxiacetona con la estereoquímica opuesta en comparación con la enzima análoga en bacterias y eucariotas. Esta enzima arqueal fue identificada y aislada en 1997.
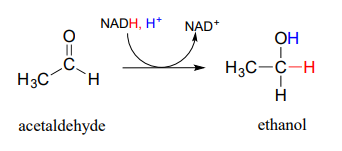
En una reacción que es relevante para las personas que disfrutan de la ocasional 'bebida adulta', un\(NADH\)-dependent enzyme (EC 1.1.1.1) in brewer's yeast produces ethanol by reducing acetaldehyde. This is the final step in the process by which yeast ferment glucose to ethanol.
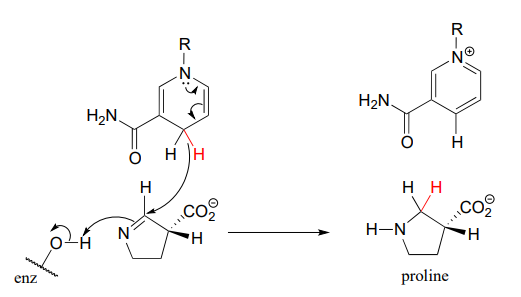
La reacción a continuación, que es la etapa final en la biosíntesis de prolina (EC 1.5.1.2), es un ejemplo de una reducción enzimática de una imina a una amina. J. Mol. Biol. 2005, 354, 91.
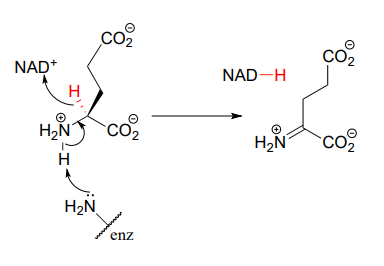
Este paso en la descomposición de los aminoácidos glutamato (EC 1.4.1.2) proporciona un ejemplo de la oxidación de una amina a una imina: Structure 1999, 7, 769.
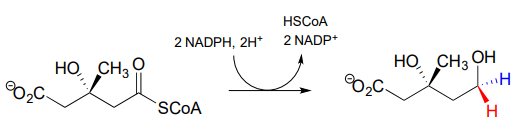
La reacción de 'doble reducción' a continuación (EC 1.1.1.34) forma parte de la vía biosintética de los isoprenoides, que eventualmente conduce al colesterol en humanos.
En esta reacción, un tioéster se reduce primero a un aldehído en las etapas 1a y 1b:
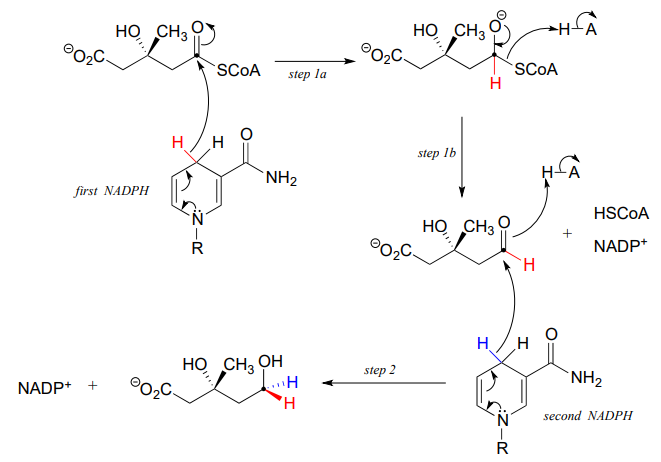
Luego, en la etapa 2, el aldehído se reduce a su vez por la misma enzima (y una segunda\(NADPH\) that enters the active site) to a primary alcohol. This enzyme is inhibited by atorvastatin and other members of the statin family of cholesterol-lowering drugs. Atorvastatin, marketed under the trade name Lipitor by Pfizer, is one of the all-time best-selling prescription medications.
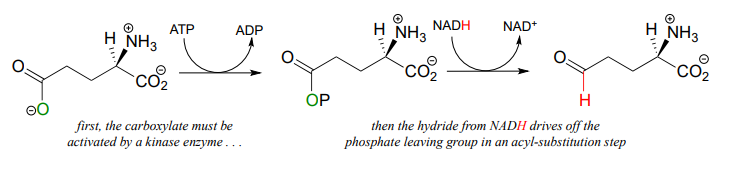
Recall from chapter 11 that carboxylates are not reactive in acyl substitution steps, so it follows that they cannot be directly reduced to aldehydes by an enzyme in the same way that thioesters can. However, a carboxylate can be converted to its 'activated' acyl phosphate form (section 11.4), which can then be hydrogenated. An example of this is found in a two-reaction sequence found in amino acid metabolism (EC 2.7.2.11; EC1.2.1.41).
La gliceraldehído-3-fosfato deshidrogenasa (EC 1.2.1.12), una enzima clave en la vía de la glucólisis, proporciona un ejemplo de la oxidación de un aldehído a un tioéster, en este caso un enlace tioéster entre el sustrato y un residuo de cisteína en el sitio activo de la enzima. En la segunda fase de la reacción, el intermedio tioéster se hidroliza para liberar el producto carboxilato.
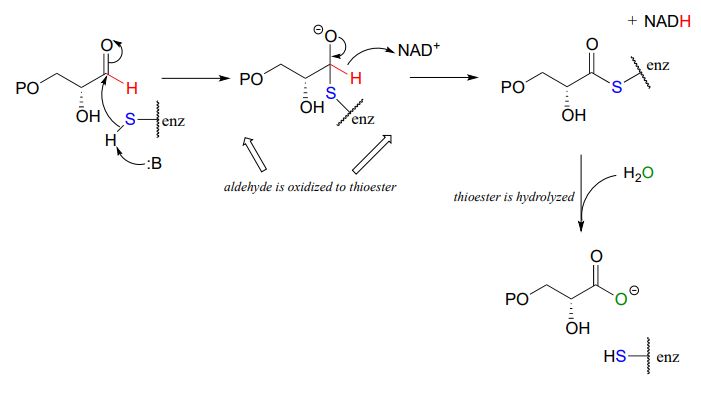
A continuación se muestra el paso final en la biosíntesis del aminoácido histidina (EC 1.1.1.23). Rellena las especies que se indican con signos de interrogación. Proc. Natl. Acad. Sci. U.S.A. 2002, 99, 1859
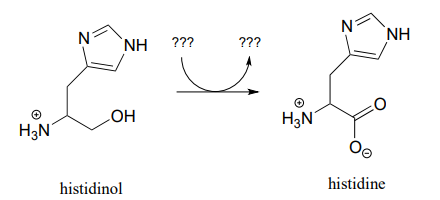
Dibujar un mecanismo probable para la conversión de glucosa en sorbitol, proceso que ocurre en el hígado. No abreviar la estructura del anillo de nicotinamida.
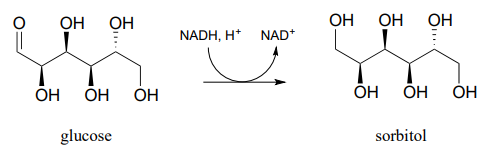
Reducción de cetonas y aldehídos en el laboratorio
Aunque nuestro enfoque en este libro son las reacciones orgánicas biológicas, es interesante señalar que los químicos orgánicos sintéticos frecuentemente realizan reacciones de hidrogenación en el laboratorio que son similares en muchos aspectos a las reacciones dependientes de NAD (P) H que acabamos de estudiar. Un reactivo llamado borohidruro de sodio (\(NaBH_4\)) se usa muy comúnmente, a menudo en disolvente metanol, para reducir las cetonas y aldehídos a alcoholes. El reactivo es esencialmente un equivalente de laboratorio de\(NADH\) (o\(NADPH\)): sirve como fuente de iones hidruro nucleofílicos. El borohidruro de sodio es un reactivo selectivo en el sentido de que reducirá las cetonas y aldehídos pero no los derivados de ácido carboxílico como los ésteres (recuerde de la sección 11.2 y la sección 11.3 que los carbonos carbonilo de los derivados de ácido carboxílico son electrófilos menos potentes que los carbonos carbonílicos de las cetonas y aldehídos). A diferencia de las reacciones de hidrogenación enzimática que vimos anteriormente, la reducción de cetonas asimétricas con borohidruro de sodio generalmente da como resultado una mezcla racémica 50:50 de los enantiómeros R y S del producto alcohólico.
Los químicos orgánicos sintéticos tienen a su disposición una amplia gama de otros reactivos reductores y oxidantes con especificidades y propiedades variables, muchos de los cuales aprenderá si toma un curso de síntesis de laboratorio.
El alcanfor se puede reducir fácilmente con borohidruro de sodio. Sin embargo, la mezcla de alcoholes estereoisoméricos que resulta no es 50:50.
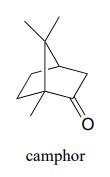
- Dibujar los dos estereoisómeros de los productos alcohólicos de esta reacción, y explicar por qué no se forman en una proporción 50:50.
- ¿Qué técnica analítica -\(^1H-NMR\)\(IR\),\(UV\),, o\(MS\) - podría utilizarse mejor para determinar la relación de los estereoisómeros en la mezcla de productos? Describir cómo se podría lograr este análisis.


