15.E: Reacciones de Oxidación y Reducción (Ejercicios)
- Page ID
- 72165
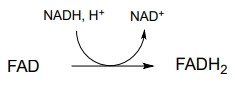
P15.1: Mostrar un mecanismo para cada una de las reacciones redox a continuación. No abreviar las partes reactivas de la coenzima redox.
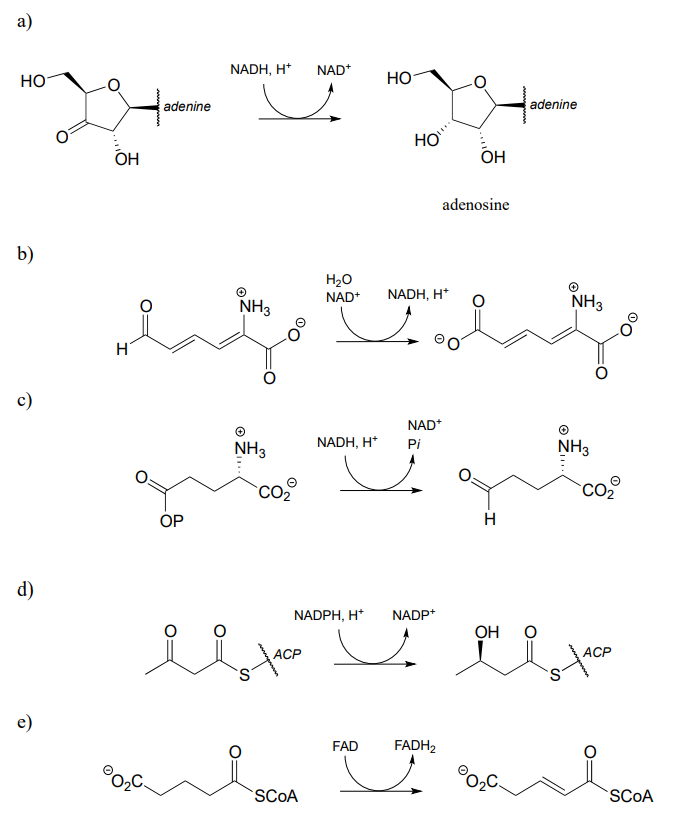
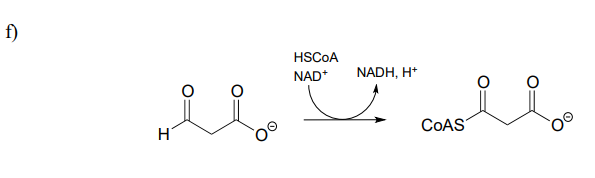
g) regeneración de flavina reducida por\(NADH\)):
h) En la reacción (a) ¿cerca de qué cara del sustrato se une el cofactor en el sitio activo?
i) En la reacción (d) ¿cerca de qué cara del producto se une el cofactor en el sitio activo?
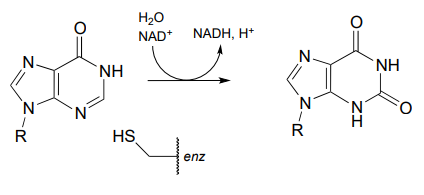
P15.2: En las reacciones siguientes ((EC 2.7.2.4; EC 1.2.1.11), se altera la cadena lateral del aspartato, pero la cadena peptídica principal no se ve afectada. Mostrar la estructura más probable de las especies A y B.
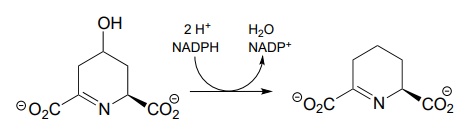
P15.3: Proponer mecanismos completos para las siguientes reacciones.
- (EC 1.3.1.26, de biosíntesis de lisina)
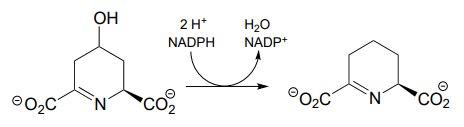
- (EC 1.1.1.205, a partir de la biosíntesis de ribonucleótidos de guanosina) El mecanismo involucra un intermedio enzima-sustrato covalente ligado a cisteína.
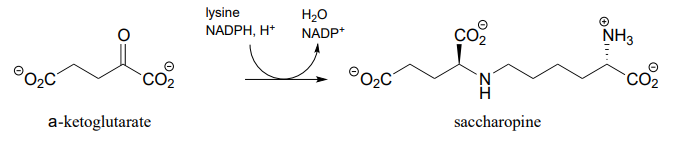
P15.4: El primer paso en la vía de degradación de lisina es una condensación reductora con a-cetoglutarato para formar un intermedio llamado sacaropina. (EC 1.5.1.8)
- Proponer un mecanismo para esta transformación.
- La sacaropina (ver parte (a) anterior) se descompone para producir glutamato y un segundo producto que contiene un grupo aldehído. Predecir la estructura de este segundo producto y proponer un mecanismo probable para la reacción que involucra e imina intermedia. (EC 1.5.1.10)
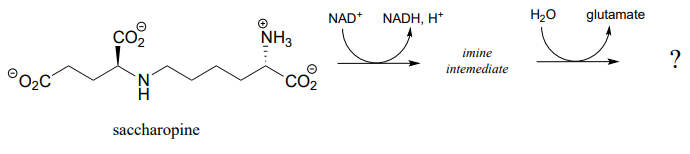
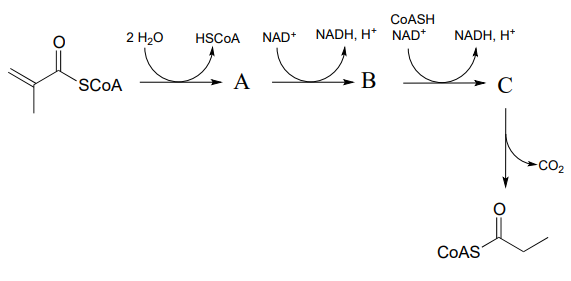
P15.5: Predecir las estructuras de las especies A y B en la ruta siguiente.
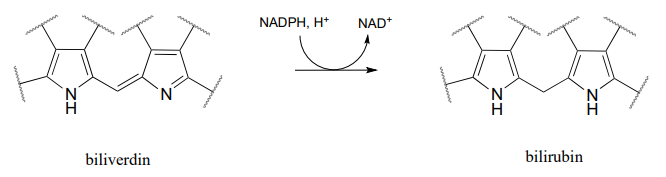
P15.6: La bilirrubina, la molécula responsable del color amarillento de los moretones, se forma a partir de la hidrogenación\(NADPH\) dependiente de un doble enlace en la biliverdina (EC 1.3.1.24), que es un producto de la degradación del hemo (el hemo es una coenzima que contiene hierro en la proteína sanguínea portadora de oxígeno hemoglobina). Dibuje un mecanismo probable para esta reacción.
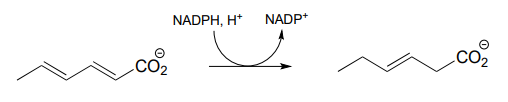
P15.7: Dibuja un mecanismo probable para cada una de las reacciones a continuación.
- De la oxidación de ácidos grasos poliinsaturados:
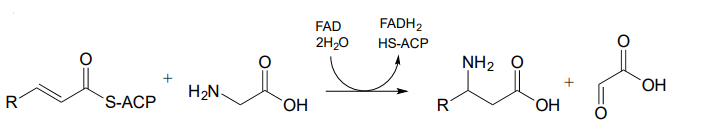
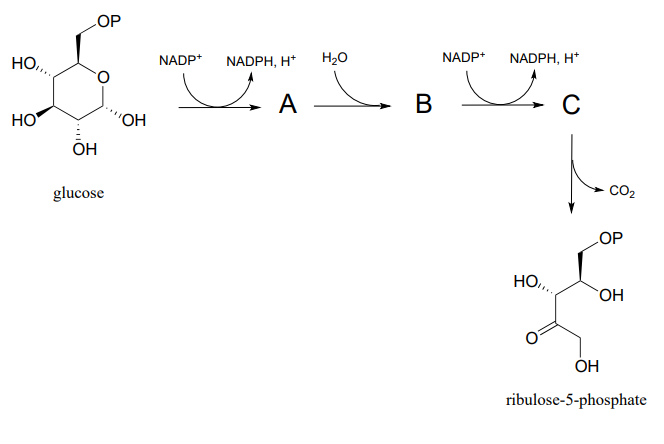
P15.8: Predecir las estructuras de los intermedios de la ruta A, B y C:
P15.9: Una enzima llamada DsBA (EC1.8.4.2) es responsable de la formación de enlaces disulfuro en proteínas bacterianas. El proceso, que puede considerarse como un 'intercambio disulfuro', implica la escisión de un enlace disulfuro entre dos cisteínas de sitio activo en DsBA. Se logra a través de dos\(S_N2\) desplazamientos sucesivos.
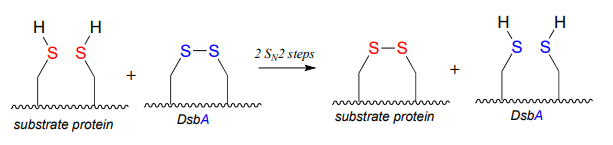
DsBA se devuelve entonces a su estado de partida (disulfuro) a través de una segunda reacción de intercambio de disulfuro con otra proteína llamada DsbB:
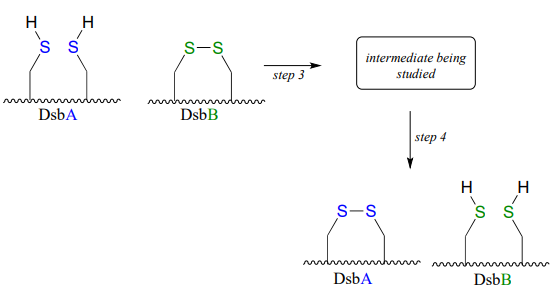
Los científicos estaban interesados en estudiar las especies intermedias formadas en el paso 3, pero encontraron que es muy efímera y difícil de aislar. Para abordar este problema, realizaron la reacción con un análogo sintético de DsbB que contenía un aminoácido de bromoalanina antinatural en lugar de una de las cisteínas del sitio activo.
- Dibujar un mecanismo completo para la reacción de intercambio de disulfuro entre DsBA y DsbB.
- Mostrar cómo el análogo de DsbB que contiene bromoalanina permitió el aislamiento de un intermedio que se asemeja al intermedio verdadero de corta duración. (J. Am. Chem. Soc. 2004, 126, 15060; J. Nat. Prod. 2001, 64, 597).
P15.10:
- En el capítulo 16 aprenderemos cómo el ascorbato (vitamina C) actúa como antioxidante 'depurador de radicales' para proteger nuestras células del daño por especies de radicales libres. Cuando el ascorbato barre un radical, termina siendo convertido en deshidroascorbato. Un posible destino metabólico del deshidroascorbato es reciclarse de nuevo a ascorbato a través de una reacción libre de enzimas con glutatión. Biocemística 1999, 38, 268.
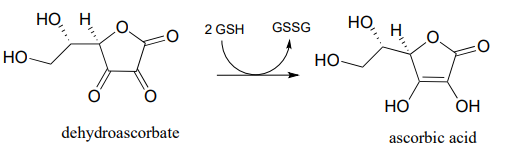
Sugerir un mecanismo probable para la reacción libre de enzimas.
- En la introducción al capítulo 16, aprenderemos que la mayoría de los animales -pero no los humanos- son capaces de sintetizar su propio ascorbato. Los humanos no pueden sintetizar vitamina C porque nos falta la enzima para el paso final en la vía biosintética, la gulonolactona oxidasa:
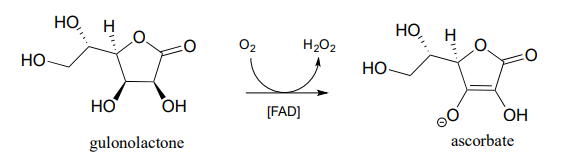
Esta enzima\(FAD\) se utiliza como agente oxidante, y\(FADH_2\) se oxida de nuevo\(FAD\) al final del ciclo catalítico por oxígeno molecular, con peróxido de hidrógeno como producto secundario. Dibuje un mecanismo probable que muestre cómo la gulonolactona se convierte en ascorbato y cómo\(FAD\) se regenera.
- La artemisinina es un compuesto natural con propiedades antipalúdicas demostradas. Se cree que actúa agotando la reserva de flavina reducida del microbio causante de la paludismo, alterando así el equilibrio redox. La reacción relevante se muestra a continuación:
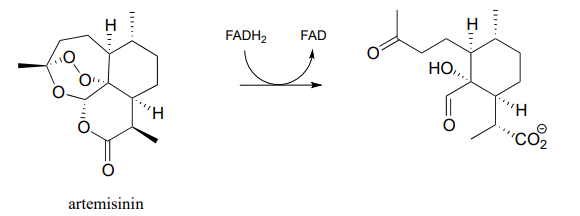
Dibuja flechas mecanicistas para el paso como se muestra arriba. (Moléculas 2010, 15, 1705)
- Dibujar el paso mecanicista en la reacción a continuación en la que se forma el enlace C-O indicado por la flecha en la siguiente figura.
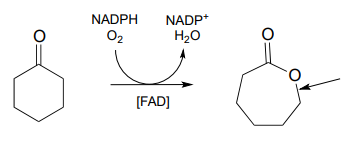
P15.11: Los metanógenos son una clase de microorganismos en el dominio arqueas que habitan una diversidad de ambientes anaerobios (carentes de oxígeno), desde los intestinos de los humanos, hasta el barro pantanoso, hasta la base de respiraderos de agua caliente de alta mar. Obtienen energía al reducir el dióxido de carbono a metano:
\[CO_2 + 4H_2 \rightarrow CH_4 + 2H_2O + \text{energy}\]
La metanogénesis, al igual que la oxidación de la glucosa en animales, no se logra en una sola reacción; requiere de una larga serie de pasos enzimáticos, e implica la participación de varias coenzimas únicas (si te interesa aprender más, consulta FEMS Microbiol. Rev. 1999, 23, 13 para una revisión detallada de las reacciones enzimáticas de la metanogénesis).
La oxidación del metano a dióxido de carbono cuando se quema gas natural para calentar tu casa es obviamente un proceso exergónico. ¿Cómo entonces es posible que reducir el dióxido de carbono a metano también sea exergónico? Explique.
Problemas de predicción de rutas multipaso
En los capítulos 12 y 13, se nos presentó el reto de trazar posibles transformaciones de varios pasos utilizando el enfoque de la retrosíntesis, donde partimos de la molécula más compleja y la desarmamos paso a paso. Estos problemas han implicado necesariamente transformaciones hipotéticas y generalizadas, porque muchos de los tipos de reacción involucrados en transformaciones bioquímicas reales aún no nos eran familiares.
Ahora hemos llegado a un punto en nuestro estudio de la reactividad orgánica donde podemos observar una ruta metabólica real y probablemente reconocer la mayoría de las reacciones que tienen lugar, por lo que estamos listos para intentar trazar rutas metabólicas reales.
Antes de sumergirnos, es posible que desee volver al intercapítulo de la retrosíntesis y revisar los elementos clave del enfoque retrosintético. Puede (o no) también necesitar un poco más de práctica con algunos problemas más simples, más cortos, hipotéticos, similares a lo que trabajamos en los últimos tres capítulos pero incorporando algunas de las reacciones redox que acabamos de aprender. Éstas se proporcionan en los problemas 15.12 y 15.13 siguientes.
Como antes, tu trabajo consiste en dibujar un 'diagrama de trayectorias' para cada transformación, usando la convención 'arrow in-arrow out' para indicar el papel de otros participantes necesarios en cada reacción, como ATP\(NADH\), agua u otra molécula orgánica. Un ejemplo de una ruta simple de dos pasos se proporciona en el problema 15.12 a continuación. Una vía de tres pasos, por supuesto, mostraría dos compuestos intermedios.
Recuerde, lo más importante es que su vía propuesta sea químicamente razonable, es decir, cada reacción hipotética que proponga debe ser muy similar a un patrón de reacción que hemos visto en los capítulos 8-15. Deberías poder poner un nombre en cada paso: por ejemplo, 'el paso 1 es una condensación de Claisen; el paso 2 es una reducción de cetona', y así sucesivamente.
También recuerda que generalmente no hay una forma correcta de abordar problemas como este: son acertijos para resolver, y el éxito dependerá en gran parte de tener una comprensión sólida de las 'herramientas' químicas disponibles para nosotros: en otras palabras, los tipos de reacciones bioquímicas que hemos estado estudiando, empezando por sustituciones nucleofílicas en el capítulo 8.
P15.12: Transformaciones hipotéticas de 2 pasos:
Se esperaría que cada una de las transformaciones generalizadas a continuación requiriera dos etapas enzimáticas. Dibuje un diagrama de ruta razonable para cada transformación.
Ejemplo:
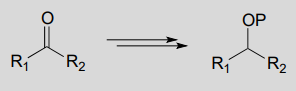
Diagrama:
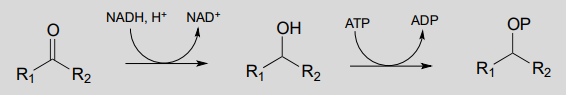
El primer paso es una reducción/hidrogenación de cetona dependiente de nicotinamina, y la etapa 2 es la fosforilación dependiente de ATP (es decir, una reacción de quinasa). Tenga en cuenta que el agente reductor en el primer paso también podría ser\(NADPH\))
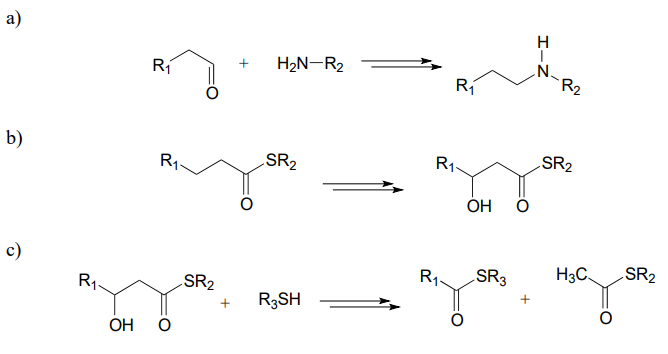
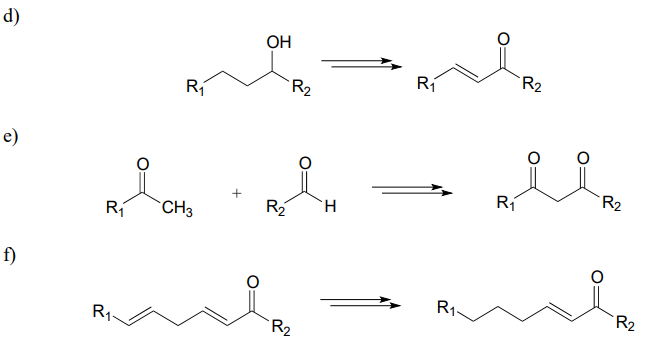
P15.13: Transformaciones hipotéticas de 3 pasos:
Se esperaría que cada una de las transformaciones generalizadas a continuación requiriera tres etapas enzimáticas. Dibuje un diagrama de ruta razonable para cada transformación.
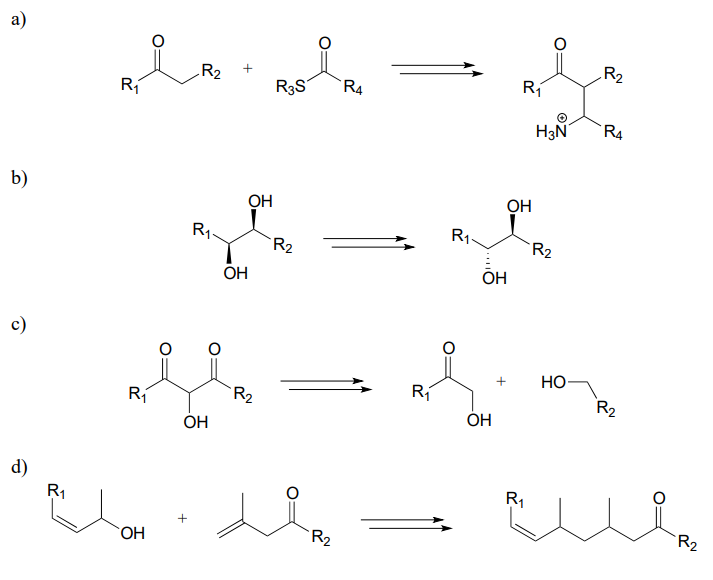
P15.14: Ahora, intentemos predecir los pasos de algunas vías metabólicas reales. Para cada uno, dibuje un diagrama de ruta completo. Según sea necesario, use cualquiera de las coenzimas que hemos estudiado, agua y amoníaco.
Nota: ¡probablemente los encontrará bastante desafiantes! No esperes poder resolverlos en unos minutos, más bien, piensa en ellos como acertijos para trabajar a lo largo de un periodo de tiempo, compartiendo ideas y estrategias con los compañeros de clase. Recuerde, si un lado de la transformación es más grande o más complejo, comience ahí y trabaje hacia las moléculas más simples. También es una buena idea, cuando corresponda, iniciar el proceso mediante a) contar carbonos a cada lado de la transformación, y b) identificar el enlace clave que se forma (o se rompe) en la transformación.
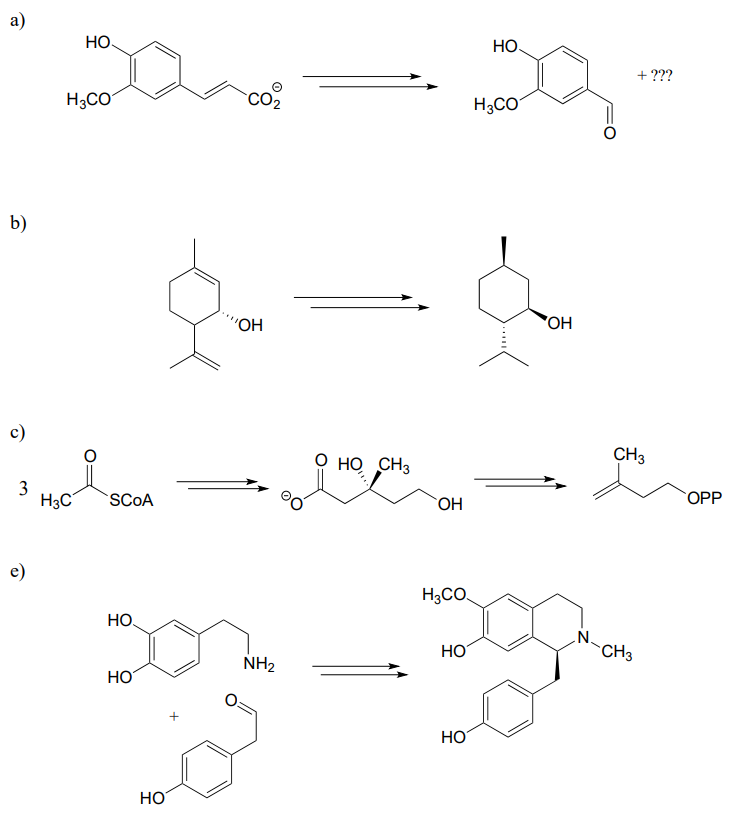
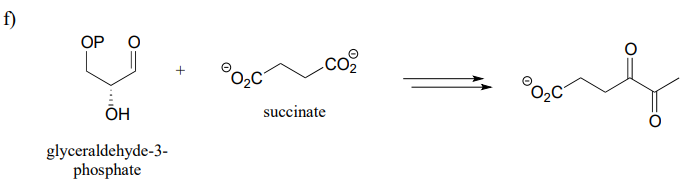
P15.15: Proponer un diagrama de vías para cada una de las vías metabólicas a continuación. Tenga en cuenta que algunas vías contienen pasos que no le resultarán familiares y, por lo tanto, ya se proporcionan.
- un ciclo de biosíntesis de ácidos grasos:
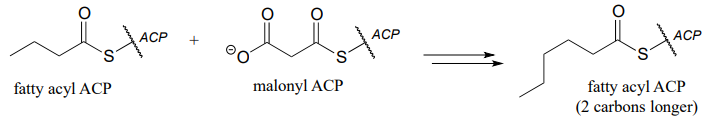
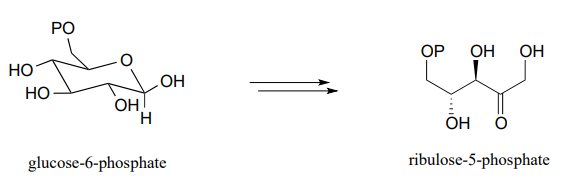
- un ciclo de degradación de ácidos grasos:
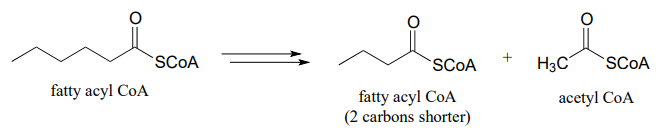
- Los diabéticos y las personas que adoptan una dieta extremadamente baja en carbohidratos a veces tienen aliento que huele a acetona, debido a la formación de 'cuerpo cetona' que ocurre cuando el acetil-\(CoA\) de la oxidación de ácidos grasos (ver parte (b) anterior) no es capaz de entrar en el ciclo del ácido cítrico. Dibuje un diagrama de ruta que muestre cómo tres moléculas de acetilo en exceso se\(CoA\) combinan para formar acetona (las tres\(CoA\) moléculas de acetilo primero se unen entre sí, pero una queda al final del proceso).
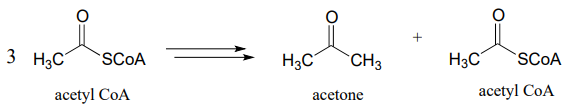
- Vía de pentosa fosfato (rama oxidativa):
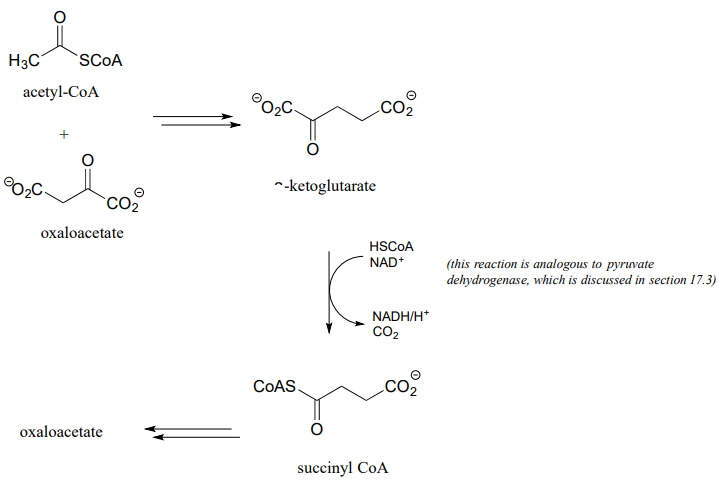
- Ciclo del ácido cítrico (Krebs):
- biosíntesis de prolina:
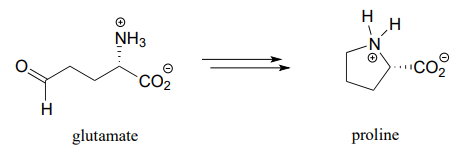
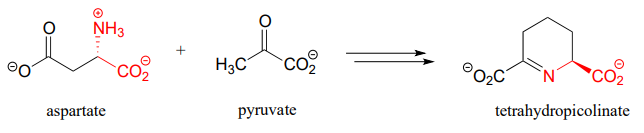
- Primera mitad de la biosíntesis de lisina:
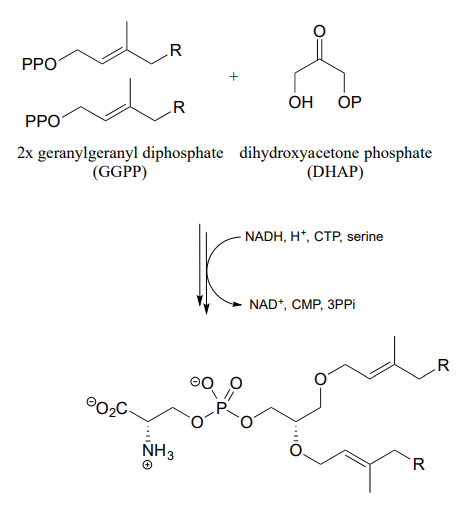
- De la biosíntesis de lípidos de membrana en arqueas: J. Bacteriol. 2003, 185, 1181