16.3: Reacciones en cadena de radicales
- Page ID
- 72074
Debido a su alta reactividad, los radicales libres tienen el potencial de ser herramientas químicas extremadamente poderosas, pero como veremos en este capítulo, también pueden ser extremadamente dañinos en un contexto biológico/ambiental. La clave para entender muchos tipos de reacciones radicales es la idea de una reacción radical en cadena.
Las reacciones radicales en cadena tienen tres fases distintas: iniciación, propagación y terminación. Utilizaremos un ejemplo bien conocido, la halogenación de un alcano como el etano, para ilustrar. La reacción general es:
\[CH_3CH_3 + Cl_2 \underset{h\nu\: or\: \Delta }{\rightarrow} CH_3CH_2Cl + HCl\cdots h\nu \text{ means light }\Delta \text{ means heat}\]
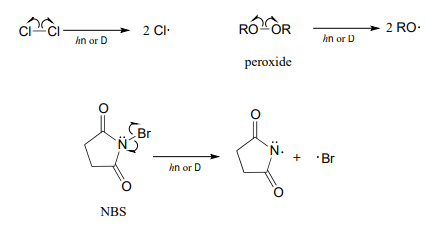
La fase de iniciación en una reacción radicalaria en cadena implica la escisión homolítica de un enlace sencillo débil en un compuesto no radical, dando como resultado dos especies radicales como productos.
A menudo, el calor o la luz proporcionan la energía necesaria para superar una barrera energética para este tipo de eventos. La etapa de iniciación en la halogenación de alcanos es la homólisis del cloro molecular (\(Cl_2\)) en dos radicales de cloro. Tenga en cuenta que prácticamente todas las especies radicales, incluidos los radicales cloro, son altamente reactivas.
\[Cl\curvearrowleft \curvearrowright Cl \rightarrow 2Cl\]
La fase de propagación es la parte 'cadena' de las reacciones en cadena.
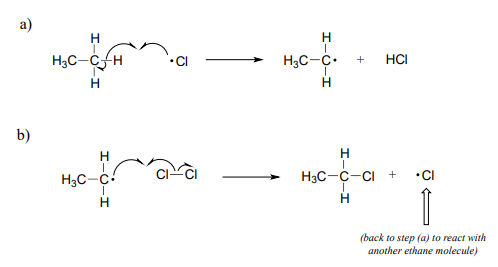
Una vez que se genera un radical libre reactivo (radical cloro en nuestro ejemplo) en la fase de iniciación, reaccionará con compuestos no radicales relativamente estables para formar una nueva especie radical. En la halogenación de etano, un radical cloro generado en la etapa de iniciación reacciona primero con etano en una etapa de abstracción de hidrógeno, generando\(HCl\) y un radical etilo (parte a anterior). Entonces, el radical etilo reacciona con otra\(Cl_2\) molécula (no radical), formando el producto cloroetano y regenerando un radical cloro (parte b anterior). Este proceso se repite una y otra vez, ya que los radicales de cloro formados en la parte (b) reaccionan con moléculas de etano adicionales como en la parte (a).
La fase de terminación es una etapa de combinación radical, donde dos especies radicales chocan y reaccionan entre sí para formar un producto no radical y 'romper la cadena'. En nuestro ejemplo de cloración de etano, un posible evento de terminación es la reacción de un radical cloro con un radical etilo para formar cloroetano.
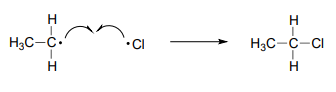
Dibujar dos etapas alternativas de terminación de cadena en la reacción en cadena de cloración de etano. ¿Cuál conduce a un producto no deseado?
Debido a que las especies de radicales son tan reactivas y de corta duración, su concentración en la mezcla de reacción en cualquier momento dado es muy baja en comparación con los componentes no radicales como etano y\(Cl_2\). Thus, many cycles of the chain typically occur before a termination event takes place. In other words, a single initiation event leads to the formation of many product molecules.
Compounds which readily undergo homolytic cleavage to generate radicals are called radical initiators. As we have just seen, molecular chlorine and bromine will readily undergo homolytic cleavage to form radicals when subjected to heat or light. Other commonly used as radical initiators are peroxides and \(N\)-bromosuccinimide (NBS).