16.2: Visión general de las reacciones de un solo electrón y los radicales libres
- Page ID
- 72040
Comenzando con las reacciones ácido-base en el capítulo x y continuando por los capítulos sobre sustitución nucleofílica, adición de carbonilo, sustitución de acilo, química de a-carbono y reacciones electrofílicas, hemos estado estudiando mecanismos de reacción en los que ambos electrones en un enlace covalente o par solitario se mueven en el misma dirección. En este capítulo, aprendemos sobre reacciones en las que los pasos clave involucran el movimiento de electrones individuales. El movimiento de un solo electrón se representa mediante flechas de “anzuelo” de púas simples (a diferencia de las conocidas flechas de doble púas que hemos estado usando a lo largo del libro para mostrar el movimiento de dos electrones).

Los mecanismos de un solo electrón implican la formación y posterior reacción de especies de radicales libres, intermedios altamente inestables que contienen un electrón desapareado. Los radicales libres a menudo se forman a partir de la escisión homolítica, un evento en el que los dos electrones en un enlace covalente de ruptura se mueven en direcciones opuestas. El enlace en el cloro molecular, por ejemplo, está sujeto a escisión homolítica cuando el cloro se somete a calor o luz. El resultado son dos radicales cloro. Obsérvese que cada radical tiene una carga formal de cero.
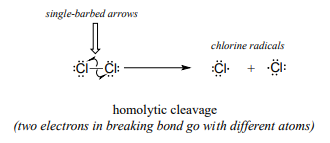
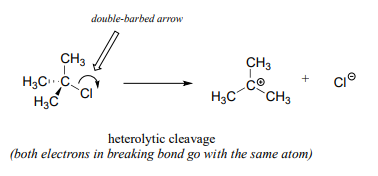
En contraste, esencialmente todas las reacciones que hemos estudiado hasta ahora involucran eventos de ruptura de enlaces en los que ambos electrones se mueven en la misma dirección: esto se llama escisión heterolítica.
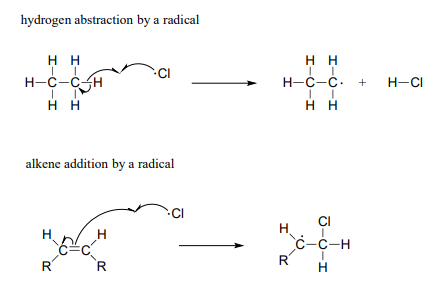
Otras dos reacciones de escisión homolítica que veremos en este capítulo pueden describirse como 'abstracción de átomos de hidrógeno radicales' y 'adición radical alqueno':
Los mecanismos de reacción de un solo electrón implican la formación de especies radicales, y en las reacciones orgánicas estos suelen ser radicales de carbono. Un radical de carbono es\(sp^2\) hybridized, with three s bonds arranged in trigonal planar geometry and the single unpaired electron occupying an unhybridized p orbital. Contrast this picture with a carbocation reactive intermediate, which is also \(sp^2\) hybridized with trigonal planar geometry but with an empty p orbital.
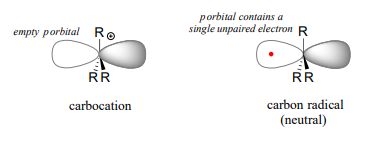
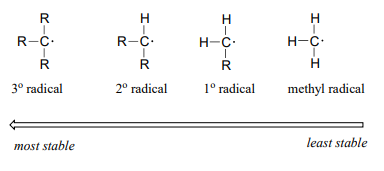
When we studied electrophilic reactions in chapter 14, a major concern when evaluating possible mechanisms was the stability of any carbocation intermediate(s). Likewise, the stability of proposed radical intermediates is of great importance when evaluating the likelihood of possible single-electron mechanisms. Fortunately, the trend in the stability of carbon radicals parallels that of carbocations (section 8.5): tertiary radicals, for example, are more stable than secondary radicals, followed by primary and methyl radicals. This should make intuitive sense, because radicals, like carbocations, are electron deficient, and thus are stabilized by the electron-donating effects of nearby alkyl groups.
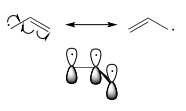
Los radicales bencílicos y alílicos son más estables que los radicales alquilo debido a los efectos de resonancia: un electrón desapareado (al igual que una carga positiva o negativa) puede deslocalizarse sobre un sistema de enlaces π conjugados. Un radical alílico, por ejemplo, se puede representar como un sistema de tres orbitales p paralelos que comparten tres electrones.
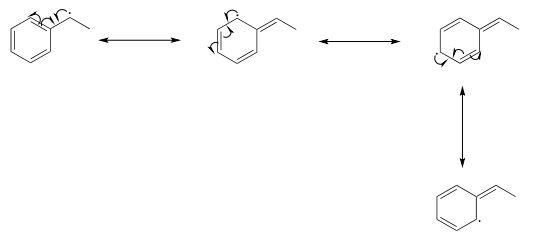
El siguiente dibujo muestra cómo un radical bencílico se deslocaliza a tres carbonos adicionales alrededor del anillo aromático:
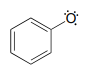
Así como los iones fenolato son menos reactivos (menos básicos) que los iones alcóxido, los radicales fenólicos son menos reactivos que los radicales alcóxido. Dibuje un contribuyente de resonancia de un radical fenólico que muestre cómo el electrón radical se deslocaliza en un carbono del anillo. Incluye flechas de movimiento de electrones.
Si bien las especies radicales son casi siempre muy reactivas y de corta duración, en algunos casos extremos pueden ser poco reactivas. A continuación se muestra un ejemplo de una estructura de radicales orgánicos inertes.

La ya extensa estabilización de resonancia bencílica se ve reforzada aún más por el hecho de que las grandes nubes de electrones en los átomos de cloro protegen el centro radical de reactivos externos. El radical se encuentra, en cierto sentido, dentro de una 'jaula' protectora.
Dibujar un contribuyente de resonancia de la estructura anterior en la que el electrón desapareado se encuentra formalmente en un átomo de cloro (incluye flechas de movimiento de electrones)


