17.4: Reacción de difosfato de tiamina, lipoamida y piruvato deshidrogenasa
- Page ID
- 72303
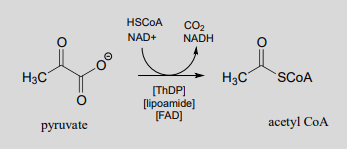
La enzima piruvato deshidrogenasa es una de las más centrales de todas las enzimas del metabolismo central: al convertir el piruvato en acetil-\(CoA\), vincula la glucólisis (donde la glucosa se descompone en piruvato) con el ciclo del ácido cítrico, en el que entran los carbonos en forma de acetilo-\(CoA\). Cinco ceonzimas están involucradas: coenzima A, nicotinamida, difosfato de tiamina\(FAD\), y finalmente lipoamida, una que es nueva para nosotros en este momento.
Reacción catalizada por piruvato deshidrogenasa:
Aprenderás más sobre la estructura y el papel metabólico de esta compleja y notable enzima en un curso de bioquímica. Aquí, nos centraremos en la reacción orgánica de múltiples etapas que cataliza, que por fin estamos equipados para entender.
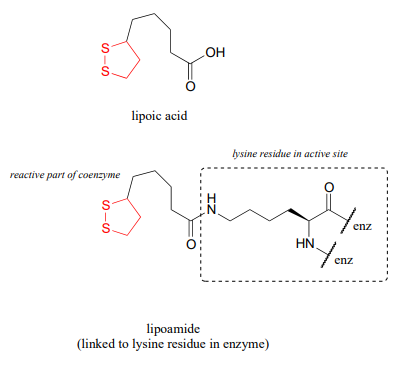
Al mirar la reacción, debes reconocer que, en primer lugar, el sustrato de piruvato se está oxidando; comienza como una cetona, y termina como tioéster, perdiendo dióxido de carbono en el proceso. En última instancia, el agente oxidante en esta reacción es\(NAD^+\), pero la reducción de\(NAD^+\) está ligada a la descarboxilación oxidativa del piruvato por\(FAD\) una coenzima que contiene disulfuro llamada lipoamida, que es el ácido lipoico unido por un enlace amida a un residuo de lisina en la enzima.
Lo segundo que hay que notar es que, debido a que la reacción implica romper el enlace entre el carbono de la cetona y un carbono adyacente, el difosfato de tiamina (\(ThDP\)) coenzyme is required. In fact, the first phase of the reaction (steps 1 and 2 below) is identical to that of pyruvate decarboxylase, an enzyme we discussed a few pages ago.
The pyruvate decarboxylase reaction mechanism
Phase 1: Decarboxylation of pyruvate

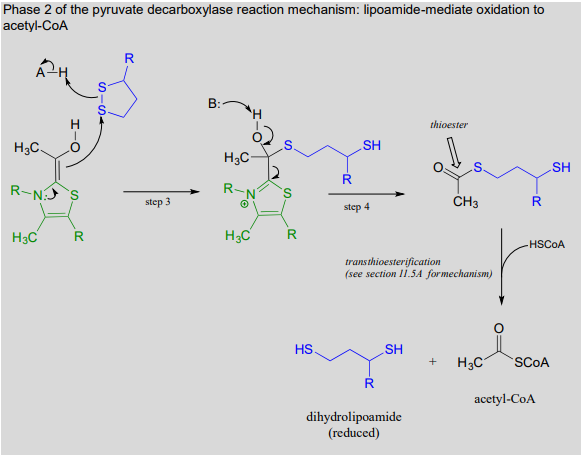
The \(ThDP\)-stabilized carbanion then acts as a nucleophile, cleaving the disulfide bridge of lipoamide (step 3 below). It is in this step that oxidation of the substrate is actually occurring. After the resulting thioester product is released from \(ThDP\) (step 4 below), it undergoes transesterification form acetyl-\(CoA\), the product of the reaction.
Phase 2 of the pyruvate decarboxylase reaction mechanism: lipoamide-mediate oxidation to acetyl-\(CoA\)
We are not done yet! In order for the catalytic cycle to be complete, the reduced dihydrolipoamide must be regenerated back to its oxidized state through disulfide exchange with a disulfide bond on the enzyme. The pair of enzymatic cysteines is then oxidized back to disulfide form by an \(FAD\)-dependent reaction.
Phase 3 of the pyruvate decarboxylase reaction mechanism: regeneration of lipoamide

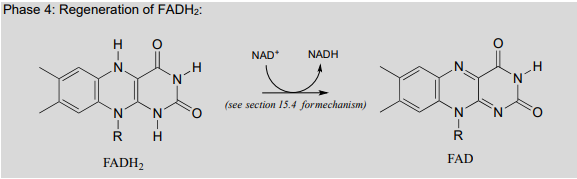
Finally, \(FAD\) is regenerated with concurrent reduction of \(NAD^+\):
Phase 4: Regeneration of \(FADH_2\):