II. Selenides
- Page ID
- 79964
A. Mecanismo de reacción
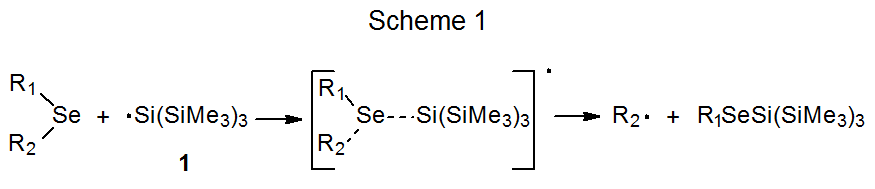
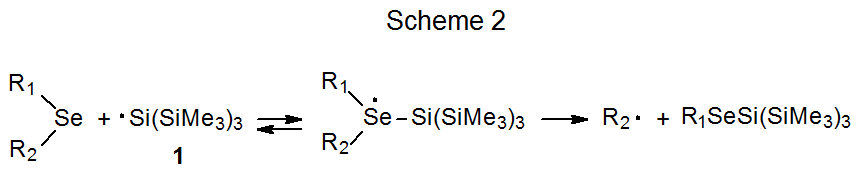
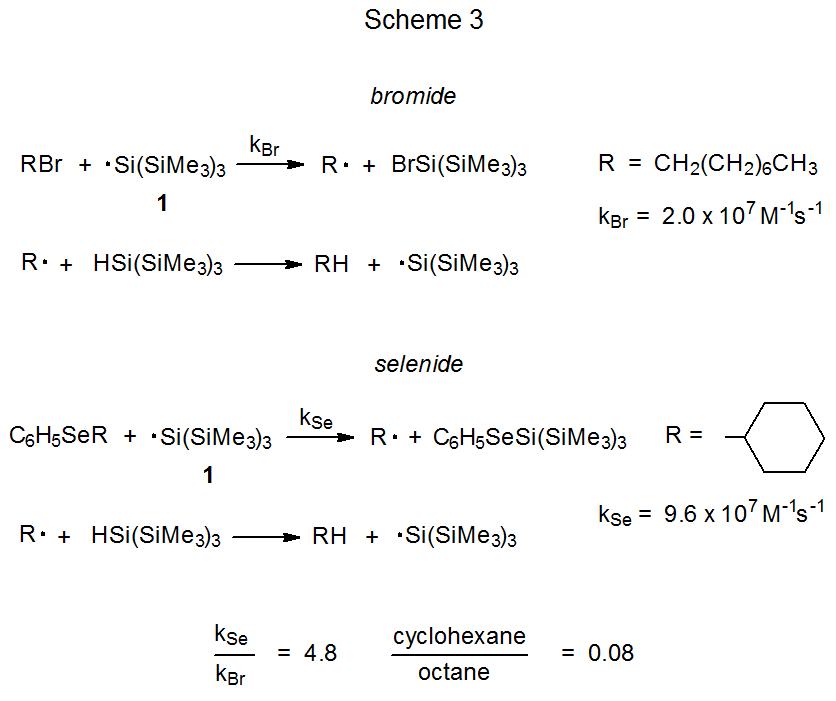
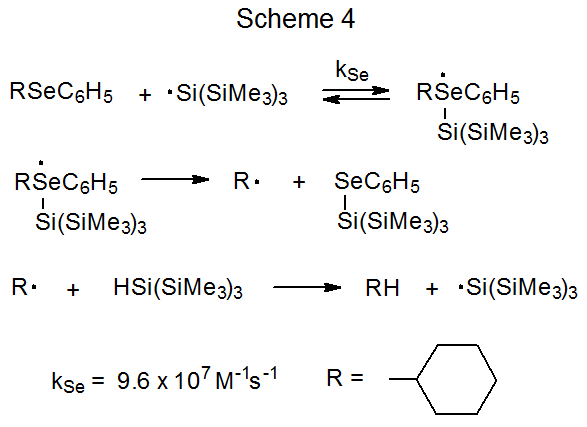
Tanto el mecanismo S H 2 representado en el Esquema 1 como el proceso por etapas mostrado en el Esquema 2 se consideran posibilidades para explicar la reacción entre un seleniuro de fenilo y un radical centrado en estaño o silicio. 6 El radical tris (trimetilsilil) sililo (1) se utiliza para ilustrar estos dos mecanismos porque juega un papel importante en la elección entre ellos. 2 Una manera de hacer esta elección comienza con la observación de que la constante de velocidad absoluta para la reacción de 1 con seleniuro de ciclohexil fenilo para dar ciclohexano (k Se) es 9.6 x 10 7 M -1 s -1 y la constante de velocidad para la reacción de 1- bromooctano para dar octano (k Br) es 2.0 x 10 7 M -1 s -1. Si cada radical ciclohexilo y 1-octilo se forma irreversiblemente y abstrae un átomo de hidrógeno de (CH 3 Si) 3 SiH (Esquema 3), entonces la relación k Se /k Br debe ser igual a la relación de ciclohexano a octano formado cuando se forma una mezcla igual molar del seleniuro y el bromuro reaccionan con una cantidad limitada de 1. Cuando se realiza un experimento para probar esta posibilidad, la relación de ciclohexano a octano en la mezcla de productos es de 0.08, un valor muy inferior a la relación 4.8 predicha a partir de las constantes de velocidad absolutas (Esquema 3). 2 Este resultado es inconsistente con un proceso en el que tanto el bromuro como el seleniuro reaccionan de acuerdo con el mecanismo de S H 2 mostrado en el Esquema 3. La relación de 0.08 es consistente con el bromuro que reacciona como se muestra en el Esquema 3 pero el seleniuro produciendo un intermedio que puede regresar a los materiales de partida (Esquema 4). Un intermedio probable en tal reacción es uno con un átomo de selenio hipervalente. 2 Los resultados de este experimento comparativo, por lo tanto, favorecen el mecanismo paso a paso para la reacción de seleniuro mostrado en el Esquema 2 sobre el proceso concertado representado en el Esquema 1.
B. Reacciones
1. Reducción
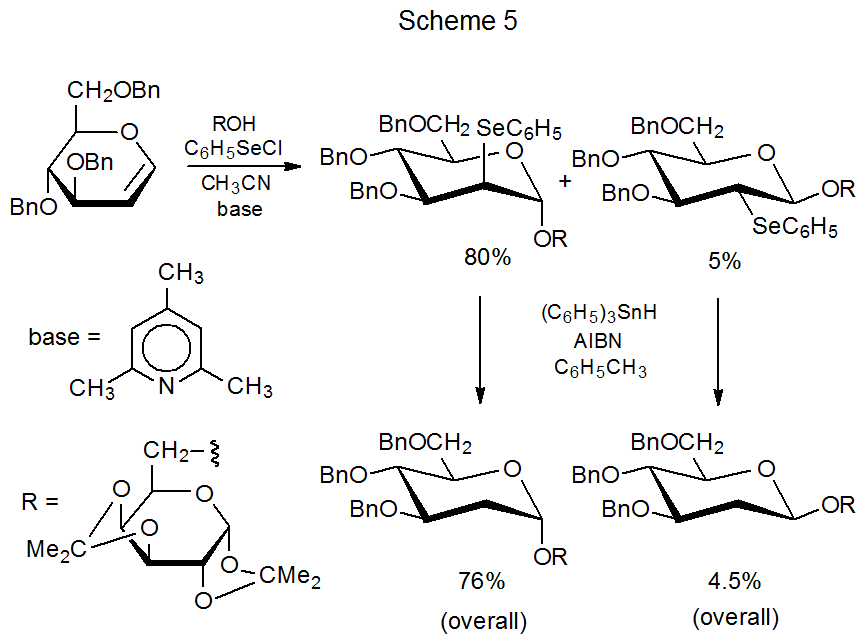
Los carbohidratos que tienen un grupo selenofenilo unido a un anillo piranoide reaccionan con hidruro de tri- n-butilestaño, hidruro de trifenilestaño o tris (trimetilsilil) silano para reemplazar el grupo que contiene selenio con un átomo de hidrógeno. 7—19 Tal reacción es la etapa final en la síntesis de disacáridos que se muestra en el Esquema 5. 7 Aunque la reducción que implica el reemplazo del grupo selenofenilo suele ser en C-2 en monosacáridos o en C-2' en disacáridos y nucleósidos, la reacción en monosacáridos también se ha observado en C-1 17,18 y en C‑6. 20
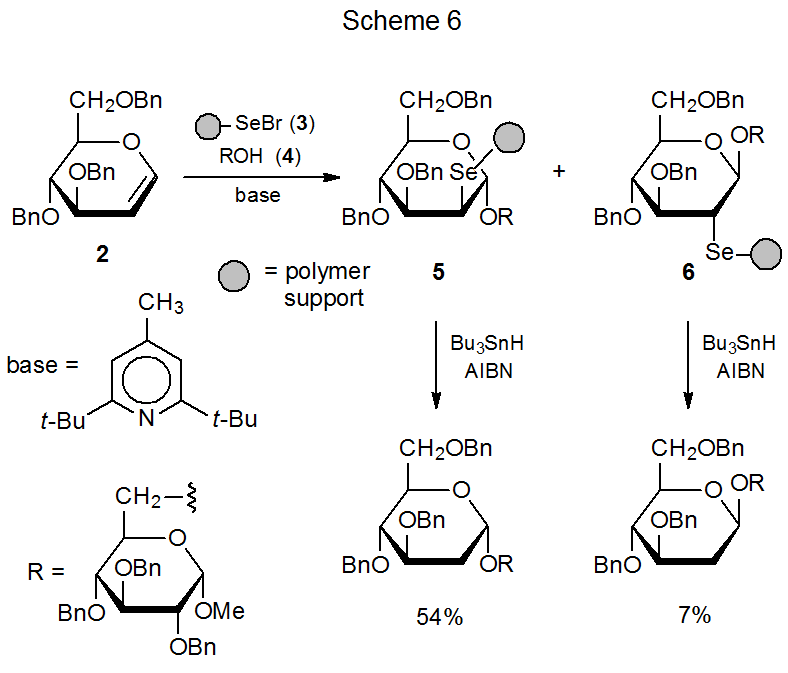
El polímero 3, 21,22 con selenio unido a los anillos aromáticos en poliestireno, reacciona con el glical 2 en presencia del azúcar parcialmente protegido 4 para producir los polímeros que contienen carbohidratos 5 y 6 (Esquema 6). 21 (El reactivo unido a polímero 3 tiene la ventaja de que es inodoro, más seguro y más conveniente de manejar que C 6 H 5 SecL, que es tóxico y maloliente. 21) La reacción de 5 y 6 con hidruro de tri- n - butilestaño libera los carbohidratos de los polímeros y, al mismo tiempo, completa el proceso de reducción.
Reemplazar un grupo selenofenilo en un anillo de cinco miembros por un átomo de hidrógeno es una reacción común para nucleósidos y análogos de nucleósidos. 23—32 Este reemplazo se puede realizar ya sea a 80-110 o C con inicio de AIBN (eq 1), 23 o a temperatura ambiente con Et 3 B—O 2 como iniciador (eq 2). 26 [El reemplazo del grupo selenofenilo, cuando se inicia por Et 3 B—O 2, puede ocurrir a temperaturas tan bajas como ‑75 o C (eq 3). 31] El hidruro de tri- n-butilestaño es la transferencia normal de átomos de hidrógeno en tales reacciones, pero tris (trimetilsilil) silano (eq 4) 28 y 1,4-ciclohexadieno (eq 5) 30 también son efectivos en este papel. Los rendimientos de la reacción de Bu 3 SnH con carbohidratos que contienen grupos selenofenilo permanecen altos cuando el átomo de oxígeno en un anillo furanoide es reemplazado por un átomo de azufre. 33—35
.png)
.png)
.png)
.png)
.png)
2. Adición
Los radicales carbohidrato generados a partir de selenidos de fenilo experimentan reacciones de adición características con compuestos que contienen múltiples enlaces. 19,36—39 Estos radicales se suman no sólo a dobles enlaces decididamente deficientes en electrones, como el que se encuentra en el acrilato de t-butilo, sino también a dobles enlaces menos deficientes en electrones, como el presente en el estireno. 19,37,38 Los rendimientos del producto por adición al estireno son menores, sin embargo, debido a que la abstracción de átomos de hidrógeno del hidruro de tri- n-butilestaño para dar el producto de reducción compite eficazmente con la adición a un enlace múltiple menos deficiente en electrones (eq 6). Las condiciones son críticas para el éxito de estas reacciones de adición porque solo se observa abstracción de átomos de hidrógeno a menos que Et 3 B-O 2 sea el iniciador y la reacción se realice a temperatura ambiente. 38 Como es típico para reacciones de este tipo (es decir, aquellas que forman radicales piranos-1-ilo intermedios), la estereoselectividad de adición está controlada por el efecto anomérico cinético [Sección III.B del Capítulo 11 del Volumen I].
.png)
3. Ciclización
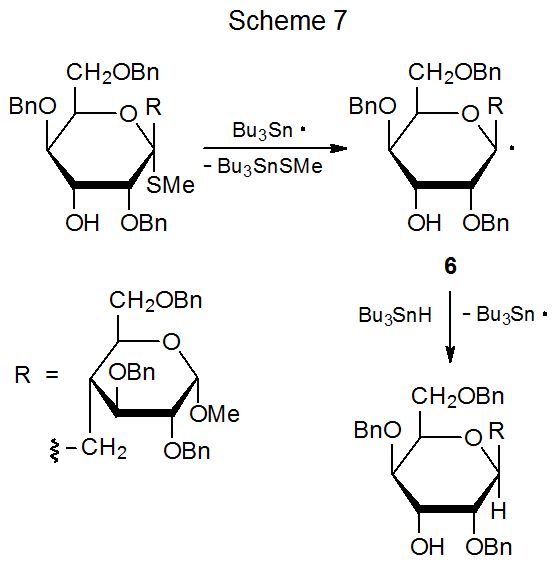
La reacción mostrada en el Esquema 7 40 ilustra la preferencia establecida de radicales insaturados para formar anillos de cinco miembros incluso cuando son posibles los de seis miembros. 40—43 Esta reacción (Esquema 7) también revela una complicación en la ciclación radical causada por la abstracción interna de átomos de hidrógeno, proceso que conduce en este caso a la epimerización en C-5. Solo los radicales centrados en carbono que son muy reactivos, como el radical primario 7, son capaces de abstraer un átomo de hidrógeno de un enlace carbono-hidrógeno lo suficientemente rápido como para ser consecuencia. La epimerización en C-5 en esta reacción puede reducirse o incluso eliminarse aumentando la concentración de hidruro de tri- n-butilestaño hasta el punto de que la abstracción interna de átomos de hidrógeno por 7 ya no compite con éxito con la abstracción de Bu 3 SnH (Esquema 7). 40
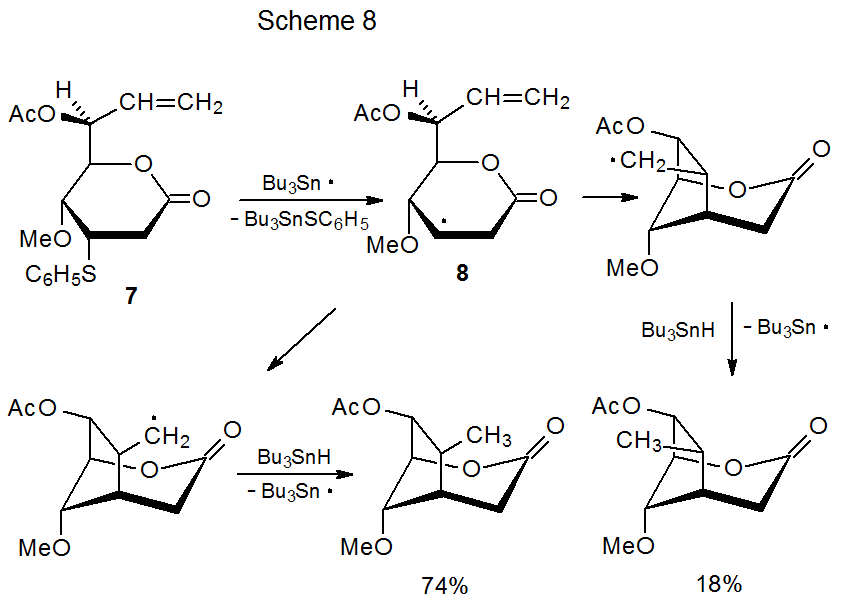
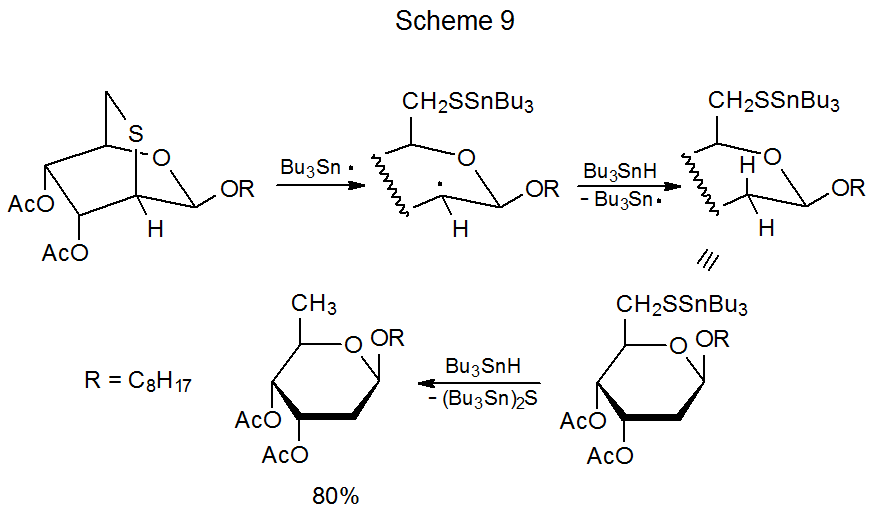
La ciclación de carbohidratos insaturados en los que un grupo selenofenilo está unido a un anillo piranoide está marcada por una sorprendente variedad de nuevos sistemas de anillos que se pueden producir. Además de los anillos esperados de cinco- 40—44 y 45 de seis miembros, también tiene lugar la formación de anillos de siete miembros, 46 de ocho miembros, 47,48 e incluso de nueve miembros de 49—54. Los anillos más grandes generalmente se generan cuando un centro radical y un enlace múltiple se unen a través de un conector de silicio-oxígeno. 46—52 Las reacciones de este tipo a menudo producen carbohidratos en los que dos unidades de sacárido están unidas por un puente de metileno (Esquema 8.) 48 Aunque los puentes que contienen átomos de silicio y oxígeno son comunes, también ocurren reacciones entre monosacáridos conectados por otras combinaciones de átomos. 53,54
En las reacciones de ciclación un grupo selenofenilo unido a un anillo furanoide se comporta de manera similar a uno unido a un anillo piranoide; es decir, la reacción produce un radical que se suma a un enlace múltiple conectado. El grupo conector a veces contiene un átomo de nitrógeno (eq 7) 55 o un átomo de oxígeno 56—58 (eq 8 56) o la colección de átomos que componen un enlace éster, 59,60 pero como es el caso de compuestos con anillos piranoides, un radical centrado en un anillo furanoide frecuentemente tiene el grupo insaturado atado al anillo de cinco miembros a través de un puente silicio-oxígeno 61—69 (eq 9 61). La ciclación radical reportada de este tipo, como la que se muestra en la ecuación 10, 62 a menudo implica la reacción de un nucleósido.
.png)
.png)
.png)
.png)
Aunque en la mayoría de los carbohidratos un grupo selenofenilo sometido a reacción está unido a un átomo de carbono del anillo, las reacciones de ciclación 70,71 (y adición 72) también pueden comenzar con una estructura de anillo abierto. Un ejemplo se da en la ecuación 11. 70 La ciclación del seleniuro de anillo abierto 8 comienza con la transferencia de electrones del yoduro de samario (II). El cetilo de samario intermedio formado durante esta reacción desplaza un grupo bencilo del selenio para dar un sistema de anillos que contiene un átomo de selenio (Esquema 9). 73 Este es un método inusual para la formación de anillos porque tiene lugar por desplazamiento de grupo en lugar de adición a un enlace múltiple.
.png)
4. Migración de grupo
La migración de grupo es una reacción característica de un radical piranos-1-ilo que tiene un grupo aciloxi unido a C-2. Dado que los selenuros de fenilo son un tipo de precursor para estos radicales, es razonable esperar que los selenuros sean sustratos para tal migración. 5,74,75 La reacción mostrada en la ecuación 12 justifica esta expectativa. 5 (Las reacciones de migración de grupos aciloxios se discuten en la Sección V. del Capítulo 8.)
.png)
5. Formación de cationes radicales
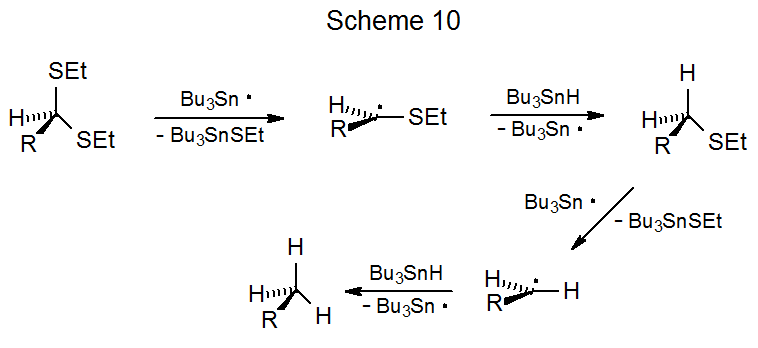
En la reacción mostrada en el Esquema 10 la abstracción del grupo selenofenilo del 9 por Bu 3 Sn· da el radical piranos-1-ilo 10, que luego se fragmenta para producir el catión radical 11. 76 Este catión radical experimenta entonces una combinación de ciclación, pérdida de protones y abstracción de átomos de hidrógeno para dar el producto final. La investigación de la formación de cationes radicales a partir de nucleótidos que contienen grupos selenofenilo se utiliza para estudiar el mecanismo de escisión de cadenas de ADN. 77,78
6. Combinación Radical
El reemplazo de un grupo selenofenilo con un átomo de hidrógeno típicamente depende de la capacidad de un reactivo como hidruro de tri- n-butilestaño tanto para proporcionar un radical portador de cadena (Bu 3 Sn·) como para servir como transferencia de átomo de hidrógeno. Si este reactivo es reemplazado por uno que carece de capacidad de donación de hidrógeno pero conserva la capacidad de generar un radical portador de cadena, todavía se producirá una pérdida de grupo selenofenilo, pero no se puede depender de la abstracción de átomos de hidrógeno para completar la reacción. Si están presentes reactivos insaturados, es posible la adición de radicales, pero si dichos compuestos están ausentes, puede tener lugar la combinación de radicales (eq 13). 4 {[La combinación del tipo que se muestra en la ecuación 13 también ocurre cuando los radicales piranos-1-ilo se forman a partir de bromidas de glicosilo [Capítulo 2, Sección III.G.1] y glicosil fenil sulfonas [Capítulo 3, Sección VII.B.1.c.]}
.png)

