II. Radicales que abstraen los átomos de hidrógeno de los carbohidratos sin
- Page ID
- 79952
A. Radicales hidroxilo
1. Radiación ionizante y luz ultravioleta
La γ-radiólisis del agua produce radicales hidroxilo junto con los compuestos, iones y otros radicales mostrados en la ecuación 1. 1—4 El rendimiento de radicales hidroxilo en esta reacción se puede incrementar añadiendo N 2 O a la mezcla de reacción debido a que los electrones hidratados reaccionan con N 2 O para formar radicales hidroxilo (eq 2). 2—4 En soluciones que contienen N 2 O 85% de los radicales son HO· y 15% son H·. 4 Tanto el HO· como el H· abstraen los átomos de hidrógeno de los enlaces carbono-hidrógeno. 4 Los radicales hidroxilo (y átomos de hidrógeno) también se pueden producir por fotólisis de agua con luz ultravioleta de longitud de onda inferior a 185 nm (eq 3). 1
.png)
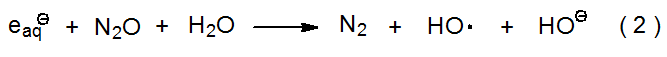.png)
.png)
2. Reacción de H 2 O 2 con Fe 2 + y Ti 3 +
La reacción de H 2 O 2 con Fe 2 + (eq 4) o Ti 3 + (eq 5) produce radicales hidroxilo. 5—8 (Estas combinaciones de reactivos a veces se describen como radiomiméticos, es decir, imitando la radiación). Cada radical hidroxilo producido es capaz de abstraer un átomo de hidrógeno de un enlace carbono-hidrógeno presente en una molécula de sustrato (eq 6). El Ti 4 + generado por la reacción mostrada en eq 5 no reacciona más con el radical centrado en carbono producido, pero el Fe 3 + formado en la reacción mostrada en la ecuación 4 sí; 8 Fe 3 + oxida un radical α-hidroxi a grupo carbonilo mientras que él mismo se reduce a Fe 2 +. La regeneración de Fe 2 + a partir de Fe 3 + por la reacción mostrada en la eq 7 significa que cuando ocurre esta reacción, solo puede ser necesaria una cantidad catalítica de Fe 2 + para la descomposición completa de H 2 O 2 (eq 4). (La combinación de H 2 O 2 y Fe 2 + se conoce como reactivo de Fenton, 9 y la de H 2 O 2 y Te 3 + como reactivo tipo Fenton. 8)
.png)
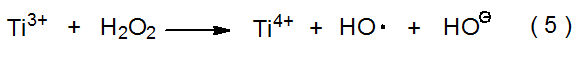.png)
.png)
.png)
B. Aniones de Radical Sulfato
El anión radical sulfato (SO 4 · -) se forma cuando el dianión peroxidisulfato (S 2 O 8 2 -) reacciona con Ti 3 + (eq 8). 10 Una baja concentración de Cu 2 + presente en la mezcla de reacción potencia la velocidad de generación de SO 4 · - a través de las reacciones mostradas en las ecuaciones 9 y 10. El anión radical sulfato también se forma a partir de la fotólisis directa de S 2 O 8 2 - (eq 11). 10
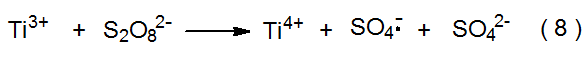.png)
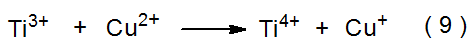.png)
.png)
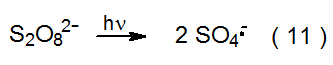.png)

