III. Transferencia de electrones fotoquímicos a ésteres de ácido carboxílico
- Page ID
- 80195
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
A. Acetatos y pivalatos
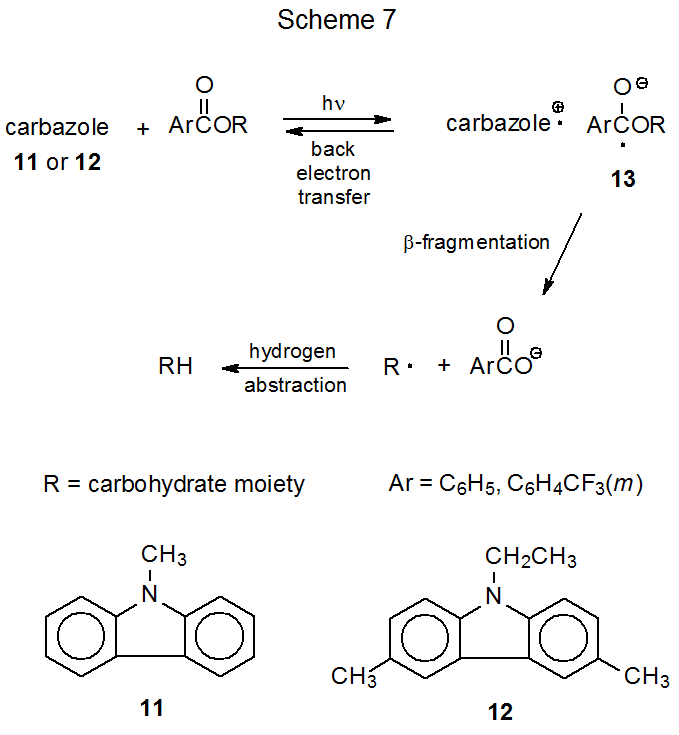
La transferencia fotoquímica de electrones de hexametilfosforamida excitada (HMPA) a un grupo O-acilo en un carbohidrato comienza una serie de eventos que resultan en reemplazar cada grupo O-acilo con un átomo de hidrógeno. Un ejemplo de una reacción típica se muestra en la ecuación 5. 27 La temperatura a la que se puede llevar a cabo esta reacción (~25 o C) es sintéticamente mucho más atractiva que los 140 o C necesarios para la reacción térmica correspondiente de un carbohidrato acetilado (eq 3). 23 La transferencia fotoquímica de electrones a acetatos se ha utilizado para la síntesis de una serie de desoxiazúcares. 27—34 Ésteres de ácido pivalico, que también pueden servir como sustratos en este tipo de reacción, 28,35—41 a veces dan mejores rendimientos que los acetatos correspondientes. 28,35,36
.png)
1. Mecanismo de reacción
La transferencia fotoquímica de electrones comienza con la absorción de luz por HMPA para producir una molécula altamente reactiva, electrónicamente excitada que expulsa un electrón a la solución (Esquema 5). 42.43 El electrón expulsado es capturado por el carbohidrato acilado para producir un anión radical que se escinde para dar un anión carboxilato y un radical carbohidrato (R·). 43 La abstracción de átomos de hidrógeno por el radical carbohidrato completa entonces el proceso de reemplazo (Esquema 5). El agua presente en la mezcla de reacción extiende la vida útil del electrón solvatado y, al hacerlo, aumenta la probabilidad de que este electrón sea capturado por una molécula de éster. 43 (La importancia del agua para el éxito de este proceso se demuestra por los rendimientos de las reacciones que se muestran en la ecuación 6. 44,45)
.png)
2. Regeneración de Alcohol
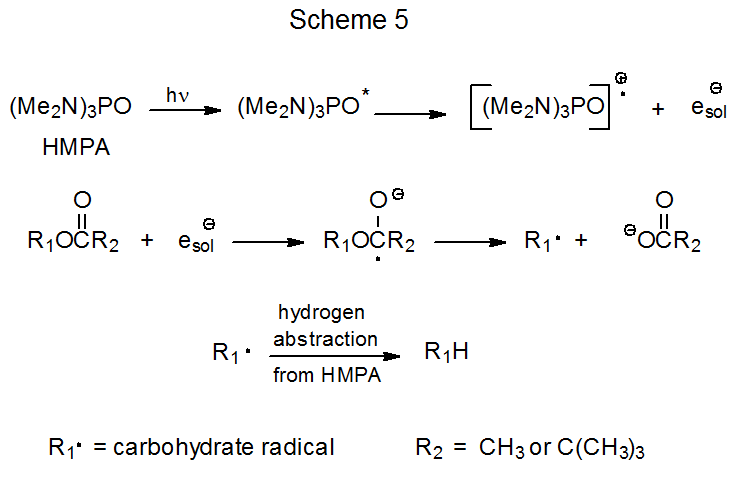
La fotólisis de éster en HMPA acuosa a veces regenera el alcohol a partir del cual se sintetizó el éster (eq 7). 34 En algunos casos, la formación de alcohol puede deberse a la hidrólisis de ésteres no fotoquímicos. La reacción no fotoquímica proporciona una explicación razonable para el acetato anomérico fácilmente hidrolizado que se muestra en la ecuación 8 que experimenta solo hidrólisis (sin desoxigenación) cuando se fotoliza en HMPA acuoso. 34 Aunque la hidrólisis simple puede ser significativa para algunos compuestos, como se describe a continuación, la regeneración de alcohol durante la fotólisis de otros, probablemente la mayoría, ésteres debe ocurrir de una manera diferente.
.png)
.png)
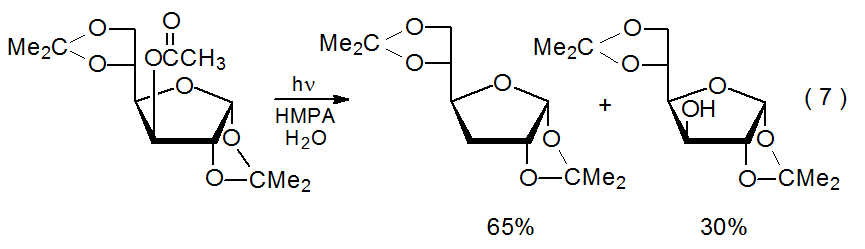
La formación de alcohol durante la fotólisis del éster no puede explicarse, en general, por hidrólisis simple porque, como se muestra en la reacción representada en el Esquema 6, el rendimiento del alcohol puede depender de la concentración del éster de partida. 43 Una explicación de esta dependencia comienza con el éster 5 capturando un electrón solvatado para formar el anión radical 6. Este anión radical luego abstrae un átomo de hidrógeno de una segunda molécula de 5 para producir el anión 7, que luego forma un ion alcóxido que protonata para dar el alcohol observado. 43 Dado que, de acuerdo con esta explicación, elevar la concentración de éster debería aumentar la tasa de abstracción de átomos de hidrógeno para dar 7 pero no la tasa de la β-escisión competidora que forma R·, mayor concentración de éster debería aumentar la cantidad de alcohol (ROH) producida en el gasto del producto desoxigenado (RH).
Una pregunta crítica sobre el mecanismo para la formación de alcohol presentado en el Esquema 6 se refiere a si el anión radical 6 puede abstraer un átomo de hidrógeno del éster 5. La evidencia encontrada en la ecuación 9 respalda la idea de que 5 puede funcionar como donante de átomos de hidrógeno. La irradiación de 5 en HMPa-d 18 /D 2 O da un 27% de rendimiento de 8, un producto de reducción que no contiene deuterio. Dado que la única fuente para el segundo átomo de hidrógeno en C-3 en 8 es uno de los carbohidratos en la mezcla de reacción y dado que el éster 5 es el único carbohidrato presente al inicio de la reacción, la abstracción de 5, al menos en las primeras etapas de reacción, parece inevitable. Si 5 puede actuar como donante de átomos de hidrógeno en la formación de 8, se convierte en un fuerte candidato para el mismo papel en la conversión del anión radical 6 en el ion alcóxido 7 (Esquema 6).
.png)
3. Competencia de cromóforos absorbentes de luz
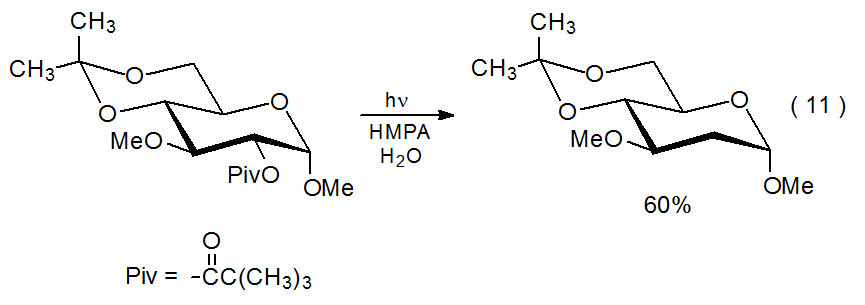
Si un éster contiene un cromóforo fuertemente absorbente, la excitación de HMPA se impedirá de manera efectiva porque la mayor parte de la luz incidente será absorbida por el éster. Si no se excita HMPA se impedirá el reemplazo del grupo acilooxi con un átomo de hidrógeno al evitar la transferencia de electrones. Las propiedades de absorción de luz del grupo benzoiloxi, por ejemplo, hacen que los benzoatos sean participantes mucho menos deseables en estas reacciones de transferencia de electrones porque mucha menos luz incidente llega al HMPA. Esto significa que un factor importante en la reacción de los acetatos y pivalatos simples es que estos compuestos no contienen cromóforo fuertemente absorbente. 42 Un ejemplo de un éster que no experimenta el reemplazo del grupo aciloxi debido a la presencia de un sustituyente que absorbe la luz (es decir, el grupo 4,6-O-bencilideno) se muestra en la ecuación 10. 41 Aunque el grupo bencilideno se elimina durante la fotólisis, el cromóforo aromático permanece en la solución y continúa absorbiendo la luz incidente. Cambiar la protección de 4,6-O-bencilideno a 4,6-O-isopropilideno permite que la reacción proceda de manera normal (eq 11). 41
.png)
.png)
B. m - (Trifluorometil) benzoatos
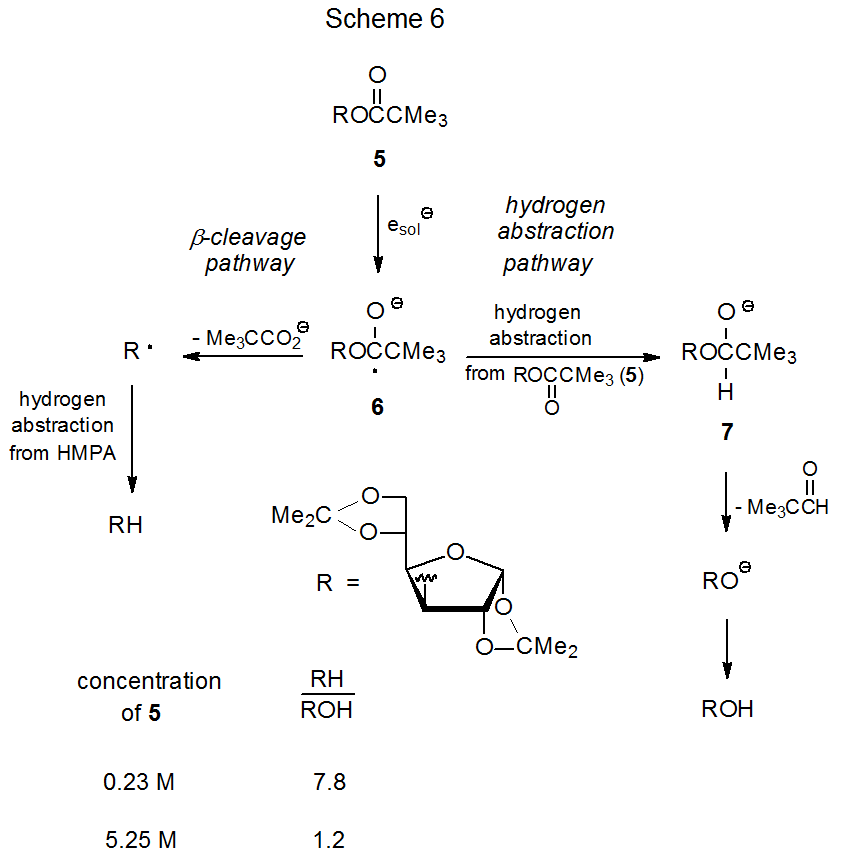
Un benzoato de m - (trifluorometilo) aceptará un electrón de N-metilcarbazol excitado (11) en una reacción que conduzca a la sustitución del grupo aciloxi por un átomo de hidrógeno; por ejemplo, fotólisis de 2',3',5'-tri- O - [m - (trifluorometilo) benzoil] -adenosina (9) produce el derivado de 2',3'-didesoxiadenosina 10 (eq 12). 46 (La mayoría, 46—52 pero no todos, 48 compuestos reportados que experimentan este tipo de reacción son nucleósidos). Las reacciones, como la que se muestra en la ecuación 12, son regioselectivas porque el anión radical generado a partir de un grupo m - (trifluorometil) benzoílo no se fragmentó para dar un radical primario.
.png)
La transferencia fotoquímica de electrones que involucra m - (trifluorometil) benzoatos y N - metilcarbazol (11) tiene varias ventajas sobre la transferencia de electrones entre HMPA y acetatos o pivalatos. Una de ellas es que el N-metilcarbazol tiene mayor capacidad de absorción molar que el HMPA, hecho que hace que el reactivo carbohidrato sea menos probable que detenga la reacción al absorber la luz incidente. 52 Desde el punto de vista de la seguridad, eliminar HMPA de la mezcla de reacción evita manejar un agente altamente tóxico, sospechoso de cáncer. Debido a que el grupo m- (trifluorometil) benzoilo es un aceptor de electrones efectivo (mejor que un grupo acetilo o pivaloílo) pocos sustituyentes en el carbohidrato competirán con este grupo por un electrón donado por N-metilcarbazol excitado (11); consecuentemente, las reacciones de los m - (trifluorometil) benzoatos suelen ser altamente quimioselectivas. Un ejemplo de esta selectividad se muestra en la eq 13, donde el grupo benzoilo permanece unido a C-3' mientras que el grupo m ‑ (trifluorometil) benzoilo en C-2' se reemplaza por un átomo de hidrógeno. 49
.png)
Cuando la reacción se realiza en presencia de Mg (ClO 4) 2, es posible reemplazar incluso un grupo benzoiloxi no sustituido con un átomo de hidrógeno (eq 14 50). 50—52 El perclorato de magnesio afecta esta reacción al obstaculizar la transferencia de retroelectrones, proceso que compite con la fragmentación del anión radical 13 (Esquema 7). Otro factor que afecta la reacción de un grupo benzoiloxi es la elección del donador de electrones; así, reemplazar el N-metilcarbazol (11) por 3,6-dimetil-9-etilcarbazol (12) provoca que la desoxigenación tenga lugar más rápidamente. 50 El compuesto 12 es superior al 11 porque forma un catión radical más estable tras la transferencia de electrones. 50,53,54
.png)