II. Reemplazo de un Grupo Aciloxi con un Átomo de Hidrógeno
( \newcommand{\kernel}{\mathrm{null}\,}\)
A. α-aciloxi cetonas
Las α‑aciloxicetonas reaccionan con hidruro de tri- n - butilestaño reemplazando el grupo aciloxi con un átomo de hidrógeno (eq 1). 1 La importancia del grupo carbonilo para este proceso de reemplazo es evidente en las dos reacciones mostradas en la ecuación 2. En el primero de estos un benzoato (1) que contiene un grupo ceto-forma un desoxi azúcar con buen rendimiento, pero en el segundo un benzoato (2) que carece de tal grupo no es reactivo. 1 Aunque las reacciones de α-aciloxi cetonas conducen a la formación de desoxiazúcares, la utilidad de tales reacciones está limitada por el número relativamente pequeño de carbohidratos que o bien tienen los sustituyentes necesarios o pueden convertirse fácilmente en compuestos que sí. 1,2
.png)
.png)
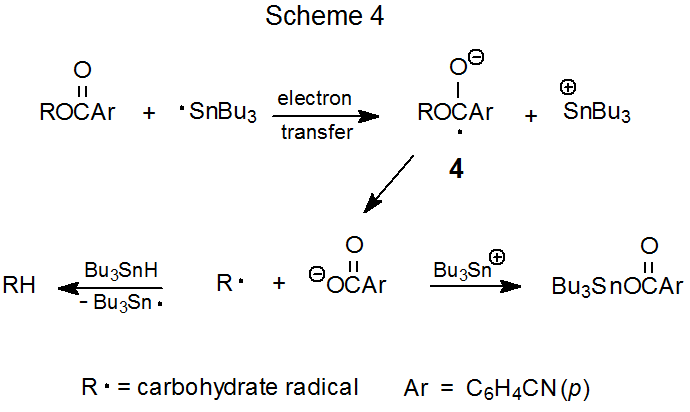
Un mecanismo propuesto para el reemplazo grupal en α-aciloxi cetonas se representa en el Esquema 1. Las secuencias de adición/eliminación y transferencia/eliminación de electrones se presentan como posibilidades de pérdida de grupos aciloxi. La posibilidad de adición-eliminación se propuso en el momento del descubrimiento de esta reacción, 1 pero la opción de transferencia de electrones se reconoció como una alternativa viable posteriormente cuando se demostró que la pérdida del grupo benzoiloxi de α- (benzoiloxi) acetofenona implicaba transferencia de electrones de Bu 3 Sn· a esta α-aciloxi cetona. 3 No hay pruebas decisivas que favorezcan ninguno de los dos mecanismos.
B. Ésteres metílicos de oxalilo
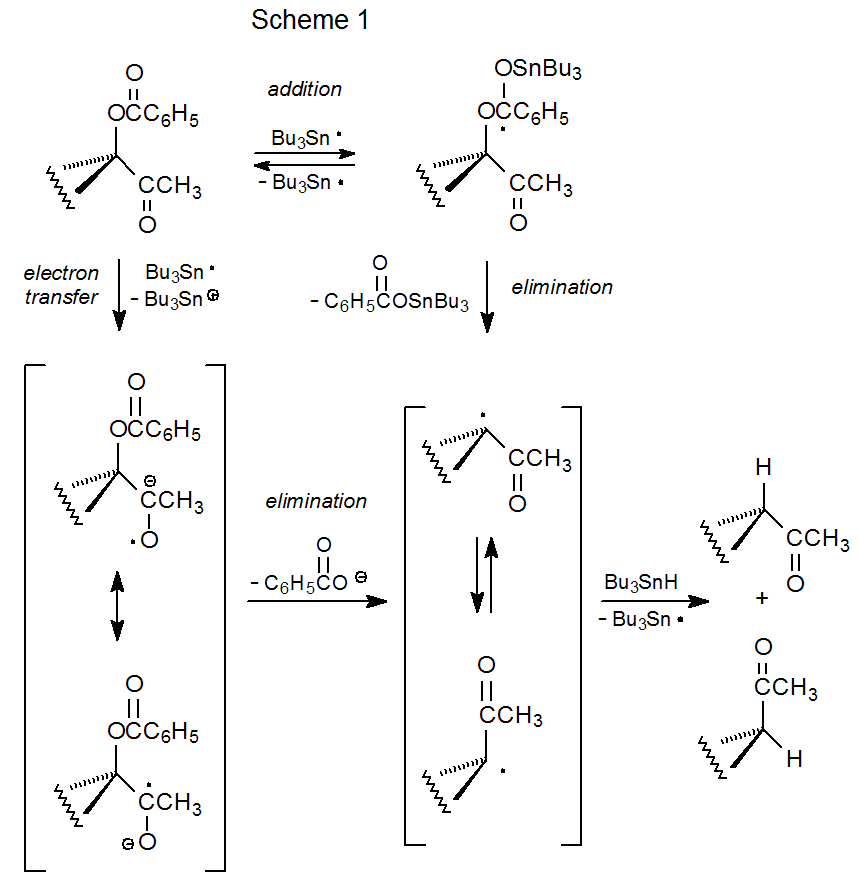
Los ésteres metílicos de oxalilo se pueden preparar fácilmente por esterificación de carbohidratos parcialmente protegidos con cloruro de metil oxalilo (Esquema 2). 4 Estos ésteres reaccionan con hidruro de tri- n-butilestaño para reemplazar el grupo metiloxaliloxi con un átomo de hidrógeno. 4—19 Los estudios de ésteres no carbohidratados muestran que los derivados de alcoholes secundarios y terciarios son materiales de partida adecuados en este proceso de desoxigenación, pero los ésteres de alcoholes primarios no lo son porque regeneran los alcoholes a partir de los cuales fueron sintetizados. 20 La mayoría de las reacciones de los ésteres metílicos de oxalilo de carbohidratos son de compuestos en los que se ha esterificado un grupo hidroxilo terciario. Muchos de estos compuestos son nucleósidos. 4,7—16 Una razón por la que la mayoría de los ésteres de metil oxalilo se forman a partir de alcoholes terciarios es que los compuestos de O-tiocarbonilo comúnmente utilizados para la desoxigenación en la reacción de Barton-McCombie (Sección II en el Capítulo 12) a veces tienen dificultades para formarse cuando un alcohol es terciario. 6 El cloruro de metiloxalilo esterifica típicamente alcoholes terciarios sin dificultad. 4,6—19 Otra razón para seleccionar ésteres de metil oxalilo es que es menos probable que experimenten la eliminación térmica (reacción de Chugaev) que es común para los compuestos terciarios de O-tiocarbonilo. En las moléculas con la estructura adecuada, la ciclación puede preceder a la abstracción de átomos de hidrógeno. 13
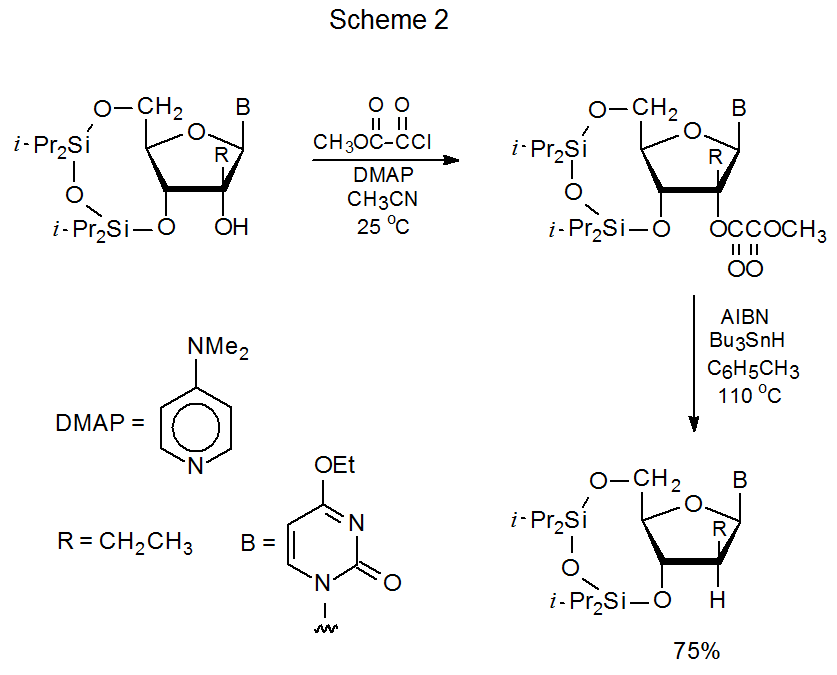
En el Esquema 3 se muestra un mecanismo propuesto para la reacción de ésteres metílicos de oxalilo con hidruro de tri- n-butilestaño. De acuerdo con este mecanismo, el radical tri- n-butilestaño transfiere un electrón al sistema π del éster para producir un anión radical altamente estabilizado (una semidiona). 20 (Apoyando la idea de que tal transferencia tiene lugar es la observación de que Bu 3 Sn· reacciona con ésteres de oxalato para producir intermedios con espectros ESR característicos de aniones radicales. 21) La fragmentación de dicho anión radical genera entonces un radical centrado en carbono que abstrae un átomo de hidrógeno de Bu 3 SnH (Esquema 3).
Hay dos problemas significativos asociados con la síntesis y reacción de los ésteres metílicos de oxalilo. Una de ellas es la dificultad en la purificación del material de partida que surge debido a que estos ésteres se hidrolizan fácilmente, en particular, durante la cromatografía sobre gel de sílice. 4,22 Un segundo problema tiene que ver con la regeneración de alcohol, una reacción secundaria significativa del tratamiento de algunos ésteres de metiloxalilo con hidruro de tri- n - butilestaño. 5,20
C. Acetatos y Trifluoacetatos
Los carbohidratos acetilados no reaccionan con hidruro de tri- n - butilestaño en condiciones normales (80-110 o C, 2 h, inicio de AIBN), pero bajo condiciones diferentes y más vigorosas (trifenilsilano, 140 o C, 12 h, dos equivalentes de peróxido de benzoílo) estos compuestos producen desoxiazúcares respondedores (eq 3). 23 Estas condiciones más vigorosas provocan una reacción similar en carbohidratos sustituidos con O - trifluoroacetilo. 24 La necesidad de dos equivalentes de peróxido de benzoílo en la reacción mostrada en la ecuación 3 indica que se está llevando a cabo un proceso no en cadena.
.png)
D. p-Cianobenzoatos
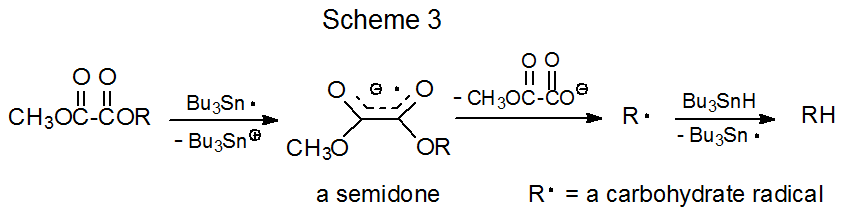
La sustitución del grupo benzoilo en el compuesto 2 por un grupo p-cianbenzoílo convierte un compuesto no reactivo (2) en uno reactivo (3) (eq 4). 25 Una explicación de esta diferencia en la reactividad es que debido a que un grupo ciano es bastante efectivo para estabilizar un anión radical, se produce la transferencia de electrones al compuesto 3 donde no se produce una transferencia análoga al benzoato no sustituido 2. Dado que los aniones radicales se pueden formar por transferencia de electrones desde el radical tri- n-butilestaño a compuestos orgánicos fácilmente reducidos, 21,26 el mecanismo de transferencia de electrones representado en el Esquema 4 representa una posible vía para el reemplazo de un grupo p-cianobenciloxi con átomo de hidrógeno.
.png)