II. Migración del Grupo Fosfatoxi
- Page ID
- 80426
A. Mecanismo de reacción
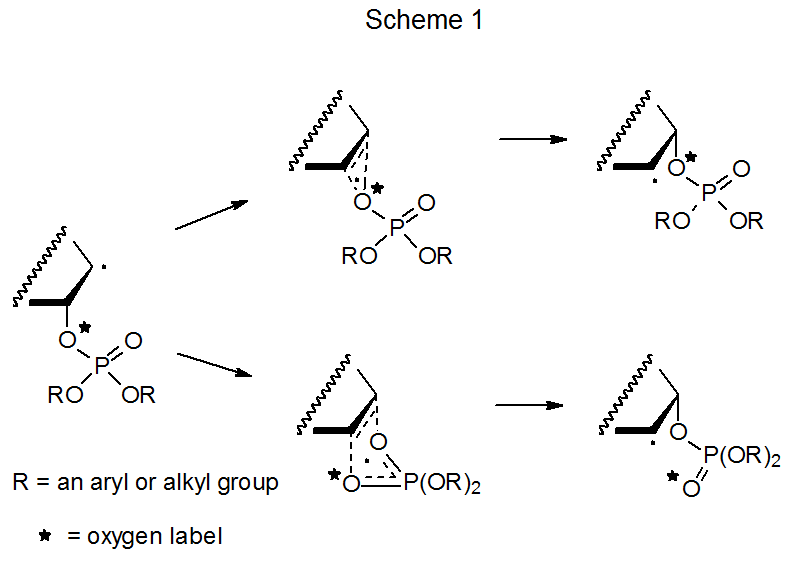
Inicialmente se consideraron dos mecanismos como posibilidades para la migración del grupo fosfatoxi del tipo mostrado en la eq 1. (Esta misma elección mecanicista existe para la migración de grupos aciloxicos y se discute en la Sección V.A del Capítulo 8.) El primero de estos mecanismos consistió en un par de reacciones competitivas concertadas, cada una de las cuales pasó por un estado de transición cíclica (Esquema 1). 3—7 Una diferencia básica entre este par fue que en una reacción el mismo átomo de oxígeno estaba unido a la estructura carbono-átomo tanto antes como después de la migración, pero en la otra la estructura tenía un átomo de oxígeno diferente unido después de la migración. Proponer migración a través de una combinación de estas dos reacciones permitió explicar experimentos con sustratos marcados con oxígeno en los que solo una porción del oxígeno marcado se adhirió a la estructura del átomo de carbono después de la migración. Los resultados de estudios tempranos favorecieron esta explicación de dos reacciones, 3—7 pero los de investigaciones posteriores requirieron que se cambiara debido a que los estudios posteriores mostraron que los intermedios iónicos estaban involucrados en el proceso de migración.
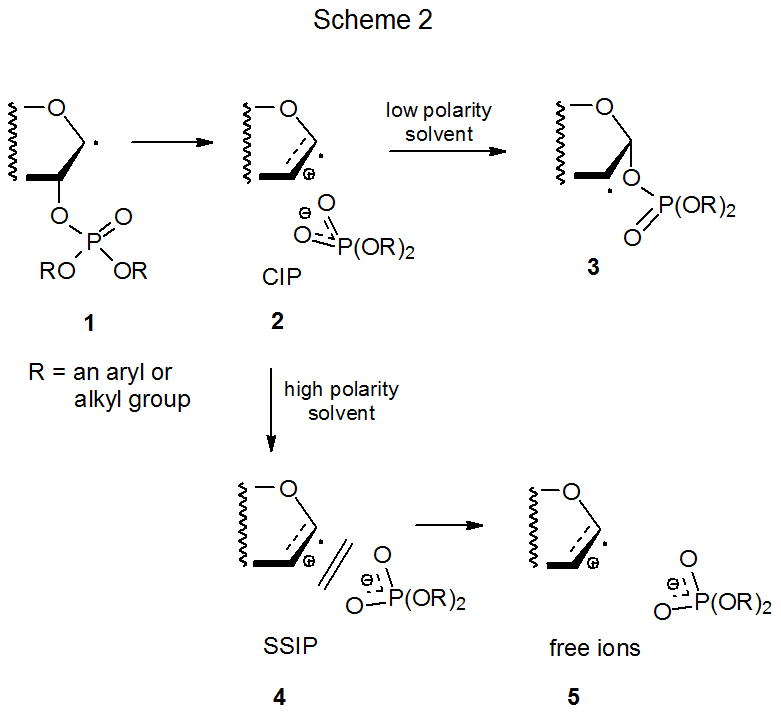
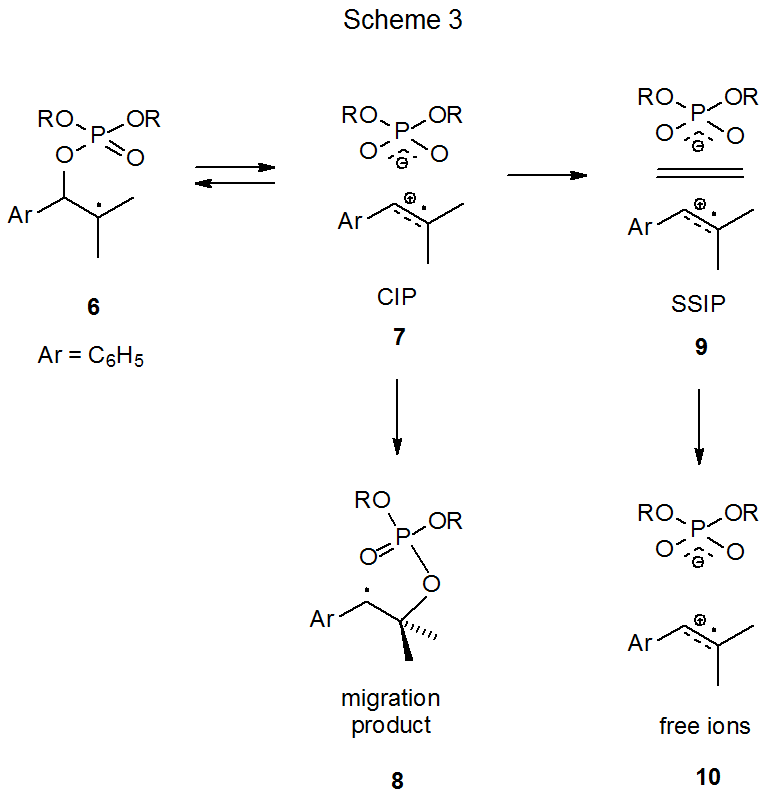
Un mecanismo que satisface el requisito iónico-intermedio se muestra en el Esquema 2, donde el radical β-fosfatoxi 1 se fragmenta heterolíticamente para dar el par iónico de contacto (CIP) 2. 8—13 Este par iónico se recombina en disolventes de baja polaridad para formar el radical migrado por grupos 3, pero en disolventes más polares el CIP también puede separarse para convertirse en un par iónico separado por disolvente (SSIP, 4) y luego iones libres 5. 10
El soporte crítico para el mecanismo de pares iónicos para la migración del grupo fosfatoxi proviene de experimentos de fotolisis por flash láser (LFP). Tanto el SSIP 9 como el catión difusivamente de radicales libres 10 pueden detectarse en estudios donde LFP genera el radical 6 (Esquema 3). 12 La evidencia del CIP en esta reacción es indirecta presumiblemente porque su vida útil es demasiado corta para permitir la detección directa. El estudio de las velocidades de reacción en disolventes de diferente polaridad respalda la idea de que el radical 6 está pasando por un intermedio común en la formación del radical migrado 8 o el SSIP 9. Una conclusión razonable es que el intermedio común es el par de iones de contacto 7 (Esquema 3). 12 Entropias de activación, que son las mismas para la formación de pares iónicos en disolventes de alta polaridad y la migración de grupos en disolventes de baja polaridad, también favorecen un intermedio común para el que 7 es el candidato principal. 10,12 Generalizar estos resultados conduce al mecanismo de reacción propuesto en el Esquema 2. (La redacción de este párrafo también se encuentra en la Sección V.A.5 del Capítulo 8 porque la información contenida es pertinente al mecanismo de migración del grupo aciloxi.)
Las migraciones del grupo fosfatoxi no están muy extendidas en la química de carbohidratos; de hecho, todas las reacciones reportadas implican migración de C-2 a C-1 en un anillo piranoide o furanoide. Esta situación existe porque la estabilización proporcionada por el átomo de oxígeno del anillo es crítica en el estado de transición que conduce a la formación de cationes radicales. El examen de la reactividad de los radicales no carbohidrato mostrados en las ecuaciones 4 y 5 es instructivo. Un átomo de oxígeno debe ser completamente capaz de participar en la estabilización de cationes radicales para que se produzca la ruptura del enlace heterolítico (eq 4). 14 Reemplazar el grupo metoxi en el sustrato en la reacción mostrada en la ecuación 4 con un grupo acetilo, como se hace en la reacción mostrada en la ecuación 5, evita la formación de cationes radicales debido a que un átomo de oxígeno con un grupo atractor de electrones unido es incapaz de estabilizar suficientemente la transición estado que conduce al intermedio radical-catión. 14
.png)
.png)
B. Tasas de reacción relativas
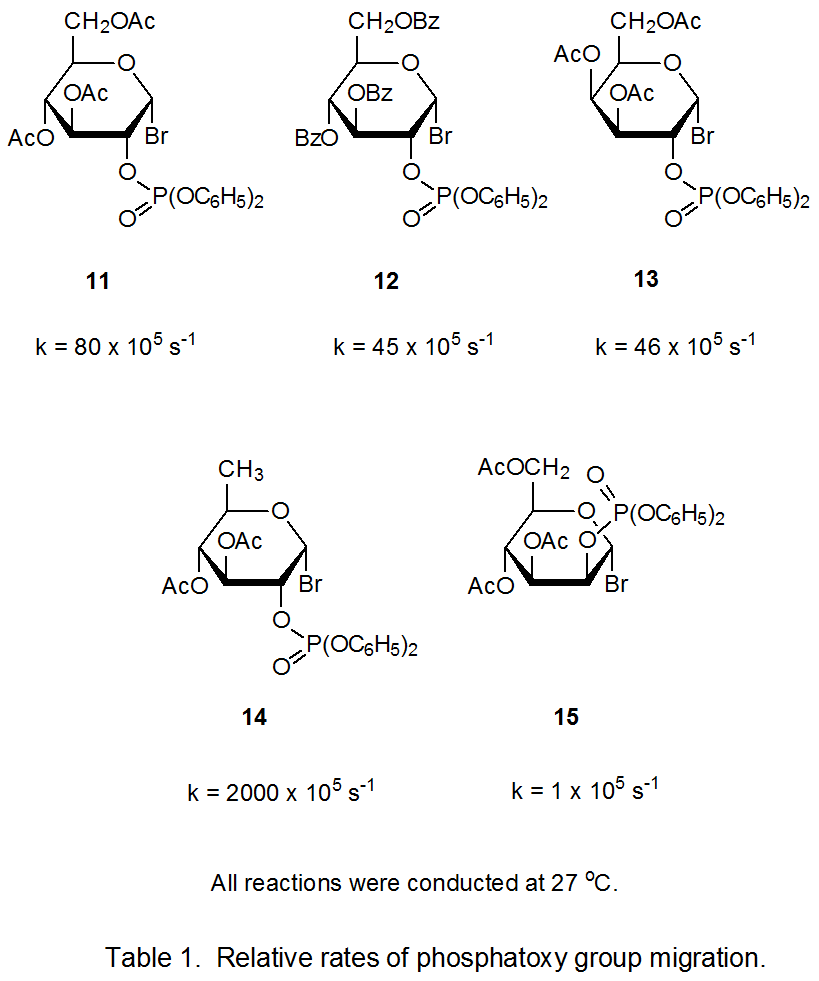
Las constantes de velocidad relativa para la migración del grupo fosfatoxi en las reacciones de los cinco bromuros de hexopiranosilo 11 - 15 se dan en el Cuadro 1. 15 La constante de velocidad para la reacción del 6-desoxibromuro 14 es sustancialmente mayor que la de los otros bromuros. Reemplazar el grupo aciloxi atractor de electrones en C-6 con un átomo de hidrógeno hace que el catión radical 16 sea más estable y, al hacerlo, estabiliza el estado de transición que conduce a él (eq 6).
.png)
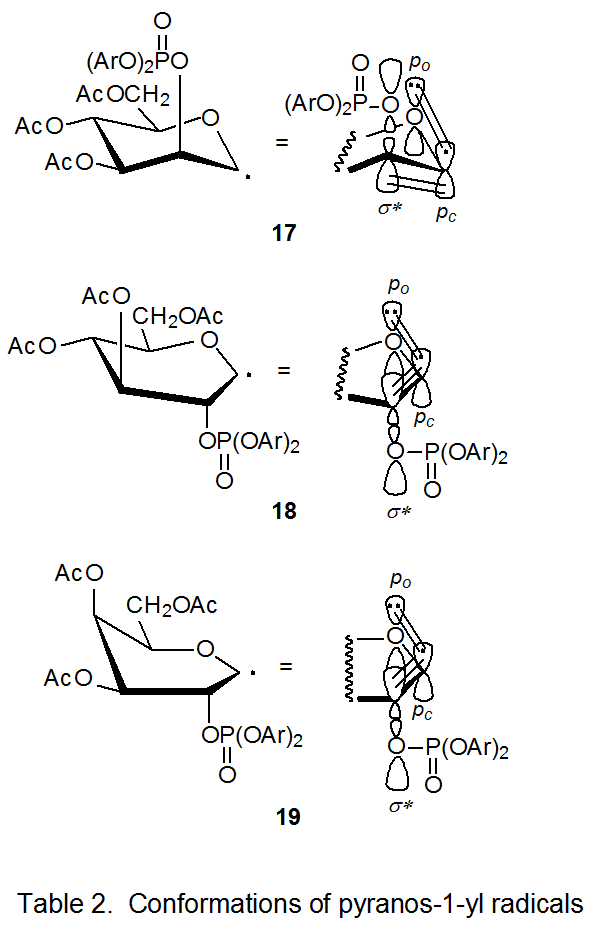
La constante de velocidad para la reacción del bromuro de D-manopiranosilo 15 es decididamente menor que las de las reacciones de los bromuros 11 - 14. Un factor que contribuye a esta reactividad reducida es la estabilidad mejorada del radical 17 cuando se compara con los radicales correspondientes derivados de los otros bromuros (11 - 14). Solo 17 permanecen en una conformación relativamente libre de tensión, 4 C 1 mientras se aprovecha la interacción estabilizadora de orbitales paralelos p o, p c y σ * (Cuadro 2). 15 Para beneficiarse de la estabilización paralelo-orbital, los radicales derivados de los bromuros 11 - 14 deben asumir conformaciones menos estables; por ejemplo, el radical derivado de 11 adopta la conformación de barca B 2,5 18. 15 A medida que la migración tiene lugar en cada uno de los radicales 17 - 19, p o, p c, σ * se pierde la estabilización orbital, pero para los radicales 18 y 19 esta pérdida se compensa, a menos en parte, por el movimiento hacia una conformación más estable, 4 C 1. Dicha compensación significa que los estados de transición para la formación de cationes radicales de 18 y 19 no son tan altos en energía como los de la reacción de 17; en consecuencia, la migración grupal para el radical 17 es más lenta que para 18 y 19.
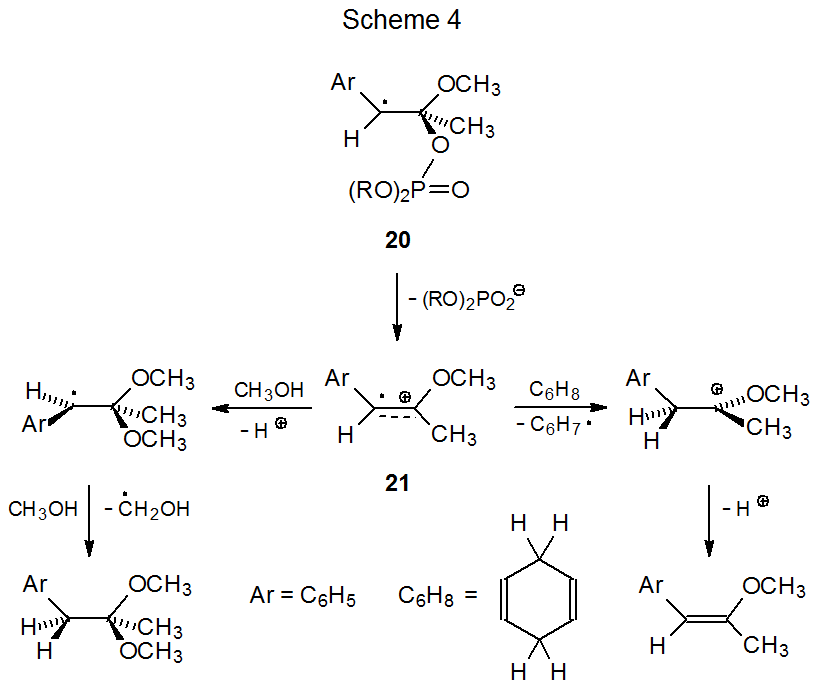
La información pertinente sobre la formación y reactividad de cationes radicales proviene del estudio de sistemas no carbohidrato. 16,17 El atrapamiento nucleofílico del catión radical 21 por metanol (k< 1 x 10 3 M -1 s -1) es lento en comparación con la abstracción de átomos de hidrógeno de 1,4-ciclohexadieno (k = 6 x 10 5 M -1 s -1) ( Esquema 4). 17 En la medida en que esta observación es general, se puede esperar que los cationes radicales tengan mayor reactividad radical que reactividad catiónica.
C. Estereoselectividad
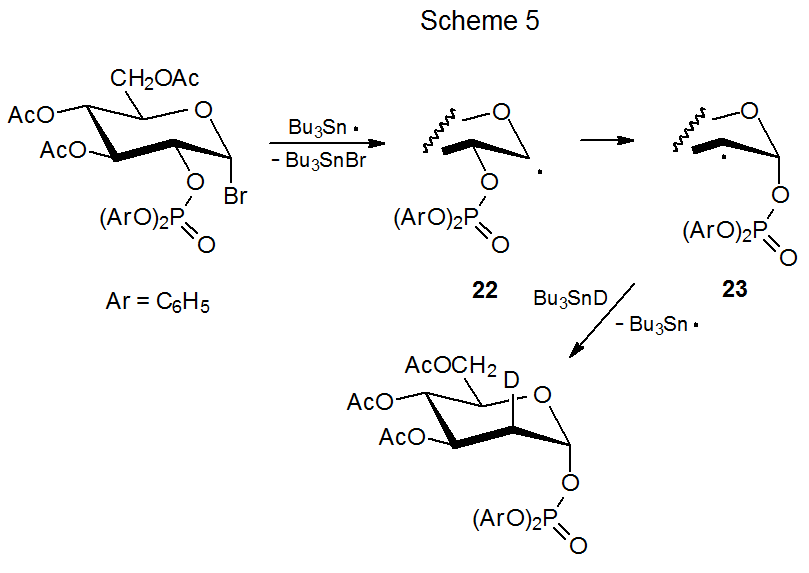
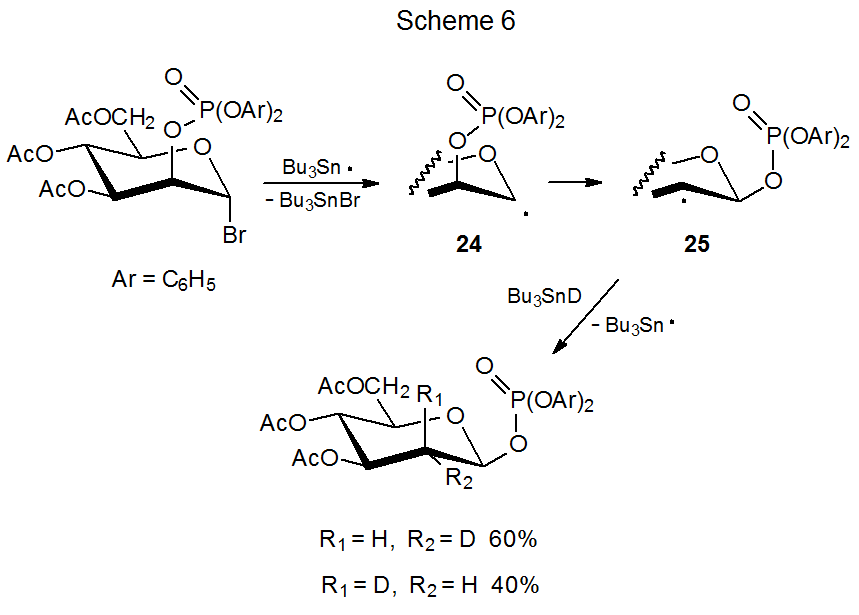
Las reacciones que se muestran en los Esquemas 5 y 6 muestran que la migración del grupo fosfatoxi es un proceso estereoespecífico; así, los radicales epiméricos 22 y 24 dan los radicales producto 23 y 25, respectivamente. 1,15 Una vez que se ha producido la migración, la abstracción estereoselectiva de deuterio completa la reacción. Para el radical 23 la abstracción es altamente estereoselectiva, pero lo es mucho menos para el radical 25. El blindaje de la cara α de 23 por el grupo fosfatoxi axial provoca que el deuterio se abstraga de la cara β de este radical (Esquema 5). El grupo fosfatoxi ecuatorial en 25 no es tan efectivo para forzar Bu 3 SnD a la cara opuesta del anillo piranoide (Esquema 6).
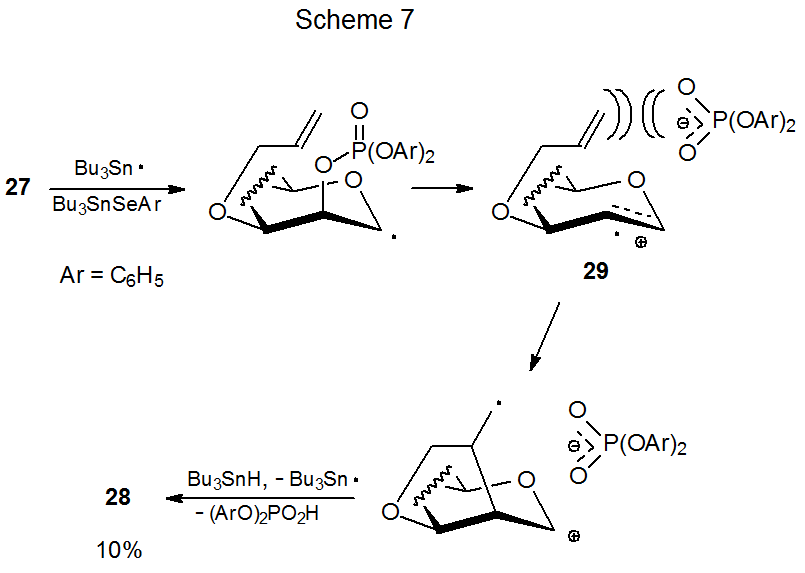
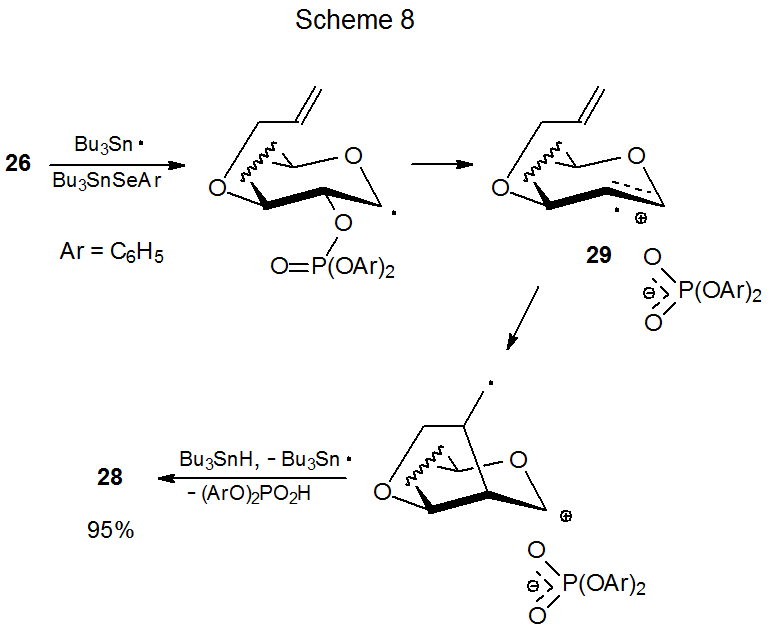
El blindaje diferencial de las caras de un anillo piranoide afecta la capacidad de los fosfatos 26 y 27 para experimentar nueva formación de anillo (eq 7). El fosfato 26 da un rendimiento decididamente mayor del glical 28 que su epímero 27. 18 El rendimiento de producto sustancialmente menor de la reacción de 27 se atribuye al impedimento estérico por el contraión fosfato cercano durante la ciclación del catión radical 29 (Esquema 7). Sin embargo, cuando 29 se genera a partir del 26, el contraión se encuentra en la cara opuesta del anillo y no impide la ciclación (Esquema 8).
.png)