II. Adición Intramolecular de Radicales Centrados en Carbono a Grupos Aldehído y Keto
- Page ID
- 80092
La posibilidad de aislar un producto de la adición intermolecular de un radical centrado en carbono a un aldehído o cetona es pequeña debido a la rápida reversibilidad de esta reacción (eq 1), pero la posibilidad de aislamiento del producto aumenta considerablemente si la reacción se vuelve intramolecular adición de un radical centrado en carbono a un grupo aldehido o cetopara dar un radical centrado en un átomo de oxígeno que está unido a un anillo de cinco o seis miembros.
Un ejemplo de tal reacción se muestra en el Esquema 1, donde el radical 2 centrado en carbono, generado a partir de 6-bromohexanal (1), se convierte reversiblemente en el radical alcoxi cíclico 3. 1 La abstracción de átomos de hidrógeno por 3 a partir de hidruro de tri- n-butilestaño tiene una constante de velocidad sustancialmente mayor que la de la abstracción por 2; en consecuencia, aunque la apertura del anillo es más rápida que el cierre del anillo, la reacción produce ciclohexanol como principal producto y hexanal como menor.
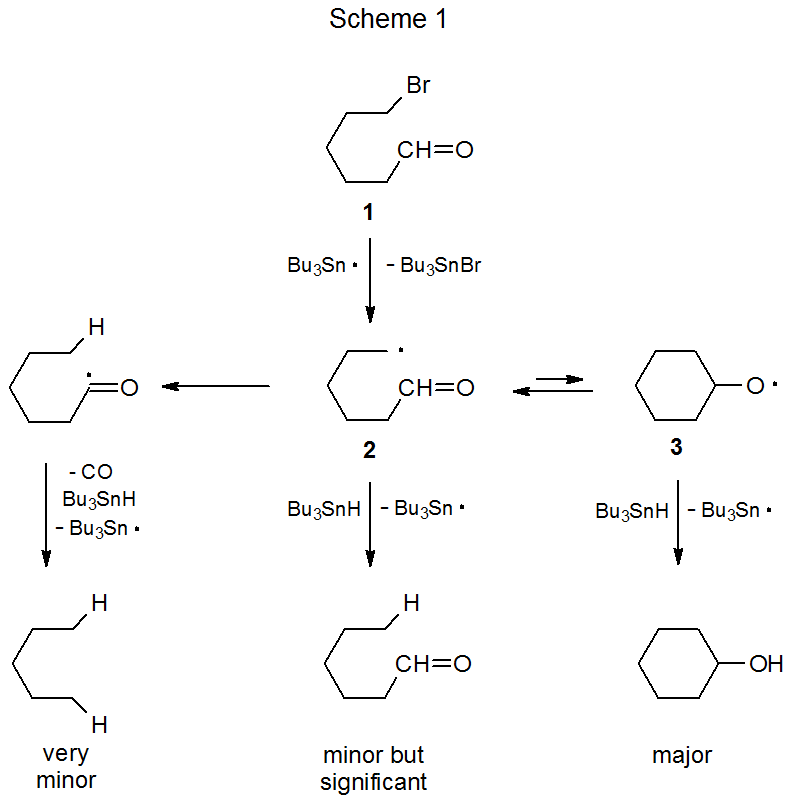
La abstracción intramolecular de átomos de hidrógeno del grupo aldehido en 2 es un proceso muy menor. La incapacidad de esta abstracción para competir con la formación de anillos en un sistema no carbohidrato se hace eco en las reacciones de radicales carbohidrato que contienen grupos aldehídos. La reacción que se muestra en el Esquema 2 es una de las varias discutidas en este capítulo donde la abstracción de átomos de hidrógeno a partir de un grupo aldehido es posible pero no tiene lugar. 2
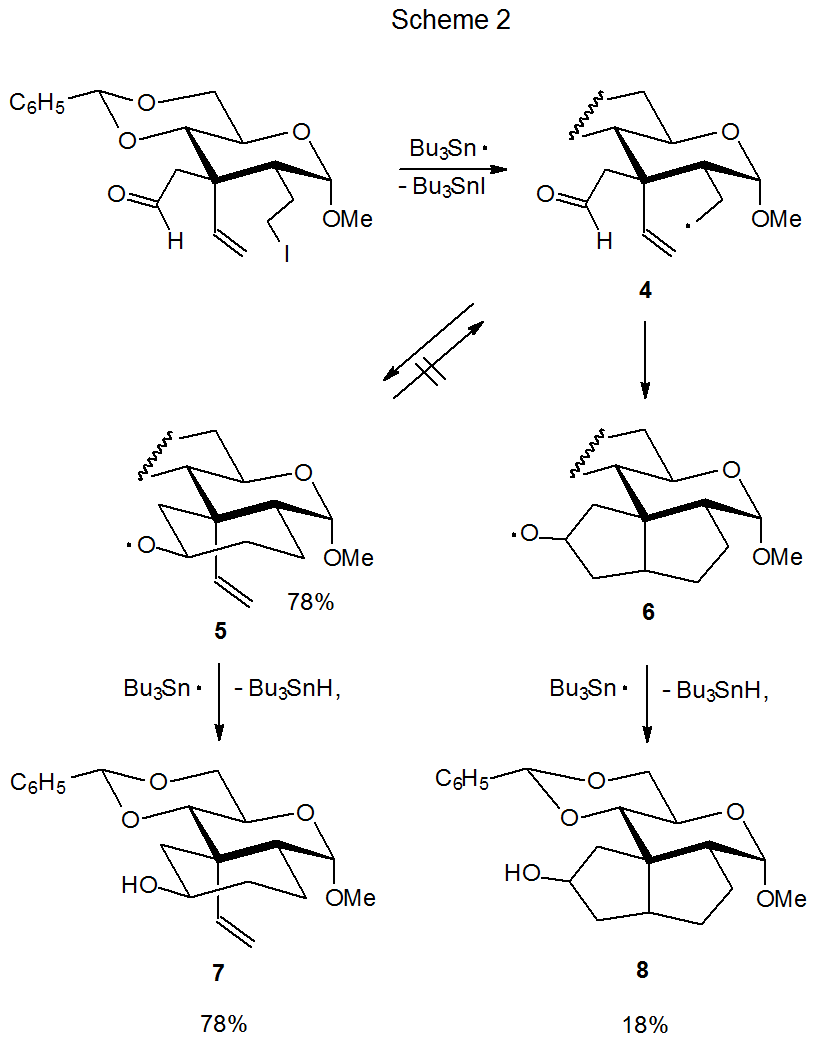
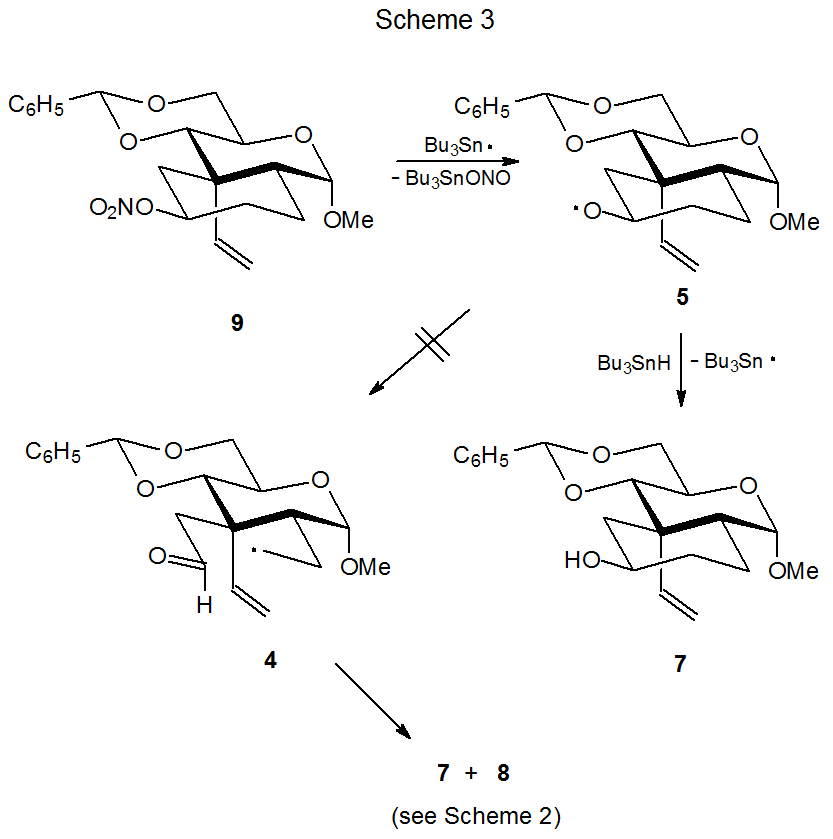
Aunque la apertura del anillo siempre es una posibilidad para los radicales alcoxi cíclicos, esta transformación a veces no tiene lugar; por ejemplo, la reacción que produce el radical alcoxi 5 a partir del radical 4 de anillo abierto no es reversible (Esquema 2). 2,3 La falla del anillo de ciclohexano en 5 para abrirse se demuestra por reacción del éster nitrato 9 (Esquema 3). 3 El tratamiento de 9 con Bu 3 SnH produce 5 (y finalmente el producto 7) pero la apertura del anillo para dar 4 no ocurre. Si se formara el radical 4 de anillo abierto, el producto 8 también se produciría en esta reacción, pero como no se pudo detectar 8, la conclusión es que el radical alcoxi 5 no experimenta apertura de anillo. 3
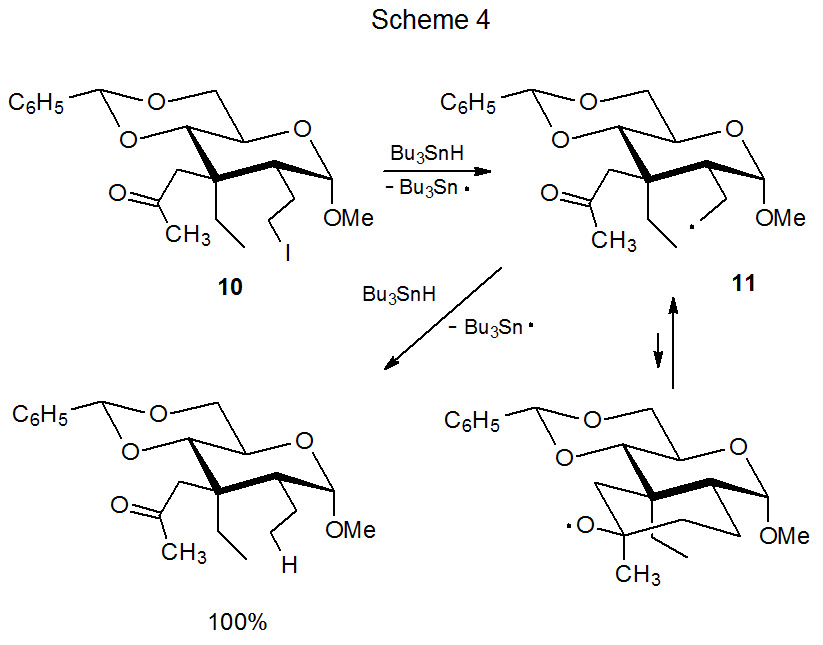
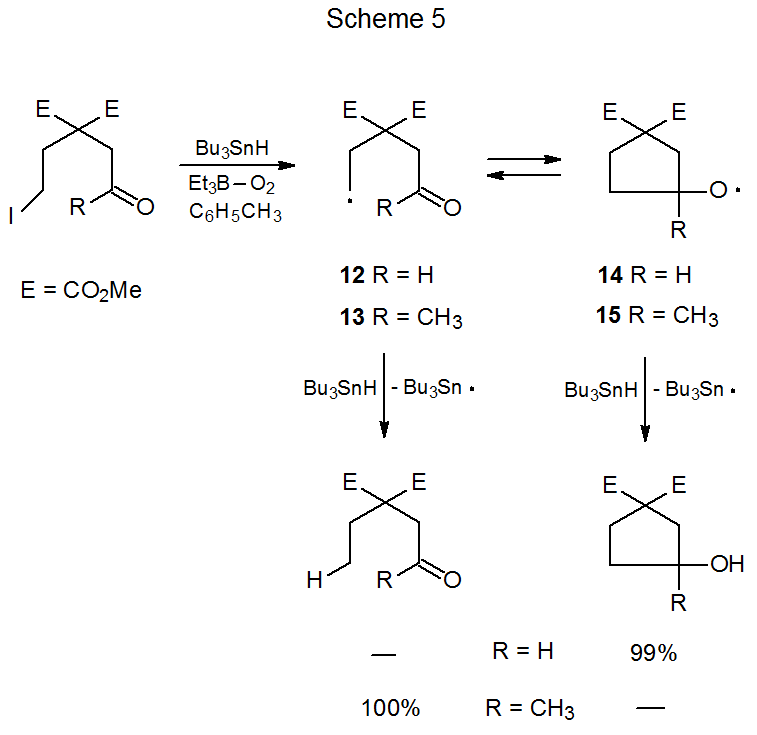
En contraste con la ciclación del radical aldehido 4 (Esquema 2), el radical ceto-11 estrechamente relacionado (Esquema 4) no forma un nuevo sistema de anillos. 4 O bien el mayor impedimento estérico inherente a la producción de un radical alcoxi terciario o la rápida apertura del anillo de dicho intermedio deformado o ambos son suficientes para evitar que 11 forme un nuevo sistema de anillos. Estas razones para no formar un nuevo anillo extraen apoyo de las reacciones de los radicales no carbohidrato 13 y 14 (Esquema 5). 5 En la reacción mostrada en el Esquema 5 donde R es un grupo metilo, la abstracción de átomos de hidrógeno a partir de hidruro de tri- n-butilestaño se realiza exclusivamente por el radical de cadena abierta 13. Cuando R es un átomo de hidrógeno, la abstracción de Bu 3 SnH ocurre solo después de la conversión del radical 12 de cadena abierta en el radical alcoxi cíclico 14.
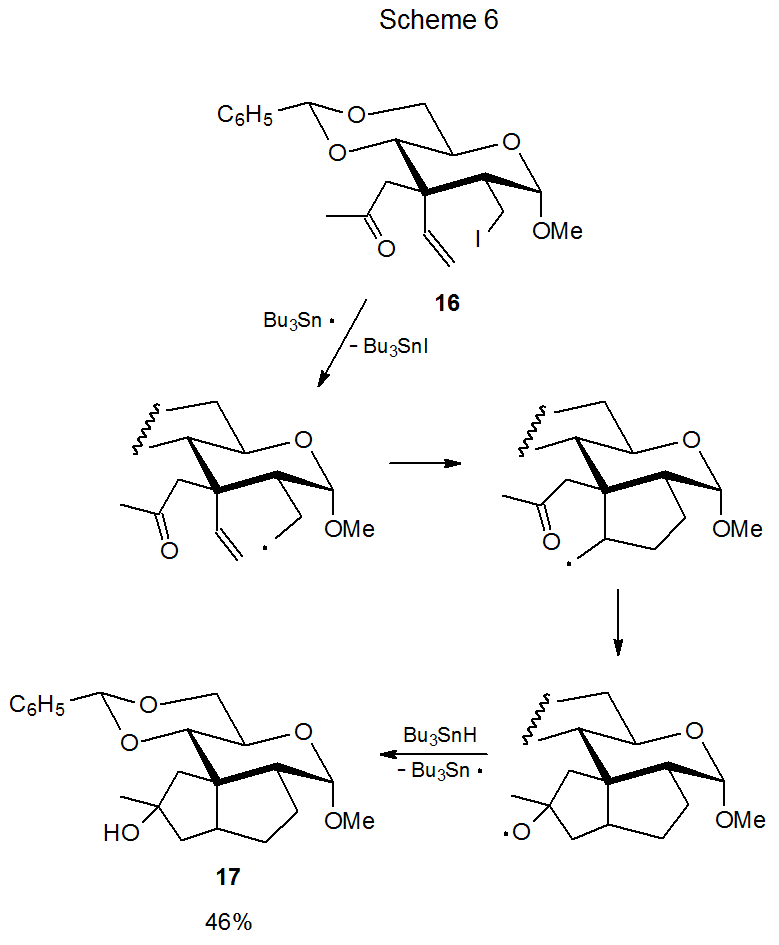
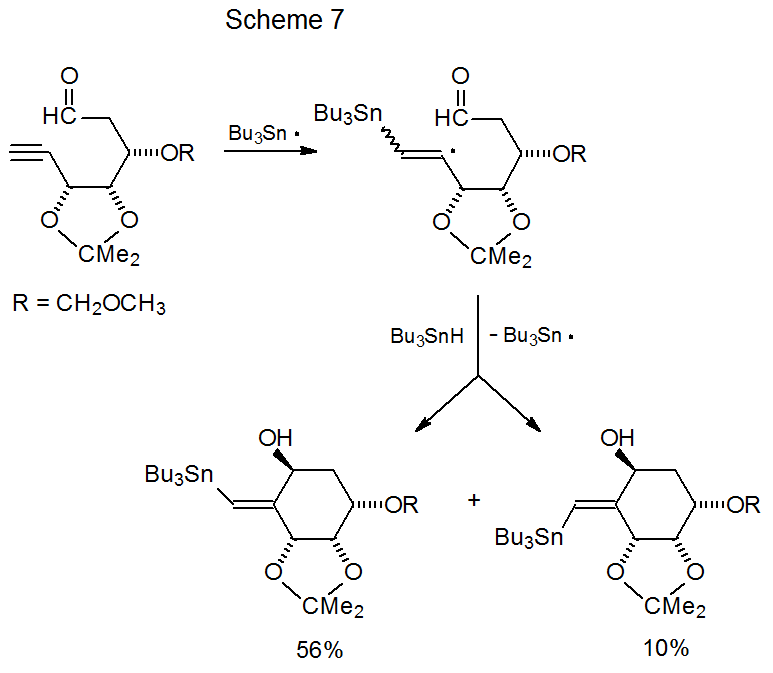
Los reactivos del radical aldehido 4 (Esquema 2) y el radical ceto-11 (Esquema 4) plantean una serie de preguntas (enumeradas a continuación) sobre la participación de grupos cetogénicos y aldehídos en reacciones de ciclación radical. Muchas de estas preguntas han sido respondidas por el estudio de compuestos relacionados. Sus respuestas proporcionan una visión de los factores que controlan el proceso de ciclación. Estas preguntas y sus respuestas son:


.png)
.png)
.png)