III. (Tiocarbonil) imidazolidas
- Page ID
- 79893
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
La formación de una (tiocarbonil) imidazolida (3) implica generalmente calentar un carbohidrato parcialmente protegido con N, N-tiocarbonildiimidazol (4, TCDI) a reflujo en tetrahidrofurano (o 1,2-dicloroetano) y aislar el producto de reacción mediante cromatografía (eq 2). 1,11 Casi todas las síntesis de una (tiocarbonil) imidazolida siguen este procedimiento, aunque ocasionalmente se utilizan como disolventes de reacción acetonitrilo, 12—14 tolueno, 15—17 y N, N-dimetilformamida 18 ,19.
.png)
Hay reportes dispersos de (tiocarbonil) imidazolidas que se forman más lentamente de lo que cabría esperar en las condiciones típicas de reacción. Uno de esos informes se refiere al metilglucósido 5, un compuesto que reacciona tan lentamente que la activación previa con óxido de bis (tributilestaño) es necesaria para aumentar la nucleofilia de 5 hasta el punto de que la formación de (tiocarbonil) imidazolida se produce a una velocidad aceptable (Esquema 3) ). 20

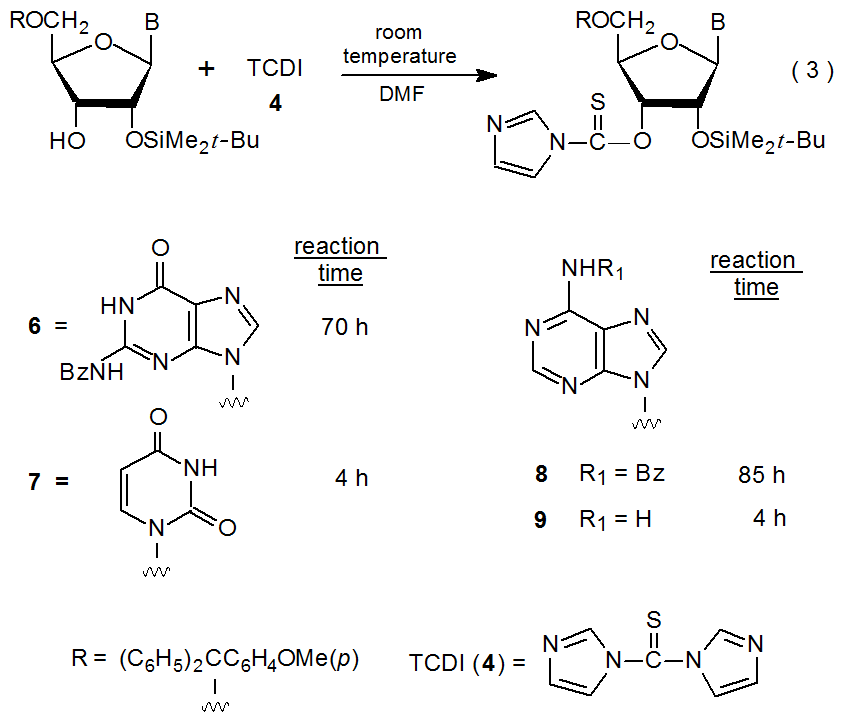
La reducción de la reactividad en los nucleósidos a veces se produce por N-benzoilación. Los derivados de N-benzoilguanosina y adenosina 6 y 8 requieren tratamiento con TCDI (4) durante 70 y 85 horas, respectivamente, para que tenga lugar la reacción completa; en contraste, derivados que carecen del grupo N-benzoilo (7 y 9), necesitan solo cuatro horas para que la reacción alcance su finalización (eq 3). 21
.png)
Aunque las (tiocarbonil) imidazolidas (3) se pueden preparar fácilmente mediante la reacción mostrada en la ecuación 2, este procedimiento tiene varios inconvenientes menores. Una de ellas es que el N, N-tiocarbonildiimidazol (4, TCDI) necesita mantenerse en una atmósfera seca porque es inestable en presencia de humedad atmosférica. 22 Otra es que el imidazol, producido como subproducto en esta reacción (eq 2), puede catalizar la transformación no deseada de algunos compuestos. 22 Finalmente, el costo del TCDI (4) es lo suficientemente alto como para ser un factor a la hora de decidir sobre su uso, particularmente en reacciones a gran escala.
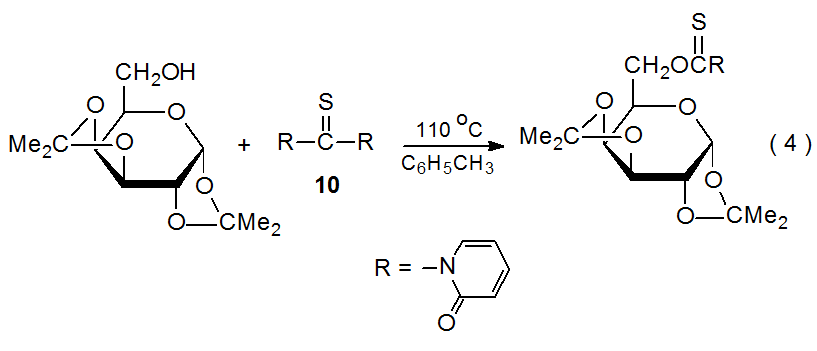
En un esfuerzo por superar las posibles desventajas asociadas con el uso de (tiocarbonil) imidazolidas, algunos investigadores han propuesto cambiar a compuestos relacionados. Los tionocarbamatos formados a partir de 1,1'-tiocarbonildi-2,2'-piridona (10), un reactivo estable a la humedad atmosférica, son reemplazos efectivos para las (tiocarbonil) imidazolidas (eq 4), 22 pero restando valor al uso de este nuevo reactivo (10) es su costo aún mayor que el TCDI.
.png)
Algunos tionocarbamatos sintetizados a partir del isotiocianato de fenilo económico (11) (eq 5) son capaces de formar radicales. 23,24 Aunque producir un tionocarbamato haciendo reaccionar un carbohidrato parcialmente protegido con isotiocianato de fenilo (11) resuelve el “problema de costo”, tiene la desventaja de que esta reacción requiere la presencia de una base fuerte porque la desprotonación del grupo hidroxilo es necesaria para esta reacción se produzca a una velocidad aceptable (eq 5). Además, no todos los tionocarbamatos preparados a partir de 11 forman radicales bajo condiciones de reacción típicas. 25 Ninguna de las alternativas a las (tiocarbonil) imidazolidas ha sido ampliamente adoptada.
.png)

