VII. Factores que afectan la síntesis de compuestos de O-tiocarbonilo
- Page ID
- 79908
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
A. La Fuerza del Nucleófilo Participante
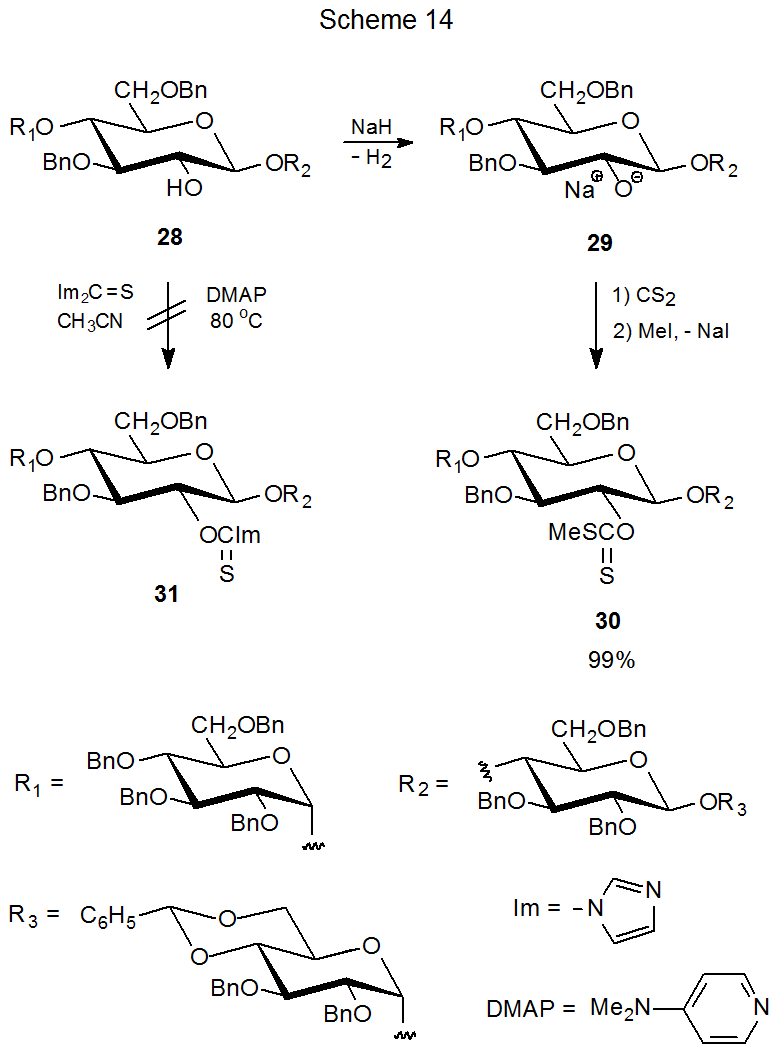
Algunos compuestos no forman todos los tipos de derivados de O - tiocarbonilo. El tetrasacárido 28, por ejemplo, no produce una (tiocarbonil) imidazolida (31) pero sí forma un xantato (30) (Esquema 14). 62 Una posible explicación de esta diferencia de comportamiento se basa en la reactividad de los nucleófilos involucrados en la preparación de cada derivado. El primer paso en la formación de xantato es la conversión de 28 en el poderoso nucleófilo 29 por desprotonación del grupo hidroxilo C-2' con hidruro de sodio. Estas condiciones de reacción contrastan con las de la síntesis de (tiocarbonil) imidazolida, que depende del nucleófilo menos efectivo 28. (La pequeña concentración de equilibrio del ion alcóxido 29, producida por la desprotonación de DMAP de 28, es insuficiente para hacer que la (tiocarbonil) imidazolida 31 se forme en cantidades detectables).
Otro ejemplo que ilustra el papel de la nucleofilia en la producción de compuestos de O- tiocarbonilo se refiere al fenoxitionocarbonato 34, que no se puede preparar a partir del diol 32, a pesar de que el xantato 35 se forma fácilmente a partir de este compuesto (32 ) por medio del ion alcóxido 33 (Esquema 15). 63 Una vez más, una mayor facilidad en la formación de xantato puede estar ligada a una mayor nucleofilia de un ion alcóxido en comparación con su alcohol correspondiente.

Un método para aumentar la nucleofilia de un carbohidrato parcialmente protegido sin convertirlo en un compuesto totalmente iónico consiste en formar un derivado que contiene un enlace estaño-oxígeno. Este es el enfoque adoptado en varias de las reacciones (Esquemas 2, 3, 8 y 11 y ecuaciones 12 y 13) discutidas hasta el momento. En la derivatización mostrada en el Esquema 3, por ejemplo, la combinación del metilglicósido 5 con óxido de bis (tributilestaño) forma un nucleófilo capaz de producir una (tiocarbonil) imidazolida, pero la reacción de 5 sin aumentar su nucleofilia no tiene éxito. 20
Otra ventaja de la nucleofilia de un ion alcóxido al participar en la síntesis de xantato es que la reacción puede tener lugar a bajas temperaturas. 64,65 La reacción que ocurre bajo estas condiciones es particularmente importante para formar xantatos terciarios (eq 15 64) porque estos compuestos experimentan fácilmente reacciones de reordenamiento térmico y eliminación. 66
.png)
B. Migración y pérdida de grupos protectores
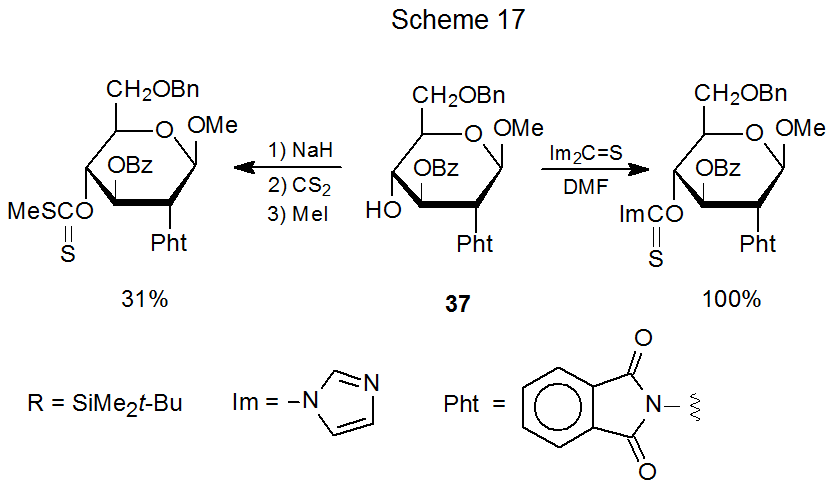
Aunque aumentar la nucleofilia de un grupo hidroxilo por desprotonación a veces es útil para formar un compuesto de O-tiocarbonilo, la desprotonación también promueve la migración de grupos protectores. El compuesto 36, por ejemplo, forma una (tiocarbonil) imidazolida con el grupo sililo permaneciendo en su lugar, pero el intento de síntesis del xantato correspondiente provoca la migración completa del grupo sililo O-2' a O-3' (Esquema 16). 67 En otro ejemplo, el compuesto 37 forma un xantato con solo 31% de rendimiento, pero la formación de (tiocarbonil) imidazolida es cuantitativa (Esquema 17). 68 La migración de grupos (Esquema 16) y el rendimiento reducido del producto (Esquema 17) (posiblemente a través de la pérdida o migración del grupo benzoilo o ambos) están ligados a la nucleofilia de los iones alcóxido formados durante la síntesis de xantato.

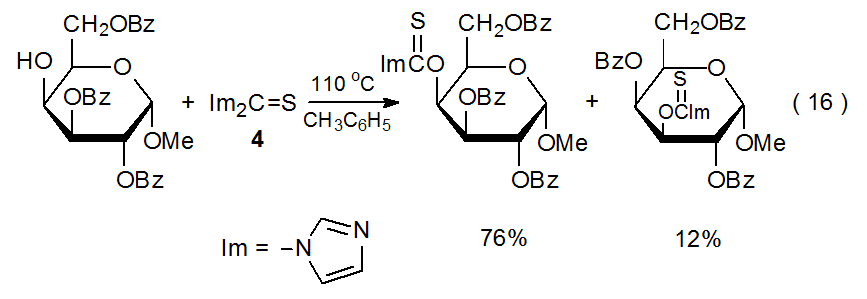
Aunque la ausencia de una base fuerte durante la formación de (tiocarbonil) imidazolida reduce la probabilidad de migración grupal, no elimina esta posibilidad por completo. Siempre que un átomo de carbono que lleva un grupo hidroxilo tenga un grupo aciloxi o sililoxi en un átomo vecino (o cercano), la migración del grupo es una posibilidad 15 ,69,70 porque la base orgánica (y catalizador) imidazol se genera a medida que avanza la reacción (eq 2). Un ejemplo de una reacción de migración que tiene lugar durante la síntesis de (tiocarbonil) imidazolida se muestra en la ecuación 16, donde el grupo benzoílo en O-3 en el material de partida migra a O-4 en la formación del producto menor. 15
.png)
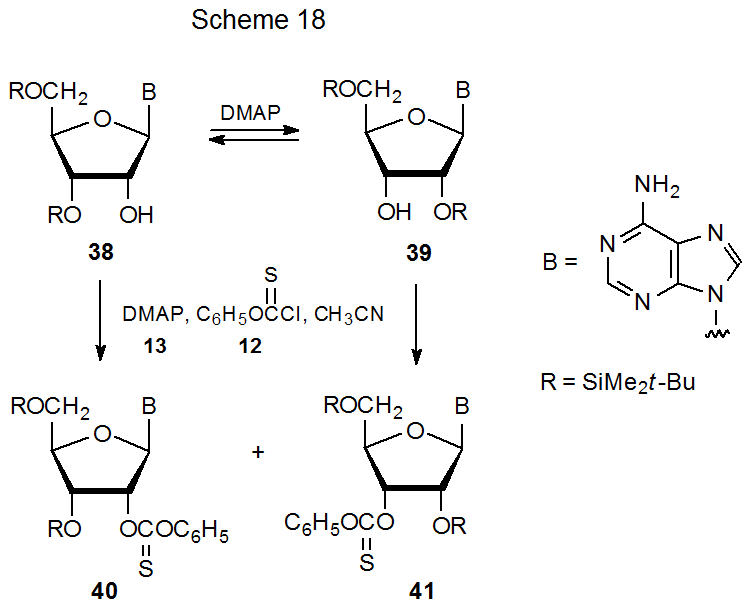
La posibilidad de que el imidazol cause migración grupal durante la formación de (tiocarbonil) imidazolida obtiene apoyo de la observación de que DMAP causa dicha reacción durante la síntesis de tionocarbonato. Los tionocarbonatos de fenilo 40 y 41 se forman ambos cuando cualquiera de los nucleósidos 38 o 39 reacciona con cloruro de fenoxitocarbonilo (12) (Esquema 18). 71 La formación de esta mezcla de productos (40 y 41) es el resultado de la migración de grupos sililo catalizada por DMAP en los compuestos 38 y 39 antes de la esterificación (Esquema 18).
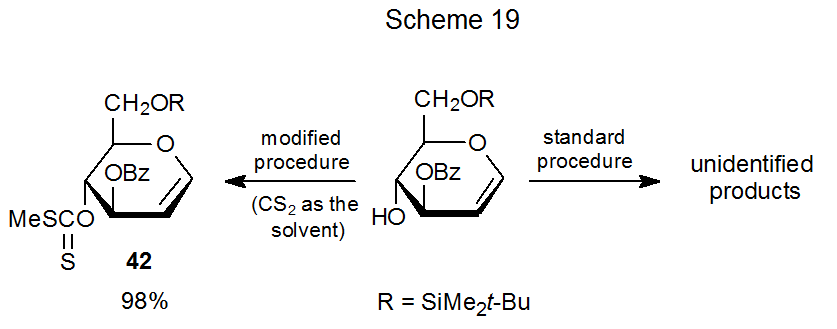
La migración de grupos a veces se puede evitar por modificación en las condiciones de reacción. El xantato 42, por ejemplo, no se puede sintetizar por el procedimiento estándar, pero se forma con excelente rendimiento cuando el disulfuro de carbono es el disolvente de reacción (Esquema 19). 72 Cuando el disulfuro de carbono está presente en gran exceso, el aumento de la tasa de formación de xantato suprime las reacciones competitivas, unimoleculares como la migración grupal.
C. Reacciones de desplazamiento
Los grupos O-tiocarbonilo pueden funcionar como nucleófugos en reacciones de desplazamiento. No son particularmente eficaces en este papel; en consecuencia, su participación se limita a la reacción interna en la que el nucleófilo se crea por desprotonación y se mantiene en una posición ventajosa para la reacción. Un ejemplo de desplazamiento interno de este tipo se muestra en el Esquema 20 donde el tionocarbonato 44 se forma con buen rendimiento a partir de la reacción del nucleósido 43 con cloruro de fenoxitiocarbonilo (12) en presencia de piridina, pero cuando la base más fuerte DMAP ( 13), el desplazamiento interno de S N 2 produce el anhidro nucleósido 45. 73 El apoyo a la idea de que 44 es un intermedio en esta reacción proviene de su conversión cuantitativa a 45 por reacción con DMAP.

Los tionocarbonatos cíclicos también pueden ser sustratos en reacciones de sustitución nucleofílica. 74,75 En la reacción mostrada en el Esquema 21, por ejemplo, la formación del derivado 2',3'-O-tiocarbonilo 46 coloca a los nucleófugos en C-2' y C-3'. El sustituyente C-2' es desplazado entonces por un átomo de oxígeno en la porción de base nitrogenada de la molécula. 74

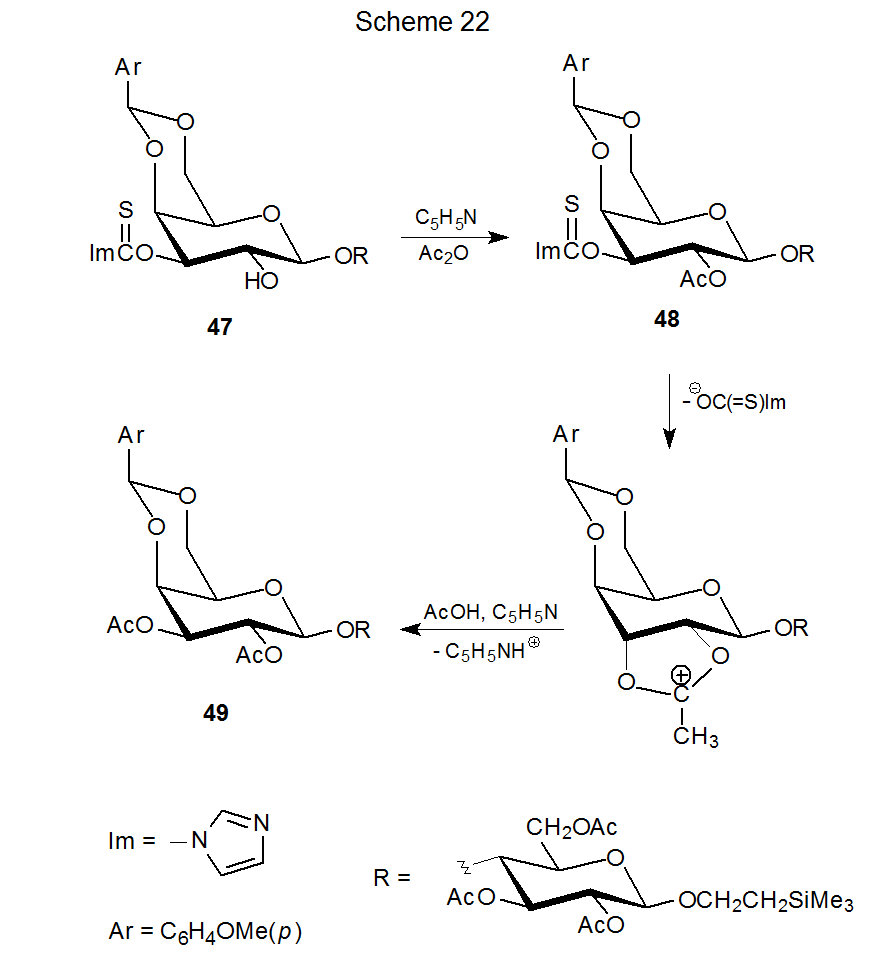
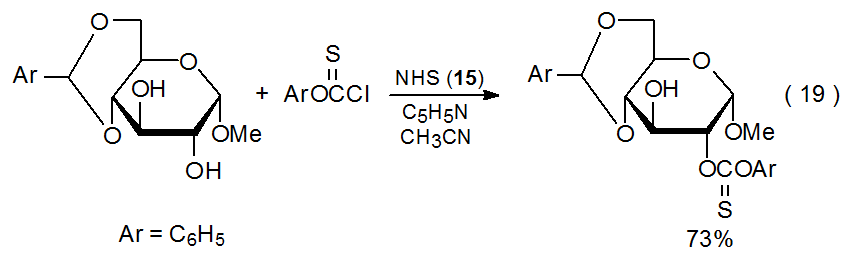
Otro ejemplo de sustitución nucleofílica que implica un compuesto de O-tiocarbonilo se encuentra en el Esquema 22, donde el intento de acetilación del disacárido 47 provoca la sustitución del grupo O-imidazol-1-iltiocarbonilo por un grupo acetilo. 10 Una suposición razonable es que el acetato deseado 48 realmente se forma, pero el grupo O-imidazol-1-iltiocarbonilo es un nucleófugo suficientemente bueno como para ser desplazado por el grupo O-acetilo vecino en una reacción que conduce al pentaacetato 49. La acetilación del xantato 50 estrechamente relacionado (eq 17) sin desplazamiento interno indica que el grupo O - [(feniltio) tiocarbonilo] es un nucleófugo menos efectivo. 10
.png)
D. Reacciones regioselectivas
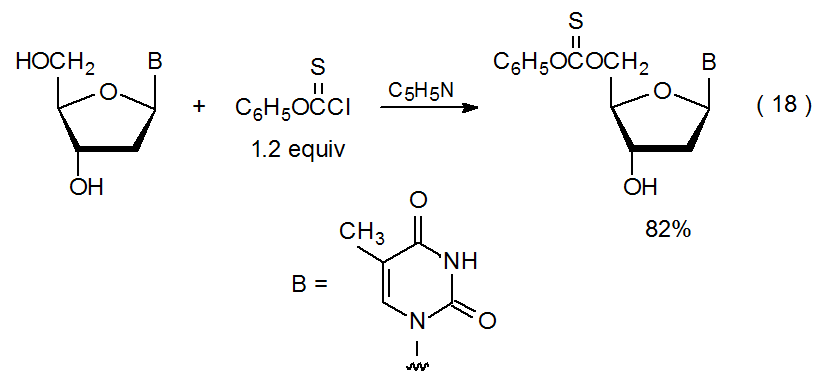
En un carbohidrato con más de un grupo hidroxilo desprotegido, a veces es posible predecir qué grupo reaccionará preferentemente con una cantidad limitada de un agente tioacilante. Por ejemplo, la reacción de los grupos hidroxilo menos impedidos ocurrirá si hay una diferencia sustancial en su blindaje estérico; así, en la reacción mostrada en la eq 18, la tioacilación regioselectiva tiene lugar en el grupo hidroxilo primario, en lugar del secundario. 76
.png)
Incluso si hay poca diferencia en el blindaje estérico de dos grupos hidroxilo, la selectividad del sitio a veces se puede predecir si uno de los grupos está unido a C-2 y la desprotonación es el primer paso en la reacción. Bajo estas condiciones, la acidez típicamente mayor del grupo hidroxilo C-2 determina cuál de los dos posibles iones alcóxido se formará en mayor medida. Esta formación preferencial conduce a una reacción regioselectiva en C-2 (Esquema 15 63 y eq 19 30). La comparación de la reacción mostrada en la eq 19 30 con la de la eq 14 1 demuestra que la predicción de la reacción regioselectiva en C-2 se debe hacer con cautela. En estas dos reacciones el mismo compuesto exhibe diferente selectividad cuando cambian los reactivos y las condiciones de reacción.
.png)
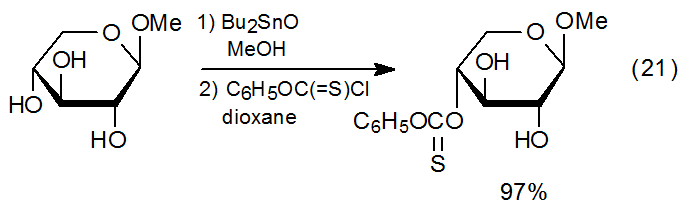
La regioselectividad se extiende a reacciones donde la esterificación está precedida por la formación de un complejo de estannileno (ecuaciones 12 y 13). Dado que esta selectividad depende de la estabilidad y reactividad de los diversos complejos de estannileno que están en equilibrio en la mezcla de reacción, predecir o incluso racionalizar la formación de productos de reacción se complica por esterificación que es un proceso de dos etapas con selectividad implicada en cada paso. Aunque la reacción regioselectiva de los complejos de estannileno suele ser alta, está lejos de estar asegurada, como se ilustra por la reacción casi no selectiva del metilglucósido 51 (eq 20). 52 La dificultad para predecir la selectividad del sitio se subraya cuando se compara la reacción mostrada en la ecuación 20 con la de la ecuación 21, donde una reacción esencialmente no selectiva se vuelve altamente selectiva al cambiar la configuración del grupo metoxi en C-1. 52 Bajo condiciones cuidadosamente seleccionadas, la reacción de complejos organoestánnicos de una variedad de metilglucósidos desprotegidos con cloruro de fenoxitiocarbonilo conduce a la formación de tionocarbonato altamente regioselectiva. 53
.png)
.png)

