III. Configuración Radical-Center
- Page ID
- 79444
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
A. Estructuras Planares y Piramidales
La configuración de un radical define la ubicación en el espacio de los átomos directamente unidos al centro radical. Cuando tres de estos átomos están unidos al átomo de carbono sobre el cual se centra un radical, la configuración es plana o piramidal. 4 Una configuración plana es aquella en la que los átomos unidos directamente al centro radical y al centro mismo existen todos en el mismo plano (Figura 1). Para los radicales piramidales el plano definido por estos átomos directamente unidos ya no incluye el átomo central (Figura 1).
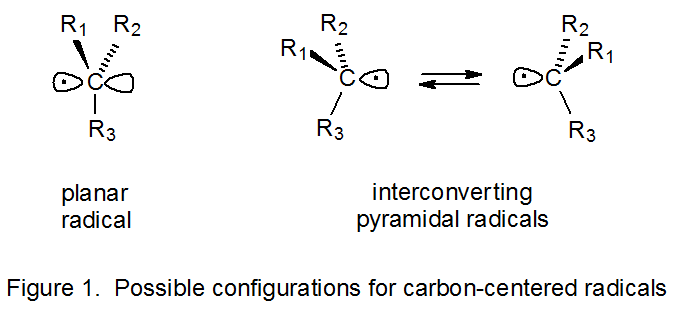
Casi todos los radicales centrados en carbono tienen una configuración piramidal en el centro radical, pero estos radicales varían ampliamente en lo cerca que están sus configuraciones de ser planos. 5 Ha surgido una terminología que está diseñada para indicar una configuración radical aproximada. Si un centro radical tiene una disposición casi plana de átomos unidos, el radical se describe como de tipo π. 6 (Dado que en un radical de tipo π el orbital en el que se centra el electrón está cerca de ser un orbital p, este orbital a menudo se conoce como de tipo p.) Si un radical tiene una configuración decididamente piramidal (es decir, una que se aproxima a la correspondiente a la hibridación sp 3), el radical se describe como de tipo σ‑type.
Los radicales piramidales centrados en carbono sin sustituyentes electronegativos unidos al centro radical tienden a tener una pequeña distorsión de la planaridad; 5 es decir, generalmente se consideran radicales de tipo π. (Vale la pena señalar que la magnitud del ángulo de distorsión puede ser engañosa. La distorsión relativamente pequeña de 6.2 o de planaridad reportada para el radical etilo significa que este radical es en realidad aproximadamente 1/3 de la manera de ser sp 3 hibridado. 7) La distorsión de la disposición plana aumenta a medida que los sustituyentes aceptores de electrones reemplazan a otros grupos unidos al centro radical. El cambio en la configuración que acompaña al reemplazo de los átomos de hidrógeno en el radical metilo por átomos de flúor proporciona un claro ejemplo del efecto de los sustituyentes electronegativos en la geometría radical. 5,8,9 El radical metilo es plano, o casi así, 10 pero la sustitución progresiva de los átomos de hidrógeno por átomos de flúor produce radicales piramidales con estructuras cada vez más alejadas de la planaridad hasta que se alcanza el radical trifluorometilo, en cuyo caso el enlace F-C-F los ángulos son similares a los que se encuentran en las estructuras tetraédricas. 11
B. Determinación Configuracional a partir de Constantes de Acoplamiento Hiperfino α- 13 C
La información sobre la configuración radical se puede obtener del análisis de las constantes de acoplamiento hiperfino α- 13 C. Estas constantes de acoplamiento, obtenidas de los espectros ESR de 13 radicales enriquecidos en C, proporcionan una medida sensible de la hibridación en un centro radical. 12,13 La configuración de un radical piranos-1-ilo es naturalmente de considerable interés debido al papel único del átomo de carbono anomérico en la química de carbohidratos. Las constantes de acoplamiento hiperfina α- 13 C, obtenidas del espectro ESR del radical D-glucopiranos-1-ilo enriquecido en 13 C 5, muestran que la desviación de la planaridad para este radical es 3.9 o (Figura 2). 6,14 Dado que un radical σ sp 3-hibridado tendría una desviación 19.5 o, se considera que el radical D‑ glucopiranos-1‑ilo 5 es de tipo π. 6 Los radicales centrados en C-2 (6), C-3 (7) y C-4 (8) en anillos piranoides también tienen configuraciones de tipo π. 15


Dado que los radicales orgánicos sin sustituyentes electronegativos unidos al centro radical tienen configuraciones de tipo π, no es sorprendente encontrar que los radicales 6 - 8 tienen este tipo de configuración. Debido a que los centros radicales con átomos electronegativos unidos se vuelven más piramidales, es sorprendente descubrir que el radical 5, que tiene un átomo de oxígeno unido al centro radical, también tiene una configuración de tipo π. Para entender por qué se adopta esta configuración, es útil analizar la estabilidad de 5 determinada por las interacciones frontera-orbital.
C. Explicación teórica de las configuraciones observadas
1. Interacciones Fronteria-Orbital
Las interacciones frontera-orbital se basan en un método aproximado cuántico-mecánico que asume que todas las interacciones entre orbitales ocupados en una reacción bimolecular pueden descuidarse y que las únicas interacciones que deben considerarse son entre el orbital molecular más alto ocupado (HOMO) de un reactivo y el orbital molecular desocupado más bajo (LUMO) del otro. Una pequeña diferencia de energía entre el HOMO y el LUMO (los orbitales fronterizos) se traduce en una gran interacción estabilizadora. En reacciones radicales, el orbital molecular solo ocupado (SOMO) puede ser un HOMO o un LUMO. 16 Aunque las interacciones frontera-orbital están destinadas a ser aplicadas a reacciones bimoleculares, pueden ser utilizadas para entender la estructura radical. Al hacer tal aplicación, el radical se divide formalmente en dos fragmentos y la recombinación de fragmentos se trata como una reacción bimolecular. 16 Este enfoque, que ha gozado de amplia aplicación y éxito en la explicación de la estructura radical, 17 se utilizará para racionalizar la configuración tipo π en C-1 adoptada por el radical D-glucopiranos-1-ilo 5 (Figura 2).
2. p c/p o Interacción orbital
Estudios experimentales y teóricos muestran que los dos pares de electrones no compartidos en un átomo de oxígeno en un anillo piranoide, no tienen la misma energía. 18,19 El par de energía superior existe en un orbital de tipo p ‑mientras que el par de menor energía se encuentra en un orbital híbrido que tiene un carácter considerable s. Como se muestra en la Figura 3, la estabilización debe ser el resultado de la interacción de los electrones en un orbital de tipo p en un átomo de oxígeno anular (p o) con el electrón en el orbital de tipo p ocupado por separado en un átomo de carbono adyacente (p c). El aumento de la energía del electrón en el orbital molecular solo ocupado (SOMO) está más que compensado por la disminución combinada de energía de los dos electrones en el orbital doblemente ocupado. Debido a que existiría una alineación no paralela de orbitales en un radical piranos-1-ilo con una configuración de tipo σ‑type, la interacción orbital estabilizadora para tal radical sería menor que la de un radical con una configuración de tipo π, por lo tanto, hay una ganancia en la estabilización radical que se debe tener al tener un p tipo orbital en C-1 a pesar de que este átomo tiene un átomo de oxígeno electronegativo unido.


