I. Introducción
- Page ID
- 79569
A. La relación Evans-Polanyi
Para muchas reacciones radicales existe una relación simple entre la energía de activación para la reacción y su entalpía. Esta relación, a la que se hace referencia por varios nombres similares 1 —3 (siendo Evans-Polanyi una común), se da en la eq 1. La Ecuación 1 expresa de manera cuantitativa la noción de que en un grupo de reacciones estrechamente relacionadas la entalpía de una reacción particular debe estar relacionada con su energía de activación; específicamente, las energías de activación deben disminuir de manera lineal a medida que las reacciones se vuelven más exotérmicas.
.png)
Una vez que se han determinado las dos constantes en eq 1, es posible predecir la energía de activación para reacción de cualquier miembro del grupo a partir del conocimiento de la entalpía de reacción. El valor numérico de la constante α representa la fracción del cambio de entalpía global que existe en el estado de transición. El valor de α se puede ver como una medida de hasta qué punto ha avanzado una reacción a lo largo de la coordenada de reacción cuando se alcanza el estado de transición. Cuanto más tarde se produzca un estado de transición en una reacción, más cerca estará α de la unidad.
B. Radicales Nucleofílicos y Electrófilos
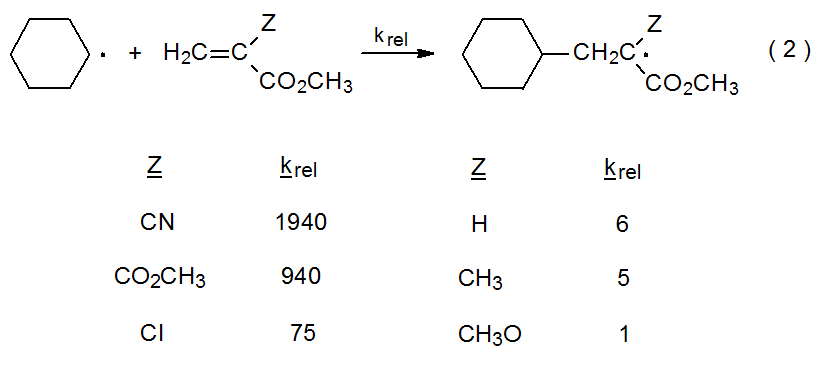
Aunque los radicales son especies neutras, a menudo presentan un comportamiento característico de intermedios nucleofílicos o electrófilos. 4,5 Este comportamiento facilita ciertos tipos de reacción; por ejemplo, en las reacciones de adición mostradas en la ecuación 2, el radical ciclohexilo centrado en carbono se comporta como nucleófilo al agregar más rápidamente a compuestos con más dobles enlaces deficientes en electrones que a aquellos en los que se encuentran los dobles enlaces menos deficientes en electrones. 6 En contraste, el radical malonilo 1 puede ser visto como electrófilo porque se suma a dobles enlaces ricos en electrones como el del D-glucal 2 (eq 3). 7 Un buen punto de partida para discutir la filicidad radical es examinar algunas reacciones de abstracción de hidrógeno.
.png)
.png)

