3.4C: Uso de la Cantidad Mínima de Solvente Caliente
- Page ID
- 73963
La cantidad de disolvente utilizada en la cristalización generalmente se mantiene al mínimo, para apoyar el objetivo de recuperar la cantidad máxima de cristales.
Cada sólido tiene solubilidad parcial en los solventes utilizados, incluso a temperaturas frías. En la Figura 3.19 el disolvente frío que rodea a un sólido amarillo se tiñe de amarillo a medida que se disuelve algún compuesto. Los sólidos que parecen insolubles en un disolvente tienen de hecho una porción (normalmente pequeña) de material que se disuelve. Esto es análogo a cómo los compuestos iónicos “insolubles en agua” (tales como\(\ce{AgCl}\) tienen una constante de producto de solubilidad distinta de cero\(\left( K_\text{sp} \right)\).

La cristalización es más común con sólidos que tienen solubilidad moderada a bajas temperaturas, por lo que el calor puede “volcarlos sobre el borde” para disolverse completamente. Esto significa que en la práctica habrá una cantidad de compuesto que se disuelva en las aguas madres a bajas temperaturas, lo que puede ser significativo dependiendo del perfil de solubilidad del compuesto. El uso de la cantidad mínima de disolvente caliente disminuye la cantidad de compuesto que se pierde en las aguas madres.
Para demostrar la importancia de usar la cantidad mínima de disolvente caliente durante una cristalización, imagina que vas a cristalizar ácido\(5.0 \: \text{g}\) 2-furoico usando agua caliente. \(^8\)Los cálculos de este ejemplo se describen a continuación, y se resumen en la Figura 3.21.
El ácido 2-furoico tiene una mayor solubilidad en agua hirviendo en comparación con agua fría, como lo muestran los datos de solubilidad en la Figura 3.20. La cantidad de disolvente caliente necesario para disolver esta muestra se puede calcular utilizando la solubilidad del compuesto en agua caliente, como se muestra a continuación. Esto representa la “cantidad mínima de disolvente caliente” necesaria para la cristalización.
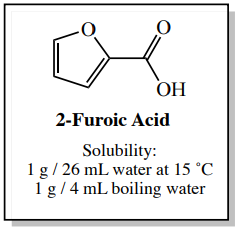
\[5.0 \: \text{g 2-furoic acid (FA)} \times \frac{4 \: \text{mL hot water}}{1 \: \text{g FA}} = \textbf{20. mL hot water}\]
Cuando el ácido 2-furoico se disuelve en\(20 \: \text{mL}\) agua caliente y se deja enfriar, el compuesto cristalizará ya que tiene una menor solubilidad en el disolvente frío. Idealmente la solución se colocaría en un baño de hielo\(\left( 0^\text{o} \text{C} \right)\), pero como no se proporcionan los datos de\(0^\text{o} \text{C}\) solubilidad, imaginemos que la solución se enfría a\(15^\text{o} \text{C}\). La solubilidad del ácido 2-furoico en esta agua fría es la siguiente.
\[20. \: \text{mL cold water} \times \frac{1 \: \text{g FA}}{26 \: \text{mL cold water}} = \textbf{0.77 g FA} \: \text{dissolves in } 15^\text{o} \text{C} \: \text{water}\]
Este cálculo muestra que una porción del ácido 2-furoico permanecerá disuelta en las aguas madres incluso cuando se coloque en el baño frío. Cualquier compuesto presente que supere esta cantidad cristalizará, en este caso\(4.2 \: \text{g}\) de ácido 2-furoico\(\left( 5.0 \: \text{g} - 0.77 \: \text{g} \right)\). Obsérvese que por la pérdida de material a las aguas madres, la recuperación teórica máxima de este proceso es sólo \(84\%\)\(\left( 100 \times 4.2 \: \text{g}/5.0 \: \text{g} \right)\).
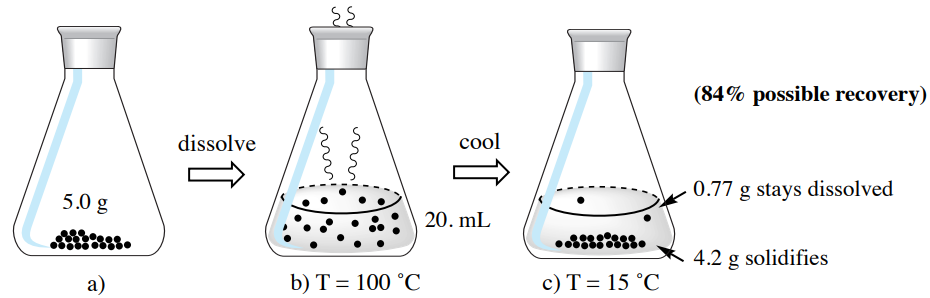
A continuación, imagina que en lugar de usar la cantidad mínima de disolvente caliente, usamos el doble del volumen de disolvente caliente (\(40 \: \text{mL}\)en este ejemplo). Los cálculos de este ejemplo se describen a continuación, y se resumen en la Figura 3.22.
Cuando se duplica el volumen de disolvente, la cantidad de material disuelto en las aguas madres también se duplica, como se muestra en el cálculo a continuación.
\[40. \: \text{mL cold water} \times \frac{1 \: \text{g FA}}{26 \: \text{mL cold water}} = \textbf{1.5 g FA} \: \text{dissolves in } 15^\text{o} \text{C} \: \text{water}\]
Si en su lugar se disolviera una\(5.0 \: \text{g}\) muestra de ácido 2-furoico\(40 \: \text{mL}\) (el doble de la cantidad mínima de disolvente caliente necesaria), solo\(3.5 \: \text{g}\) cristalizaría\(\left( 5.0 \: \text{g} - 1.5 \: \text{g} \right)\). La máxima recuperación teórica para este proceso es sólo \(70\%\).
Observe cuando se usa disolvente adicional que el mínimo, más compuesto es soluble en el disolvente y se pierde a las aguas madres, lo que lleva a una menor recuperación teórica.
Como se podría imaginar, también hay una cantidad de disolvente en la que se disuelve toda la\(5.0 \: \text{g}\) muestra de ácido 2-furoico (en este caso\(130 \: \text{mL}\), ver cálculo a continuación). Si\(130 \: \text{mL}\) se usaran para la cristalización en lugar de la cantidad mínima de disolvente caliente, no se formarían cristales cuando se enfriaran a\(15^\text{o} \text{C}\) (\(0\%\)recuperación). Por lo tanto, la cantidad de disolvente utilizada en la cristalización debe ser monitoreada y restringida cuando sea posible.
\[5.0 \: \text{g FA (2-furoic acid)} \times \frac{26 \: \text{mL cold water}}{1 \: \text{g FA}} = \textbf{130 mL} \: \text{of } 15^\text{o} \text{C} \: \text{water dissolves the whole sample}\]
Para demostrar la importancia de usar la cantidad mínima de disolvente caliente, se cristalizaron dos muestras de benzilo (cada una aproximadamente\(1.8 \: \text{g}\)) a partir de etanol caliente (Figura 3.23). El primero se disolvió en la cantidad mínima de disolvente caliente (aproximadamente\(8 \: \text{mL}\)), y resultó en una \(92\%\)recuperación después de la cristalización. El segundo se disolvió en aproximadamente el doble de la cantidad de disolvente caliente (aproximadamente\(15 \: \text{mL}\)) y resultó en una \(87\%\)recuperación. El perfil de solubilidad del benzilo condujo a una excelente recuperación en ambos ensayos, pero la recuperación se vio algo comprometida cuando se utilizó un exceso de disolvente.

\(^8\)Como se recomienda en D.D. Perrin, W.L.F. Armarego, Purificación de Químicos Orgánicos, Pergamon Press, 3\(^\text{rd}\) edición, 1988.


