6.1C: Teoría del punto de fusión
- Page ID
- 74182
Diagramas de Punto de
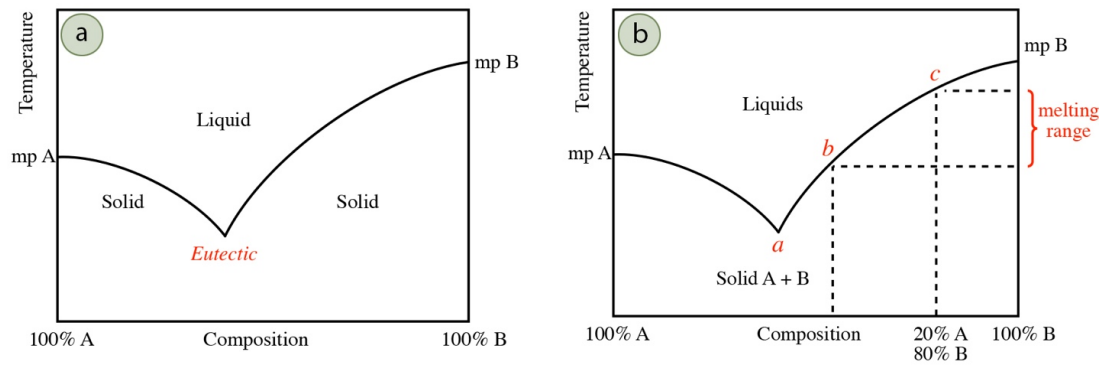
El comportamiento típico de un sólido impuro que contiene dos componentes se resume mediante el diagrama general de fases en la Figura 6.7a. El lado izquierdo más alejado de la gráfica representa una muestra que es el compuesto puro “A”, mientras que el lado derecho más alejado de la gráfica representa una muestra del compuesto puro “B”. Las líneas marcan la temperatura de transición sólido-líquido (puntos de fusión). El punto de fusión disminuye cuanto más lejos está la composición de la pureza, hacia la mitad de la gráfica. En muchas mezclas, la temperatura mínima de fusión para una mezcla ocurre en una determinada composición de componentes, y se denomina punto eutéctico (Figura 6.7a). Algunos sistemas no tienen ningún punto eutéctico y algunos tienen múltiples puntos eutécticos.
Un sólido impuro es típicamente heterogéneo a nivel microscópico, con regiones puras de cada componente distribuidas a través del sólido a granel como el granito. Cuando se calienta un sólido impuro, la fusión microscópica ocurre primero en una región pura por el componente con el punto de fusión más bajo (compuesto A en la Figura 6.7a). Esta fusión microscópica no es visible para el ojo.
La fusión preliminar del compuesto A en la Figura 6.7a forma pequeños depósitos de líquido que comienzan a disolver el compuesto B del sólido a granel. A medida que el compuesto B se disuelve en la masa fundida (haciendo que se vuelva más impuro), se deprime el punto de congelación de esta mezcla. El Compuesto B continuará disolviéndose en la masa fundida, hasta que alcance la composición eutéctica (punto a en la Figura 6.7b), y el sistema continuará fundiéndose en esta composición hasta que se disuelva la totalidad del componente menor (la impureza). Una vez que el componente menor está completamente disuelto, continúa la fusión adicional del componente a granel. Esto aumenta la pureza de la masa fundida, por lo que la temperatura de fusión aumenta algo. El sistema sigue la línea de fusión de la Figura 6.7b ya sea a la izquierda o derecha de la temperatura eutéctica (dependiendo de qué lado del punto eutéctico se inicia), ajustando su temperatura de fusión a medida que el componente a granel aumenta su concentración en la masa fundida. Esto continúa hasta que se funde toda la muestra.
Aunque la fusión microscópica comienza a la temperatura eutéctica, el primer valor del rango de fusión (cuando se ve una gotita de líquido con el ojo) no se registra necesariamente a esta temperatura. No se ve una gotita de líquido hasta que aproximadamente\(10\) -\(20\%\) de la muestra se haya derretido. Dependiendo de la cantidad de impurezas, el sistema puede haber progresado lejos de la temperatura eutéctica (quizás hasta el punto b en la Figura 6.7b) antes de que el líquido se haga visible para el ojo. El valor final del rango de fusión está en el punto de fusión más alto del sólido puro, pero a menudo es menor, reflejando el punto de fusión deprimido del sólido a granel. Por ejemplo, un sólido que sea el\(20\%\) compuesto A y el\(80\%\) compuesto B tendría una temperatura de fusión final del punto c en la Figura 6.7b. El rango de fusión registrado para este sistema estaría en el máximo entre las temperaturas a y c, pero si la primera gotita se ve en el punto b, el rango de fusión registrado estaría entre las temperaturas b y c.
Efecto de impurezas en el punto de fusión
Un punto de fusión es un indicador útil de pureza ya que hay una disminución general y una ampliación del rango de fusión a medida que aumentan las impurezas. En esta sección se describe la teoría detrás del fenómeno de la depresión del punto de fusión (que es idéntica a la depresión del punto de congelación ya que la congelación y fusión son los mismos procesos a la inversa) y por qué una muestra impura tiene un amplio rango de fusión.
Depresión del Punto de Fusión (Bajando el M. P.)
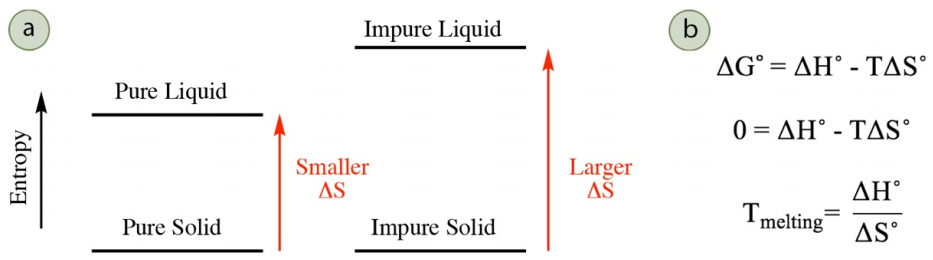
La fusión de un sólido puro ocurre a una temperatura más alta que la fusión de un sólido impuro, un concepto llamado depresión del punto de fusión (o depresión del punto de congelación). El punto de fusión es la temperatura donde las fases sólida y líquida están en equilibrio entre sí, y el cambio en la energía libre\(\left( \Delta G^\text{o} \right)\) para el proceso (\(\rightleftharpoons\)sólido-líquido) es cero. \(\Delta G^\text{o}\)depende tanto de los cambios en la entalpía\(\left( \Delta H^\text{o} \right)\) como en la entropía\(\left( \Delta S^\text{o} \right)\) durante el proceso (ver versiones de la ecuación de energía libre de Gibbs en la Figura 6.8b), pero los cambios en la entalpía son similares al fundir un sólido puro e impuro ya que se rompen fuerzas intermoleculares similares. La depresión del punto de fusión es el resultado de diferentes cambios en la entropía al fundir un sólido puro e impuro.
Como los sólidos están restringidos en el movimiento atómico, hay poca diferencia en la entropía entre un sólido puro e impuro. Sin embargo, hay una diferencia más significativa en la entropía entre un líquido puro e impuro, y un líquido impuro tiene mayor desorden y mayor entropía. Por lo tanto, la fusión de un sólido impuro en un líquido impuro tiene un cambio mayor en la entropía que fundir un sólido puro en un líquido puro (Figura 6.8a). Un mayor cambio en la entropía corresponde a una temperatura de fusión más baja. Esto puede ser racionalizado ya sea matemática o conceptualmente. Una descripción matemática se encuentra en la Figura 6.8b: como\(\Delta S^\text{o}\) es el denominador en la ecuación final, una mayor\(\Delta S^\text{o}\) corresponde a una menor\(T_\text{melting}\). Un enfoque conceptual es considerar que la fusión ocurre cuando los componentes de entalpía\(\left( \Delta H^\text{o} \right)\) y entropía\(\left( T \Delta S^\text{o} \right)\) son iguales en magnitud (cuando\(\Delta G^\text{o} = 0\)). Un mayor\(\Delta S^\text{o}\) significa que se requerirá una temperatura más pequeña para “igualar” el componente de entalpía.
Ampliación del punto de fusión
La amplitud de un punto de fusión determinado experimentalmente a menudo puede correlacionarse con la pureza del sólido. Aunque todas las muestras comienzan a fundirse a la temperatura eutéctica, la primera gotita de líquido no se ve hasta que aproximadamente\(10\) -\(20\%\) de la muestra se haya fundido microscópicamente. Como la temperatura de fusión no sube por encima de la temperatura eutéctica hasta que se haya fundido la totalidad de la impureza, la cantidad de impurezas determinará hasta qué punto habrá progresado el sistema a lo largo de la línea de punto de fusión en el diagrama de fases antes de alcanzar el mínimo visible de\(10\) -\(20\%\) de sólido.
Por ejemplo, si un sólido tiene una cantidad menor de impureza, la impureza se fundirá rápidamente a la temperatura eutéctica (punto a en la Figura 6.9a), y la temperatura de fusión aumentará, siguiendo la línea del punto de fusión en el diagrama de fases. Cuando\(10\) -\(20\%\) de sólido se ha fundido y una gotita es visible, el sistema puede haber progresado lejos de la composición eutéctica (quizás para comenzar visiblemente a fundirse en el punto b de la Figura 6.9a). El sólido continuará fundiéndose hasta quizás el punto c de la Figura 6.9a, para dar un rango de fusión relativamente estrecho (entre los puntos b y c). Si en cambio el sólido tiene una cantidad significativa de impurezas, puede tomar fusión\(10\%\) de casi el sólido para disolver completamente la impureza, lo que significa que la temperatura de fusión puede no haber progresado lejos de la temperatura eutéctica cuando una gotita se vuelve visible. Un sólido más impuro puede fundirse primero visiblemente en quizás el punto d de la Figura 6.9b, para dar un rango de fusión más amplio (entre los puntos d y e).
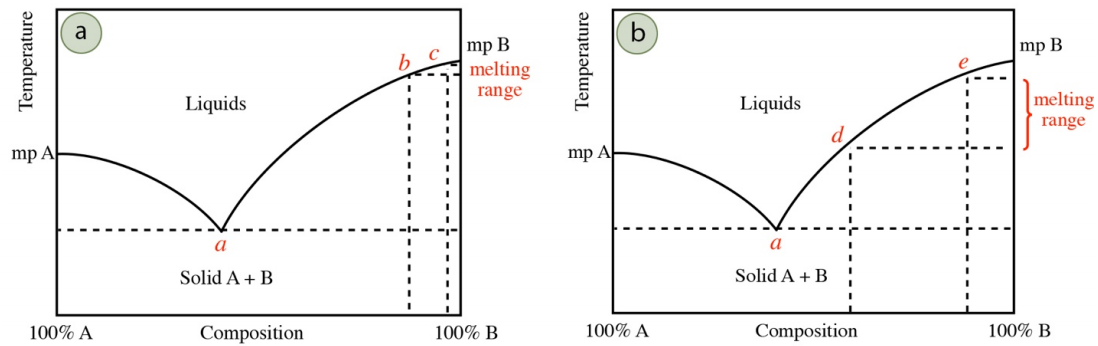
Es por estas razones que un bajo rango de fusión\(\left( < 2^\text{o} \text{C} \right)\) se asocia con la pureza, aunque también es posible que la composición del sólido pueda estar coincidentemente cerca de un punto eutéctico. Si la composición eutéctica es, por ejemplo,\(40\%\) A/\(60\%\) B, y la composición del sólido es\(45\%\) A/\(55\%\) B, casi todo el sólido impuro se fundirá antes de que la temperatura de fusión cambie de la temperatura eutéctica en el diagrama de fases. Por lo tanto, las mezclas con composiciones cercanas a la composición eutéctica también dan un rango de fusión agudo, aunque pueden estar lejos de ser puras.
Si un sistema es de hecho puro, o que se funde bruscamente porque está en la composición eutéctica, se puede probar realizando un punto de fusión mixto.


