6.1B: Usos de los puntos de fusión
- Page ID
- 74183
Existen varias razones para determinar el punto de fusión de un compuesto: es útil para apoyar la identificación de un compuesto, además de servir como una guía aproximada de la pureza relativa de la muestra.
Identificación
Como el punto de fusión de un compuesto es una constante física, se puede utilizar para apoyar la identidad de un sólido desconocido. El punto de fusión se puede buscar en un libro de referencia (este valor se llamaría entonces el "punto de fusión de la literatura “), y compararlo con el punto de fusión experimental. Por ejemplo, el punto de fusión de la literatura del ferroceno, es\(172\) -\(174^\text{o} \text{C}\). \(^1\)El autor encontró que el punto de fusión de una muestra de ferroceno (Figura 6.3) era\(176\) -\(178^\text{o} \text{C}\),\(^2\) y existe una buena concordancia entre estos dos valores.

Se debe tener cuidado en abstenerse de sacar conclusiones sobre la identidad de un compuesto basado únicamente en un punto de fusión. Existen millones de compuestos orgánicos sólidos, y la mayoría tienen puntos de fusión por debajo\(250^\text{o} \text{C}\). No es raro que dos compuestos diferentes tengan puntos de fusión coincidentemente similares o idénticos. Por lo tanto, un punto de fusión debe ser utilizado como simplemente una pieza de datos para apoyar la identificación de un desconocido.
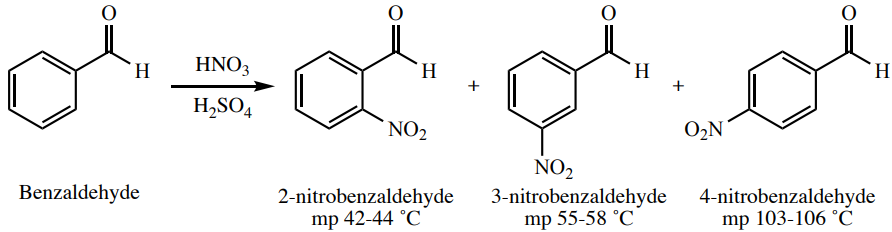
Aunque los puntos de fusión coincidentemente similares no son inauditos, cuando se utilizan en el contexto de la evaluación del producto de una reacción química, los puntos de fusión pueden ser una poderosa herramienta de identificación. Por ejemplo, tres posibles productos de la nitración del benzaldehído son 2, 3 o 4-nitrobenzaldehído (Figura 6.4). Dado que estos productos tienen puntos de fusión muy diferentes, el punto de fusión del sólido resultante (si es puro) podría usarse para sugerir fuertemente qué producto se formó.
Evaluación de la Pureza
Una segunda razón para determinar el punto de fusión de un compuesto es por una medida aproximada de la pureza. En general, las impurezas disminuyen y amplían el rango de fusión.
Por ejemplo, los puntos de fusión de muestras de ácido benzoico contaminadas con cantidades conocidas de acetanilida se resumen en el Cuadro 6.1. A medida que aumentaba la cantidad de impurezas, la fusión comenzó a una temperatura más baja, y la amplitud del rango de fusión aumentó.
| Mol% de ácido benzoico | Mol% Acetanilida | Punto de fusión (ºC) |
|---|---|---|
| 100% | 0% | 120 - 122 |
| 95% | 5% | 114 - 121 |
| 90% | 10% | 109 - 120 |
| 85% | 15% | 105 - 117 |
| 80% | 20% | 94 - 116 |
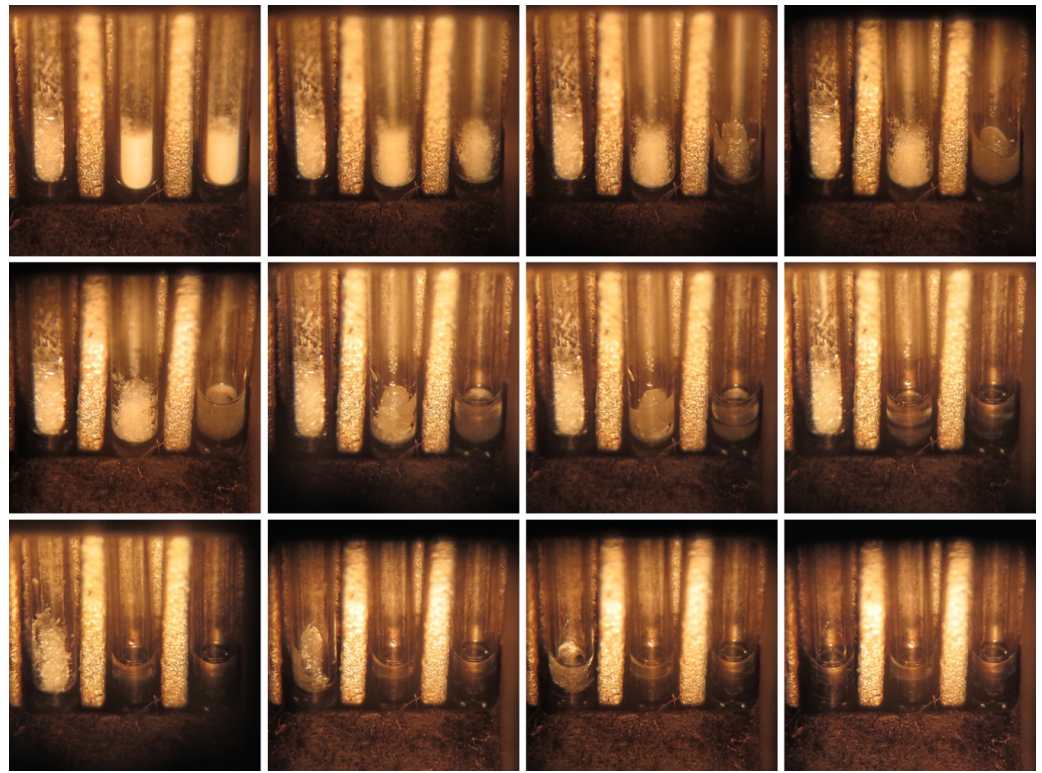
La Figura 6.5 muestra la fusión por lapso de tiempo de tres muestras una al lado de la otra en un aparato de punto de fusión: ácido benzoico puro (izquierda), ácido benzoico con impureza de\(10 \: \text{mol} \%\) acetanilida (centro) y ácido benzoico con impureza de\(20 \: \text{mol} \%\) acetanilida (derecha). A medida que se calientan las muestras, la muestra con mayor impureza (a la derecha) se funde primero. Curiosamente, ambas muestras impuras completan la fusión antes de que la muestra pura (a la izquierda) comience a fundirse.
El punto de fusión de un sólido puede ser tan reducido por la impureza que se convierte en líquido a temperatura ambiente. Por ejemplo, cuando se mezcla piperonal (punto de fusión de\(35\) -\(39^\text{o} \text{C}\)) con resorcinol (punto de fusión de\(109\) -\(112^\text{o} \text{C}\)) en una relación 4:1 en masa,\(^3\) la mezcla se vuelve fangosa y finalmente se funde a temperatura ambiente (Figura 6.6). Este tipo de comportamiento no es infrecuente para sólidos cuyos puntos de fusión son solo marginalmente más altos que la temperatura ambiente.

\(^1\)Los puntos de fusión son del Catálogo Químico de Aldrich.
\(^2\)Como se determinó usando un aparato de punto de fusión MelTemp. Los valores de temperatura no están corregidos.
\(^3\)Según lo publicado en Di Pippo, A. G., J. Chem. Ed, 1965, 42 (5), p. A413.


