6.4D: Pruebas Individuales
- Page ID
- 74157
Prueba de Beilstein
La prueba de Beilstein confirma la presencia de un halógeno en solución, aunque no distingue entre cloro, bromo o yodo. Un alambre de cobre se sumerge en la solución que contiene halógeno y se introduce en una llama. El óxido de cobre en el alambre reacciona con el haluro orgánico para producir un compuesto de haluro de cobre que le da un color azul-verde a la llama.
Procedimiento: En la campana extractora, limpie un alambre de cobre en bucle al meterlo en la punta del cono azul de una llama de quemador Bunsen hasta que brille (Figura 6.46a). Asegúrese de “quemar” cualquier líquido residual en el cable (asegúrese de que las llamas verdes de las pruebas anteriores hayan desaparecido antes de comenzar).
Deje que el cobre se enfríe a temperatura ambiente, luego sumerja en un tubo de ensayo que contenga 5-10 gotas de su muestra, recubriéndola tanto como sea posible (Figura 6.46b). Si la muestra es un sólido, adhiera parte del sólido al alambre de cobre humedeciendo primero el alambre con agua destilada y luego tocándolo con el sólido.
Inmediatamente sumerja el alambre con la muestra en el cono azul de la llama. Un resultado positivo es una llama verde, aunque podría ser efímera y débil (puede ser más fácil ver si la luz de la campana extractora está apagada). Un resultado negativo es la ausencia de este color verde (Figura 6.46c+d).

Prueba de Benedict
La prueba de Benedict puede verificar la presencia de carbohidratos reductores: compuestos que tienen hemiacetales en sus estructuras y por lo tanto están en equilibrio con la forma carbonilo libre (aldehído o\(\alpha\) -hidroxicetona). Las formas de carbonilo son oxidadas por\(\ce{Cu^{2+}}\) el reactivo de Benedict (que se compleja con iones citrato para evitar la precipitación de\(\ce{Cu(OH)_2}\) y\(\ce{CuCO_3}\)). Un insoluble\(\ce{Cu_2O}\) es el producto inorgánico de esta reacción, que suele tener un color rojo-marrón (Figura 6.47). Los carbohidratos con solo enlaces acetales son azúcares no reductores y dan un resultado negativo con esta prueba.
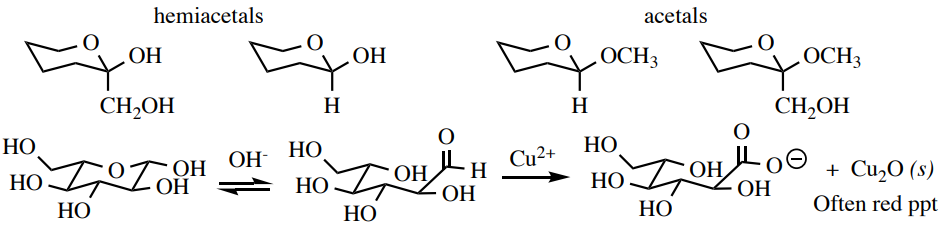
Procedimiento: Disolver\(10\) -\(30 \: \text{mg}\) de muestra sólida o líquida de 3 gotas en una cantidad mínima de agua\(\left( 0.5 \: \text{mL} \right)\) en un pequeño tubo de ensayo (\(13\)x\(100 \: \text{mm}\)). Añadir\(2 \: \text{mL}\) de reactivo de Benedict. \(^9\)Calentar la solución azul en un baño de agua hirviendo durante 2 minutos (Figura 6.48a). Un resultado positivo es la formación de una solución o precipitado marrón rojizo después de algún tiempo, mientras que un resultado negativo es la retención del color azul (Figura 6.48c+d).

Los aldehídos conjugados no son reactivos en la prueba de Benedict, y el autor encontró que muchos aldehídos no conjugados también son no reactivos. La formación de coloides parece impedir la formación del precipitado rojo (La Figura 6.49 muestra la aparición de propionaldehído en el baño de agua caliente, formando un coloide turbio).

La reacción solo puede funcionar para compuestos que son solubles en agua (como los carbohidratos), ya que la reacción parece iniciar en la superficie (Figura 6.50), y el autor encontró que los aldehídos que formaron una capa insoluble en la superficie no son reactivos.

La prueba de Benedict está relacionada con la prueba de Fehling, que utiliza diferentes ligandos en las especies oxidantes de cobre. El reactivo de Fehling utiliza un\(\ce{Cu^{2+}}\) ion complejado con dos iones tartrato.
Prueba de Bicarbonato
Los ácidos carboxílicos y sulfónicos pueden reaccionar con bicarbonato de sodio\(\left( \ce{NaHCO_3} \right)\) para producir dióxido de carbono y agua (Figura 6.51). Otros grupos funcionales principales (la mayoría de los fenoles y alcoholes) no son lo suficientemente ácidos como para producir un gas con bicarbonato.
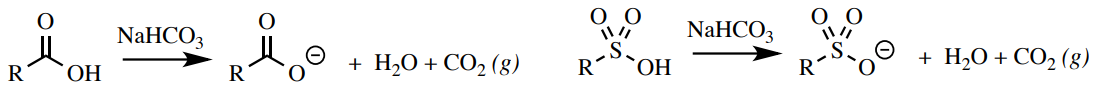
Procedimiento: Agrega\(5\% \: \ce{NaHCO_3} \left( aq \right)\) a un tubo\(2 \: \text{mL}\) de ensayo y agrega 5 gotas o\(50 \: \text{mg}\) de tu muestra. Mezclar la solución agitando el tubo de ensayo. Una prueba positiva para ácidos carboxílicos es la formación de burbujas o espumación (Figura 6.52).

Prueba de bromo
Una solución de bromo en\(\ce{CH_2Cl_2}\) es una prueba de insaturación (alquenos y alquinos) y en algunos casos la capacidad de oxidarse (aldehídos). La solución de bromo es naranja y al reaccionar la solución se vuelve incolora debido al consumo de bromo. El bromo reacciona con alquenos y alquinos mediante reacciones de adición y con aldehídos a través de la oxidación (Figura 6.53). No da reacción con los aromáticos, haciendo de esta una buena prueba para distinguir alquenos de aromáticos.
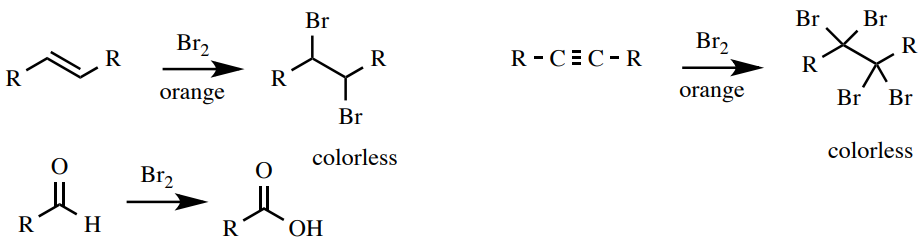
Procedimiento: Disolver 4 gotas o\(50 \: \text{mg}\)\(1 \: \text{mL}\) de muestra en diclorometano\(\left( \ce{CH_2Cl_2} \right)\) o 1,2-dimetoxietano. Agrega 2 gotas de la naranja\(5\% \: \ce{Br_2}\) en\(\ce{CH_2Cl_2}\) solución al tubo de ensayo y observa. Un resultado positivo es la desaparición inmediata del color naranja para producir una solución transparente o ligeramente amarilla (Figura 6.54). Un resultado negativo es la retención del color naranja. Un aldehído puede requerir una pequeña cantidad de tiempo para decolorar la solución y producir un resultado positivo (aproximadamente 1 min, Figura 6.55) y los aldehídos conjugados no son reactivos (Figura 6.55).


Prueba de ácido crómico (Jones)
Una solución de\(\ce{CrO_3}\) in\(\ce{H_2SO_4}\) es una prueba para grupos funcionales polares que pueden oxidarse, que incluye aldehídos, alcoholes primarios y alcoholes secundarios (Figura 6.57). Los alcoholes terciarios dan un resultado negativo con esta prueba (Figura 6.56). El\(\ce{Cr^{6+}}\) reactivo naranja se convierte en una\(\ce{Cr^{3+}}\) especie azul-verde, que a menudo precipita en acetona.

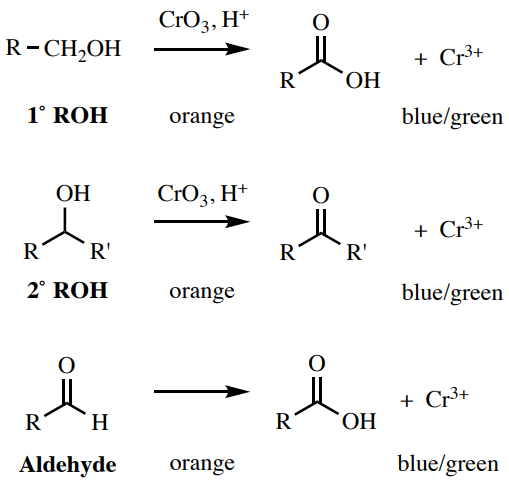
Procedimiento: Coloca\(1 \: \text{mL}\) la acetona en un tubo de ensayo pequeño (\(13\)x\(100 \: \text{mm}\)) y agrega 2 gotas o\(20 \: \text{mg}\) de tu muestra. Mientras usa guantes, agregue 2 gotas del reactivo de ácido crómico naranja\(^{10}\) (nota de seguridad: ¡el reactivo es altamente tóxico!) y mezclar agitando. Un resultado positivo es un precipitado de color azul-verde o oscuro, mientras que un resultado negativo es una solución o precipitado amarillo-naranja sin precipitado de color oscuro (Figura 6.58).
El agua funciona mejor que la acetona para enjuagar los reactivos de cromo en el vaso de desechos, aunque se necesita tiempo para la disolución de la\(\ce{Cr^{3+}}\) especie.

Prueba de 2,4-DNPH (Brady)
Una solución de 2,4-dinitrofenilhidrazina (2,4-DNPH) en etanol es una prueba para aldehídos o cetonas (Figura 6.59). La mayoría de los aldehídos o cetonas reaccionarán con el reactivo naranja para dar un precipitado rojo, naranja o amarillo. Los ésteres y otros compuestos carbonílicos generalmente no son lo suficientemente reactivos como para dar un resultado positivo para esta prueba.
El color del precipitado puede dar evidencia de la cantidad de conjugación presente en el carbonilo original: se forma un precipitado naranja para los carbonilos no conjugados (la Figura 6.60c muestra el resultado para 2-butanona), y se forma un precipitado rojo para los carbonilos conjugados (La Figura 6.60d muestra el resultado para cinamaldehído).
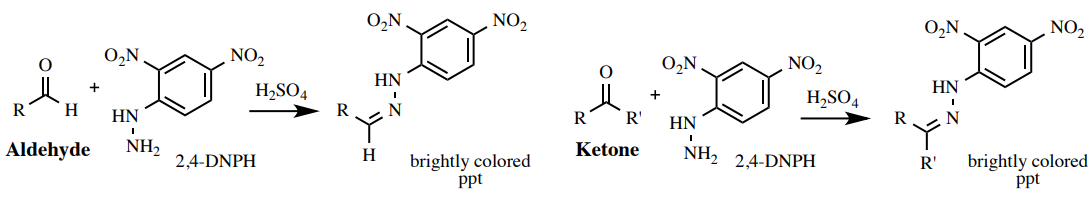
Procedimiento: Agregar 3 gotas de muestra a un pequeño tubo de ensayo (\(13\)x\(100 \: \text{mm}\)), o disolver\(10 \: \text{mg}\) la muestra sólida en una cantidad mínima de etanol en el tubo de ensayo. Mientras usa guantes, agregue aproximadamente\(1 \: \text{mL}\) del reactivo 2,4-DNPH naranja\(^{11}\) (nota de seguridad: ¡el reactivo es altamente tóxico!) y mezclar el tubo de ensayo agitando.
Un resultado positivo es la formación inmediata de una gran cantidad de precipitado de colores brillantes (rojo, naranja o amarillo). Un resultado negativo es la ausencia de este precipitado y una solución transparente de color amarillo-naranja (Figura 6.60).

Prueba de hidroxamato férrico
El procedimiento de hidroxamato férrico es una sonda para el grupo funcional éster. Los ésteres calentados con hidroxilamina producen ácidos hidroxámicos, que forman complejos intensos y coloreados (a menudo marrón oscuro) con\(\ce{Fe^{3+}}\). Una posible estructura de estos complejos se muestra en la Figura 6.61. Esta prueba está relacionada con la prueba de fenol, y como en esa prueba, los compuestos con alto carácter enólico pueden dar un complejo coloreado con\(\ce{Fe^{3+}}\). Por lo tanto, se realiza una prueba preliminar para ver si el compuesto carbonilo que se está probando produce suficiente enol para formar un complejo coloreado con\(\ce{Fe^{3+}}\), lo que conduciría a un resultado falso positivo.
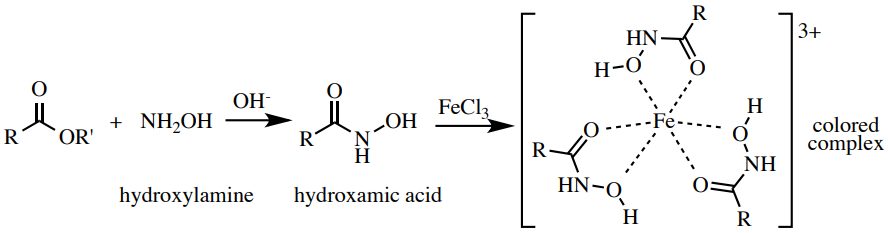
Procedimiento: Realizar una prueba preliminar para asegurarse de que esta prueba no dará un falso positivo. Agregue lo siguiente a un tubo de ensayo pequeño (\(13\)x\(100 \: \text{mm}\)):\(1 \: \text{mL}\) etanol, 2 gotas o\(20 \: \text{mg}\) de su muestra,\(1 \: \text{mL}\) de\(1 \: \text{M} \: \ce{HCl} \left( aq \right)\), y 2 gotas de\(5\% \: \ce{FeCl_3} \left( aq \right)\) solución. Si la solución es transparente o amarilla (el color de la\(\ce{FeCl_3}\), Figura 6.62a), esta prueba funcionará y no producirá un falso positivo (continuar). Si aparece un color definido distinto al amarillo, esta prueba no funcionará para tu muestra, ya que forma un complejo coloreado con\(\ce{Fe^{3+}}\) incluso sin hidroxilamina.
En un tubo de ensayo limpio de tamaño mediano (\(18\)x\(150 \: \text{mm}\)), agregue hidrocloruro\(1 \: \text{mL}\) de hidroxilamina\(0.5 \: \text{M}\) acuoso\(\left( \ce{NH_2OH} \cdot \ce{HCl} \right)\),\(0.5 \: \text{mL}\) de\(6 \: \text{M} \: \ce{NaOH} \left( aq \right)\), y 5 gotas o\(50 \: \text{mg}\) de muestra. Calentar la mezcla en un baño de agua hirviendo durante aproximadamente 3 minutos (el volumen se reducirá aproximadamente a la mitad, Figura 6.62b).
Enfríe rápidamente la solución sumergiéndola en un baño de agua del grifo, luego agregue\(2 \: \text{mL}\) de\(1 \: \text{M} \: \ce{HCl} \left( aq \right)\). Si la solución se vuelve turbia, agregue suficiente etanol para aclararla. Después agrega 6-10 gotas de una\(5\% \: \ce{FeCl_3} \left( aq \right)\) solución amarilla. Mezclar vigorosamente el tubo.
Un resultado positivo es un color burdeos profundo, umber o magenta (rojo/marrón) mientras que un resultado negativo es cualquier otro color (Figura 6.62c+d). Nota: use agua para enjuagar los tubos de ensayo, y si un resultado rojo no se limpia fácilmente, agregue unas gotas de\(6 \: \text{M} \: \ce{HCl}\).

Prueba yodoforme
Se\(\ce{NaOH}\) puede usar una solución de yodo\(\left( \ce{I_2} \right)\) y yoduro\(\left( \ce{I^-} \right)\) para ensayar cetonas metílicas o alcoholes secundarios adyacentes a un grupo metilo. Esta es una prueba muy específica que dará un resultado positivo (formación de un precipitado amarillo canario) solo para compuestos con la estructura\(\ce{RCH(OH)CH_3}\) o\(\ce{RC=OCH_3}\) (Figura 6.63). No funciona para todos los alcoholes o cetonas, y no funciona bien para compuestos insolubles en agua.
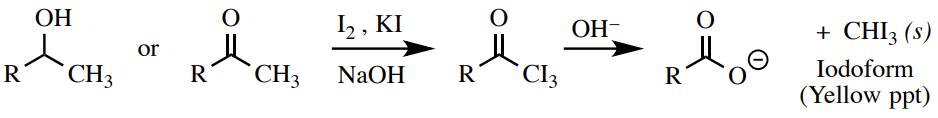
Procedimiento: Agregar 10 gotas de muestra a un pequeño tubo de ensayo (\(13\)x\(100 \: \text{mm}\)) o\(0.10 \: \text{g}\) disueltas en la cantidad mínima de 1,2-dimetoxietano seguido\(1 \: \text{mL}\) de de\(10\% \: \ce{NaOH} \left( aq \right)\). A continuación, agregue 10 gotas del reactivo yodoforme marrón oscuro\(^{12}\) (\(\ce{I_2}/\ce{KI}\)solución) y mezcle vigorosamente el tubo de ensayo agitando.
Un resultado positivo es una solución amarilla turbia, o un precipitado amarillo. Un resultado negativo es una solución transparente, amarilla o naranja sin precipitado (Figura 6.64).
Si la muestra no es soluble en agua, se puede ver una pequeña capa orgánica separada de la solución (probablemente estará en la parte superior). Esta capa puede volverse de color amarillo oscuro o marrón por disolver el yodo. Mezclar vigorosamente el tubo para fomentar una reacción, pero si la capa orgánica oscurecida permanece y no se forma precipitado, este sigue siendo un resultado negativo (Figura 6.64d).
Nota: un resultado falso positivo puede ocurrir si el tubo de ensayo se limpió con acetona antes de su uso, y quedó acetona residual en el tubo.

Prueba Lucas
El reactivo Lucas (concentrado\(\ce{HCl}\) y\(\ce{ZnCl_2}\)) es una prueba para algunos alcoholes. Los alcoholes pueden reaccionar a través de un\(S_\text{N}1\) mecanismo para producir haluros de alquilo que son insolubles en la solución acuosa y aparecen como un precipitado blanco o turbidez. La prueba no puede ser utilizada para alcoholes insolubles en agua (generalmente > 5 átomos de carbono), ya que pueden producir una turbidez o segunda capa independientemente de si alguna reacción ocurrió o no.
\[2^\text{o} \: \text{or} \: 3^\text{o} \: \ce{ROH} + \ce{HCl}/\ce{ZnCl_2} \rightarrow \ce{RCl} \left( s \right)\]
Como el mecanismo es\(S_\text{N}1\), un alcohol terciario debe reaccionar inmediatamente, un alcohol secundario reacciona más lentamente (quizás en 5 minutos si acaso) y los alcoholes primarios a menudo no reaccionan en absoluto. Los alcoholes bencílicos\(\left( \ce{Ph-C-OH} \right)\), los alcoholes alílicos\(\left( \ce{C=C-C-OH} \right)\) y los alcoholes propargílicos\(\left( \ce{C \equiv C-C-OH} \right)\) a menudo dan resultados inmediatos al igual que los alcoholes terciarios.
Procedimiento: Lugar\(2 \: \text{mL}\) del reactivo Lucas\(^{13}\) (nota de seguridad: ¡el reactivo es altamente ácido y corrosivo!) en un tubo de ensayo pequeño (\(13\)x\(100 \: \text{mm}\)). Agrega 10 gotas de muestra y mezcla agitando el tubo de ensayo.
Un resultado positivo es una turbidez blanca en 5 minutos o una nueva\(\left( \ce{RCl} \right)\) formación de capa orgánica en la parte superior. \(^{14}\)Un resultado negativo es la ausencia de cualquier turbidez o solo una capa (Figura 6.65).

Prueba de permanganato (Baeyer)
Una\(\left( \ce{KMnO_4} \right)\) solución de permanganato de potasio es una prueba de insaturación (alquenos y alquinos) o grupos funcionales que pueden oxidarse (aldehídos y algunos alcoholes, Figura 6.66). El ion permanganato\(\left( \ce{MnO_4^-} \right)\) es de color púrpura profundo, y al reducirse se convierte en un precipitado marrón\(\left( \ce{MnO_2} \right)\). El permanganato no puede reaccionar con los aromáticos, por lo que es una buena prueba para discernir entre alquenos y aromáticos. Una reacción positiva con alcoholes no siempre es confiable (se observa un resultado negativo con los alcoholes bencílicos en la Figura 6.67).
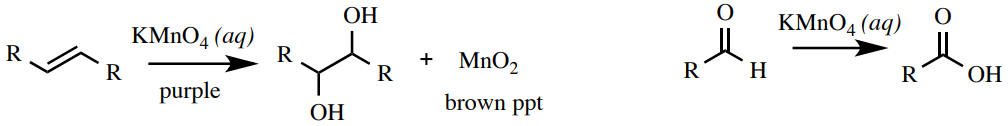
Procedimiento: Disolver 4 gotas o\(40 \: \text{mg}\)\(1 \: \text{mL}\) de muestra en etanol (o 1,2-dimetoxietano) en un pequeño tubo de ensayo (\(13\)x\(100 \: \text{mm}\)). Mientras usa guantes, agregue 3 gotas de la\(1\% \: \ce{KMnO_4} \left( aq \right)\) solución púrpura oscuro al tubo de ensayo (nota de seguridad: ¡el reactivo es corrosivo y manchará la piel de color marrón!). Mezclar el tubo de ensayo con agitación, y dejar que se asiente por 1 minuto. Un resultado positivo es la aparición de un color marrón o precipitado. Un resultado negativo es un púrpura profundo sin precipitado (sin reaccionar\(\ce{KMnO_4}\), Figura 6.67).

Prueba de pH
Los ácidos carboxílicos y sulfónicos producen soluciones acuosas ácidas (Figura 6.68a), lo que puede confirmarse tornando el papel tornasol azul rosado. El papel cambia de color (Figura 6.68c) a medida que las moléculas indicadoras reaccionan en el pH bajado y forman una estructura que tiene un color diferente.
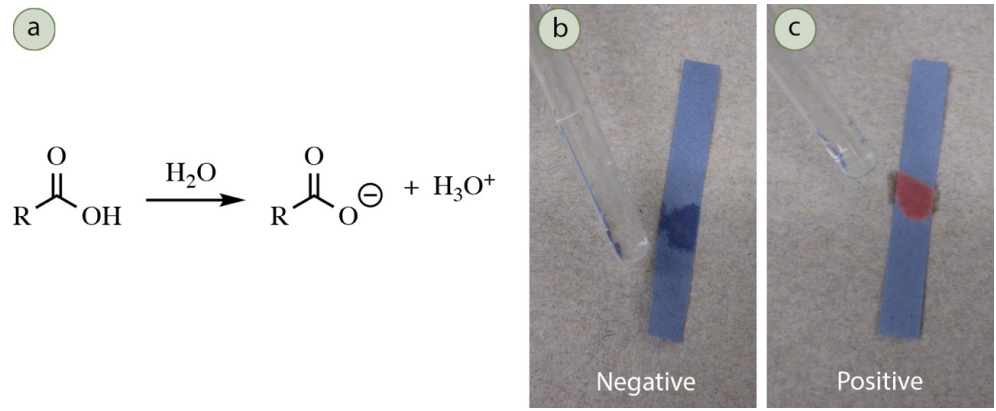
Procedimiento: Disolver 3 gotas o\(30 \: \text{mg}\) de muestra en\(1 \: \text{mL}\) agua. Sumerja una varilla de agitación de vidrio en la solución y toque la varilla hasta obtener papel tornasol azul. Un resultado positivo es un color rosado o rojo en el papel tornasol (Figura 6.68c). Si la muestra no se disuelve en agua, en su lugar disuelva la misma cantidad de desconocido en\(1 \: \text{mL}\) etanol. Agrega suficiente agua para que la solución apenas esté turbia. Después agrega unas gotas de etanol para que la solución vuelva a ser transparente, y prueba con el papel tornasol.
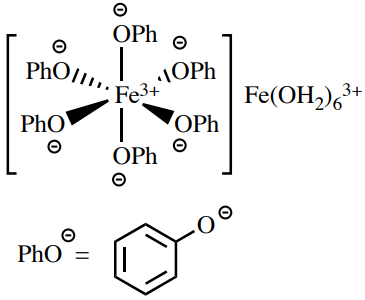
Prueba de fenol
Una solución de cloruro férrico es una prueba de fenoles, ya que forman complejos intensamente coloreados con\(\ce{Fe^{3+}}\) (a menudo azul oscuro). Se debate la estructura real de estos complejos,\(^{15}\) pero puede ser de la forma general en la Figura 6.69. Algunos compuestos de carbonilo con alto contenido de enol pueden dar falsos positivos con esta prueba.
Procedimiento: Colocar\(1 \: \text{mL}\) agua en un pequeño tubo de ensayo (\(13\)x\(100 \: \text{mm}\)) junto con 3 gotas o\(30 \: \text{mg}\) de muestra. Agrega 3 gotas de la\(5\% \: \ce{FeCl_3} \left( aq \right)\) solución amarilla, y mezcla agitando.
Un resultado positivo es un color azul intenso, morado, rojo o verde mientras que un resultado negativo es un color amarillo (el color original de la\(\ce{FeCl_3}\) solución, Figura 6.70).

Prueba de Nitrato de Plata
Una solución diluida de nitrato de plata en etanol es una prueba para algunos haluros de alquilo. La plata tiene una alta afinidad por los halógenos (forma fuertes enlaces\(\ce{AgX}\) iónicos), por lo que fomenta un\(S_\text{N}1\) mecanismo. Por esta razón, los haluros de alquilo terciario reaccionan más rápido que los haluros de alquilo secundario (que pueden o no reaccionar, incluso con calentamiento), y los haluros de alquilo primarios o haluros aromáticos no dan reacción. Los haluros de\(\left( \ce{CH_2=CHCH_2X} \right)\) alquilo bencílico\(\left( \ce{PhCH_2X} \right)\) y alílico también darán una reacción rápida. Un resultado positivo de la prueba es la formación del insoluble\(\ce{AgX}\) (Figura 6.71). \(\ce{AgCl}\)y\(\ce{AgBr}\) son sólidos blancos, mientras que\(\ce{AgI}\) es un sólido amarillo.
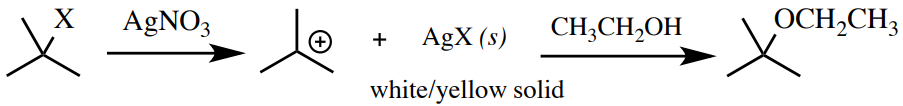
Procedimiento: En un pequeño tubo de ensayo (\(13\)x\(100 \: \text{mm}\)), añadir\(1\% \: \ce{AgNO_3}\) en solución\(2 \: \text{mL}\) de etanol. Añadir 4 gotas de muestra líquida o\(40 \: \text{mg}\) fo sólido disuelto en la cantidad mínima de etanol. Mezclar el tubo de ensayo agitando. Algunos compuestos tendrán una insolubilidad inicial cuando se mezclan por primera vez, pero el sólido a menudo se disuelve con remolinos. Un resultado positivo es un enturbiamiento sostenido blanco o amarillo. Si no se produce turbidez dentro de los 5 minutos, caliente el tubo en un baño de\(100^\text{o} \text{C}\) agua durante 1 minuto (Figura 6.72b). La ausencia de nubosidad incluso a\(100^\text{o} \text{C}\) es un resultado negativo (Figuras 6.72+6.73).

Para las reacciones que producen un precipitado intenso, la solución también puede tornarse de papel tornasol azul rosado (Figura 6.73c+d). Un análisis del mecanismo de reacción puede explicar la fuente de esta acidez.

Prueba de yoduro de sodio (Finkelstein)
Una solución de yoduro de sodio en acetona es una prueba para algunos cloruros y bromidos de alquilo. El mecanismo es en gran parte\(S_\text{N}2\), por lo que los haluros de alquilo primarios reaccionan más rápido que los haluros de alquilo secundario y los haluros de alquilo terciario generalmente no dan reacción La reacción es impulsada por la precipitación del disolvente de acetona\(\ce{NaCl}\) o\(\ce{NaBr}\) en el mismo. Por lo tanto, un resultado positivo de la prueba es la aparición de una turbidez blanca (\(\ce{NaX}\)sólida).
\[\begin{array}{ccccccccc} \ce{CH_3CH_2X} & + & \ce{NaI} \: \text{(acetone)} & \rightarrow & \ce{CH_3CH_2I} & + & \ce{NaX} \left( s \right) & & \left( \ce{X} = \ce{Cl}, \ce{Br} \right) \\ & & & & & & \text{white solid} & & \end{array}\]
Procedimiento: En un pequeño tubo de ensayo (\(13\)x\(100 \: \text{mm}\)), añadir\(15\% \: \ce{NaI}\) en solución\(2 \: \text{mL}\) de acetona. \(^{16}\)Agregar 4 gotas de muestra líquida o\(40 \: \text{mg}\) de sólido disuelto en la cantidad mínima de etanol. Mezclar el tubo de ensayo agitando.
Un resultado positivo es un enturbiamiento blanco sostenido. Si no se produce turbidez dentro de los 5 minutos, caliente el tubo en un baño de\(50^\text{o} \text{C}\) agua durante 1 minuto. La ausencia de turbidez incluso a\(50^\text{o} \text{C}\) es una reacción negativa (Figuras 6.74+6.75).


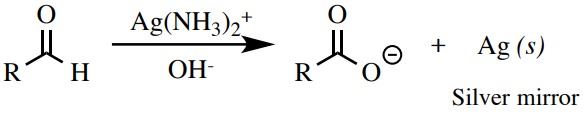
Prueba Tollens
El reactivo Tollens\(\left( \ce{Ag(NH_3)_2^+} \right)\) es un agente oxidante suave que puede oxidar aldehídos, pero no alcoholes u otros compuestos carbonílicos. Un resultado positivo de la prueba es la formación de plata elemental (Figura 6.76), que precipita como un “espejo de plata” en el tubo de ensayo, o como un precipitado coloidal negro.
Procedimiento: Mientras usa guantes, mezcla\(1 \: \text{mL}\) de\(5\% \: \ce{AgNO_3} \left( aq \right)\) (nota de seguridad: ¡tóxico!) con\(1 \: \text{mL}\) de\(10\% \: \ce{NaOH} \left( aq \right)\) en un tubo de ensayo de tamaño mediano (\(18\)x\(150 \: \text{mm}\)). Se formará un precipitado oscuro de óxido de plata (Figura 6.77b). Agregue gota\(10\% \: \ce{NH_4OH} \left( aq \right)\) a gota lo suficiente para simplemente disolver el precipitado (tenga en cuenta que se debe permitir algún tiempo entre adiciones). Esta solución es ahora el reactivo Tollens\(\ce{Ag(NH_3)_2^+}\) (Figura 6.77c).
Disolver 3 gotas o\(30 \: \text{mg}\) de muestra en unas gotas de éter dietílico (omitir disolvente si el compuesto es soluble en agua). Agregar esta solución al\(2\) -\(3 \: \text{mL}\) del reactivo Tollens previamente preparado. Mezclar los tubos de ensayo agitando. Un resultado positivo es un espejo plateado en los bordes del tubo de ensayo, o la formación de un precipitado negro. Un resultado negativo es una solución clara (Figuras 6.77d+6.78).
Limpieza: El reactivo puede formar una sustancia muy explosiva (fulminado de plata) con el tiempo, por lo que la prueba debe limpiarse inmediatamente. Acidifique la solución con\(5\% \: \ce{HCl} \left( aq \right)\), luego deséchelo en un vaso de precipitados de desechos. Un espejo plateado se puede quitar de la cristalería agregando una pequeña cantidad de\(6 \: \text{M} \: \ce{HNO_3} \left( aq \right)\).


\(^9\)El reactivo de Benedict se prepara de la siguiente manera, según lo publicado por el catálogo Flinn Scientific:\(173 \: \text{g}\) de citrato\(100 \: \text{g}\) de sodio hidratado y de carbonato de sodio anhidro se agrega a\(800 \: \text{mL}\) de agua destilada con calentamiento. La mezcla se filtra, luego se combina con una solución de sulfato de\(17.3 \: \text{g}\) cobre (II) pentahidrato disuelto en agua\(100 \: \text{mL}\) destilada. Las soluciones combinadas se diluyen a\(1 \: \text{L}\).
\(^{10}\)El reactivo de ácido crómico se prepara de la siguiente manera:\(25.0 \: \text{g}\) de óxido de cromo (VI) se agrega al ácido sulfúrico\(25 \: \text{mL}\) concentrado, que luego se agrega en porciones al\(75 \: \text{mL}\) agua. El reactivo tiene una vida útil muy larga (10+ años).
\(^{11}\)Preparación del reactivo 2,4-DNPH, tal como se publicó en B. Ruekberg, J. Chem. Ed. , 2005, 82 (9), p. A1310, es el siguiente: A un matraz\(125 \: \text{mL}\) Erlenmeyer seco se le añade\(3 \: \text{g}\) 2,4-dinitrofenilhidrazina,\(20 \: \text{mL}\) agua y\(70 \: \text{mL}\)\(95\%\) etanol. La solución se enfría en un baño de hielo con agitación, y cuando está a\(10^\text{o} \text{C}\),\(15 \: \text{mL}\) de ácido sulfúrico concentrado se agrega lentamente en porciones. Si la temperatura excede\(20^\text{o} \text{C}\) durante la adición, la solución debe dejarse enfriar\(10^\text{o} \text{C}\) antes de continuar. Luego se calienta la solución\(60^\text{o} \text{C}\) con agitación, y si quedan sólidos, se filtran. Finalmente, la solución se enfría.
\(^{12}\)La preparación del reactivo yodoforme es la siguiente:\(10 \: \text{g} \: \ce{KI}\) y\(5 \: \text{g} \: \ce{I_2}\) se disuelve en\(100 \: \text{mL}\) agua.
\(^{13}\)La preparación del reactivo Lucas es la siguiente:\(160 \: \text{g}\) de fresco anhidro\(\ce{ZnCl_2}\) se disuelve en\(100 \: \text{mL}\) de concentrado frío\(\ce{HCl}\).
\(^{14}\)Aunque los orgánicos clorados son típicamente más densos que el agua, el reactivo Lucas tiene una gran cantidad de soluto, y los compuestos clorados tienden a ser menos densos que el reactivo.
\(^{15}\)Ver Naturaleza, 24 de junio de 1950, 165, 1012.
\(^{16}\)Esta solución suele tener una lata amarilla.


