7: Bioquímica microbiana
- Page ID
- 54769
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
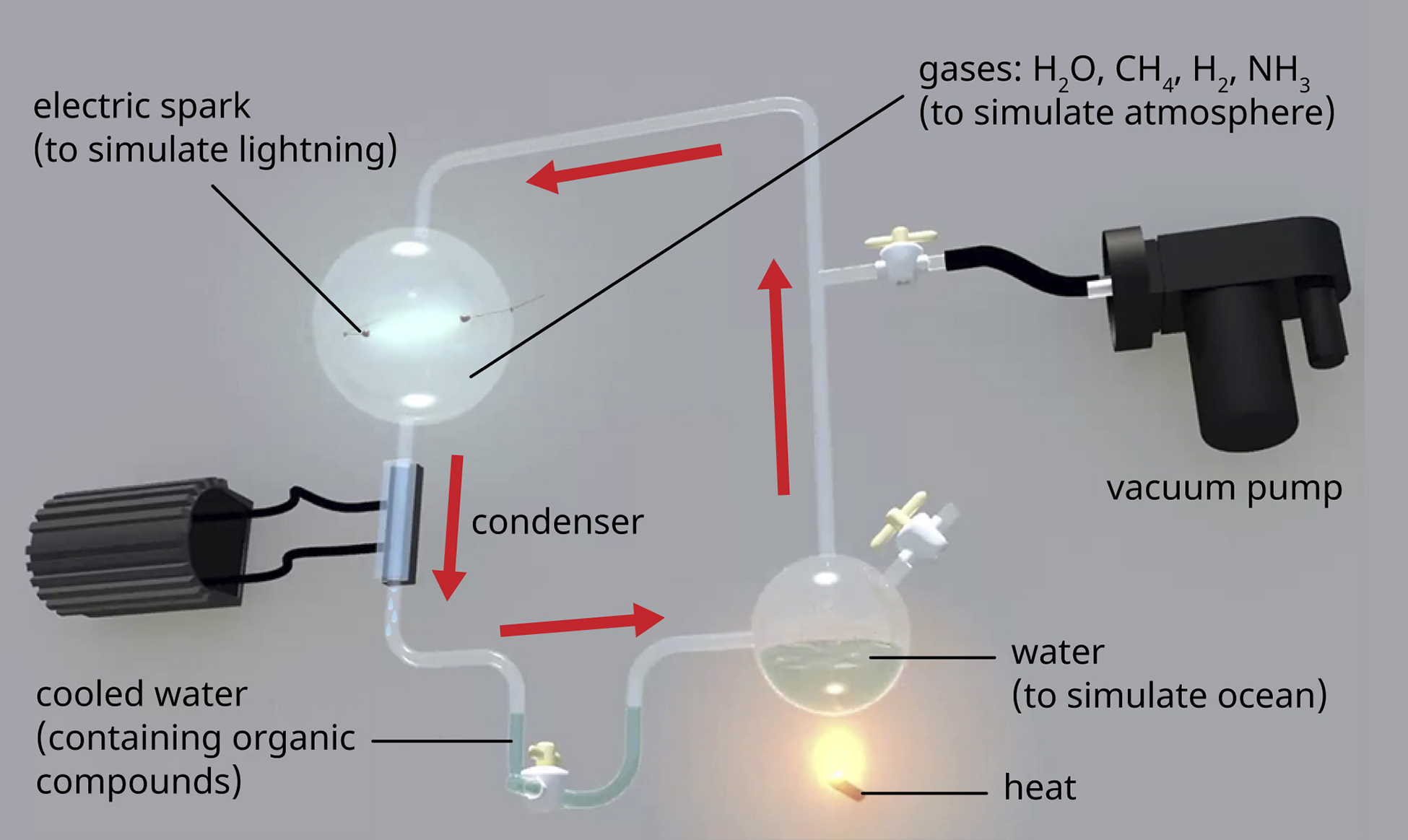
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Se estima que la tierra tiene 4.6 mil millones de años, pero durante los primeros 2 mil millones de años, la atmósfera carecía de oxígeno, sin el cual la tierra no podría soportar la vida tal como la conocemos. Una hipótesis sobre cómo surgió la vida en la tierra involucra el concepto de “sopa primordial”. Esta idea propone que la vida comenzó en un cuerpo de agua cuando los metales y gases de la atmósfera se combinaron con una fuente de energía, como los rayos o la luz ultravioleta, para formar los compuestos de carbono que son los bloques químicos de construcción de la vida. En 1952, Stanley Miller (1930-2007), estudiante de posgrado en la Universidad de Chicago, y su profesor Harold Urey (1893-1981), se propusieron confirmar esta hipótesis en un experimento ahora famoso. Miller y Urey combinaron lo que creían que eran los componentes principales de la atmósfera temprana de la tierra: agua (H 2 O), metano (CH 4), hidrógeno (H 2) y amoníaco (NH 3) y los sellaron en un matraz estéril. A continuación, calentaron el matraz para producir vapor de agua y pasaron chispas eléctricas a través de la mezcla para imitar los rayos en la atmósfera (Figura\(\PageIndex{1}\)). Al analizar el contenido del matraz una semana después, encontraron aminoácidos, las unidades estructurales de las proteínas, moléculas esenciales para la función de todos los organismos.
- 7.1: Moléculas orgánicas
- La bioquímica es la disciplina que estudia la química de la vida, y su objetivo es explicar la forma y la función a partir de principios químicos. La química orgánica es la disciplina dedicada al estudio de la química basada en carbono, que es la base para el estudio de las biomoléculas y la disciplina de la bioquímica. Tanto la bioquímica como la química orgánica se basan en los conceptos de química general.
- 7.2: Carbohidratos
- Las biomoléculas más abundantes en la tierra son los carbohidratos. Desde un punto de vista químico, los carbohidratos son principalmente una combinación de carbono y agua, y muchos de ellos tienen la fórmula empírica (CH2o), donde n es el número de unidades repetidas. Esta visión representa estas moléculas simplemente como cadenas de átomos de carbono “hidratadas” en las que las moléculas de agua se unen a cada átomo de carbono, lo que lleva al término “carbohidratos”.
- 7.3: Lípidos
- Aunque están compuestas principalmente por carbono e hidrógeno, las moléculas lipídicas también pueden contener oxígeno, nitrógeno, azufre y fósforo. Los lípidos sirven para numerosos y diversos propósitos en la estructura y funciones de los organismos. Pueden ser una fuente de nutrientes, una forma de almacenamiento de carbono, moléculas de almacenamiento de energía o componentes estructurales de membranas y hormonas. Los lípidos comprenden una amplia clase de muchos compuestos químicamente distintos, los más comunes de los cuales se discuten en esta sección.
- 7.4: Proteínas
- Los aminoácidos son capaces de unirse en esencialmente cualquier número, produciendo moléculas de esencialmente cualquier tamaño que poseen una amplia gama de propiedades físicas y químicas y realizan numerosas funciones vitales para todos los organismos. Las moléculas derivadas de aminoácidos pueden funcionar como componentes estructurales de células y entidades subcelulares, como fuentes de nutrientes, como reservorios de almacenamiento de átomos y energía, y como especies funcionales como hormonas, enzimas, receptores y moléculas de transporte.
- 7.5: Uso de la bioquímica para identificar microorganismos
- La identificación precisa de bacterias es esencial en un laboratorio clínico para el diagnóstico y manejo de epidemias, pandemias e intoxicaciones alimentarias causadas por brotes bacterianos. En esta sección, discutiremos algunos métodos que utilizan características bioquímicas para identificar microorganismos.
Miniatura: Un sitio de unión a enzima que normalmente se uniría al sustrato puede unirse alternativamente a un inhibidor competitivo, evitando el acceso al sustrato. La dihidrofolato reductasa es inhibida por metotrexato que impide la unión de su sustrato, el ácido fólico. Sitio de unión en azul, inhibidor en verde y sustrato en negro (PDB: 4QI9). (CC BY 4.0; Thomas Shafee).


