14.2: La Primera Ley de la Termodinámica
- Page ID
- 128058
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)objetivos de aprendizaje
- Explicar cómo el calor neto transferido y el trabajo neto realizado en un sistema se relacionan con la primera ley de la termodinámica
La primera ley de la termodinámica es una versión de la ley de conservación de la energía especializada para sistemas termodinámicos. Por lo general, se formula afirmando que el cambio en la energía interna de un sistema cerrado es igual a la cantidad de calor suministrado al sistema, menos la cantidad de trabajo realizado por el sistema en su entorno. La ley de conservación de la energía se puede afirmar así: La energía de un sistema aislado es constante.
Primera Ley de la Termodinámica: En este video continúo con mi serie de videos tutoriales sobre Física Térmica y Termodinámica. Está presentado a nivel de licenciatura y si bien está dirigido principalmente a carreras de física, debería ser útil para cualquiera que tome un primer curso en termodinámica como ingenieros, etc.
Si nos interesa cómo la transferencia de calor se convierte en trabajo, entonces es importante el principio de conservación de la energía. La primera ley de la termodinámica aplica el principio de conservación de energía a sistemas donde la transferencia de calor y el trabajo son los métodos para transferir energía dentro y fuera del sistema. En forma de ecuación, la primera ley de la termodinámica es

Energía Interna: La primera ley de la termodinámica es el principio de conservación de energía establecido para un sistema donde el calor y el trabajo son los métodos de transferencia de energía para un sistema en equilibrio térmico. Q representa la transferencia neta de calor: es la suma de todas las transferencias de calor dentro y fuera del sistema. Q es positivo para la transferencia neta de calor al sistema. W es el trabajo total realizado en y por el sistema. W es positivo cuando el sistema realiza más trabajo que en él. El cambio en la energía interna del sistema, ΔU, está relacionado con el calor y el trabajo por la primera ley de la termodinámica,\(\mathrm{ΔU=Q−W}\).
\[\mathrm{ΔU=Q−W.}\]
Aquí ΔU es el cambio en la energía interna U del sistema, Q es el calor neto transferido al sistema, y W es el trabajo neto realizado por el sistema. Utilizamos las siguientes convenciones de signos: si Q es positivo, entonces hay una transferencia neta de calor al sistema; si W es positivo, entonces hay trabajo neto realizado por el sistema. Por lo tanto, el Q positivo agrega energía al sistema y el W positivo toma energía del sistema. Así\(\mathrm{ΔU=Q−W}\). Tenga en cuenta también que si se produce más transferencia de calor al sistema que el trabajo realizado, la diferencia se almacena como energía interna. Los motores térmicos son un buen ejemplo de esto: la transferencia de calor a ellos se lleva a cabo para que puedan trabajar.
Presión y Volumen Constantes
El proceso isobárico es aquel en el que un gas sí funciona a presión constante, mientras que un proceso isocórico es aquel en el que el volumen se mantiene constante.
objetivos de aprendizaje
- Contraste procesos isobáricos e isocóricos
De acuerdo con la primera ley de la termodinámica, el calor transferido a un sistema puede convertirse en energía interna o utilizarse para hacer trabajo al medio ambiente. Un proceso en el que un gas sí trabaja en su ambiente a presión constante se denomina proceso isobárico, mientras que uno en el que el volumen se mantiene constante se denomina proceso isocórico.
Proceso Isobárico (Presión Constante)
Un proceso isobárico ocurre a presión constante. Dado que la presión es constante, la fuerza ejercida es constante y el trabajo realizado se da como PΔV. Un ejemplo sería tener un pistón móvil en un cilindro, de manera que la presión dentro del cilindro esté siempre a presión atmosférica, aunque esté aislada de la atmósfera. En otras palabras, el sistema está conectado dinámicamente, por un límite móvil, a un depósito de presión constante. Si un gas va a expandirse a una presión constante, el calor debe transferirse al sistema a cierta velocidad. Este proceso se llama expansión isobárica.

Fig 1: Una expansión isobárica de un gas requiere transferencia de calor durante la expansión para mantener constante la presión. Dado que la presión es constante, el trabajo realizado es PΔV.
Proceso Isochórico (Volumen Constante)
Un proceso isocórico es aquel en el que el volumen se mantiene constante, es decir, que el trabajo realizado por el sistema será cero. De ello se deduce que, para el sistema simple de dos dimensiones, cualquier energía térmica transferida al sistema externamente será absorbida como energía interna. Un proceso isocórico también se conoce como proceso isométrico o proceso isovolumétrico. Un ejemplo sería colocar en un fuego una lata cerrada que contenga solo aire. A una primera aproximación, la lata no se expandirá, y el único cambio será que el gas gane energía interna, como lo demuestra su aumento de temperatura y presión. Matemáticamente,
\[\mathrm{ΔQ=ΔU.}\]
Podemos decir que el sistema está aislado dinámicamente, por un límite rígido, del entorno.
Procesos Isotérmicos
Un proceso isotérmico es un cambio de un sistema termodinámico, en el que la temperatura permanece constante.
objetivos de aprendizaje
- Identificar los sistemas típicos en los que ocurre un proceso isotérmico
Un proceso isotérmico es un cambio de un sistema, en el que la temperatura permanece constante:\(\mathrm{ΔT = 0}\). Esto ocurre típicamente cuando un sistema está en contacto con un depósito térmico exterior (baño de calor), y el cambio ocurre lo suficientemente lento como para permitir que el sistema se ajuste continuamente a la temperatura del depósito a través del intercambio de calor. En contraste, un proceso adiabático es donde un sistema no intercambia calor con su entorno (\(\mathrm{Q = 0}\)). (Ver nuestro átomo en “Proceso adiabático. “) En otras palabras, en un proceso isotérmico, el valor\(\mathrm{ΔT = 0}\) pero\(\mathrm{Q ≠ 0}\), mientras que en un proceso adiabático,\(\mathrm{ΔT ≠ 0}\) pero\(\mathrm{Q = 0}\).
Gas Ideal en un Proceso Isotérmico
Para un ideal, el producto de presión y volumen (\(\mathrm{PV}\)) es una constante si el gas se mantiene en condiciones isotérmicas. (A esto se le llama históricamente ley de Boyle.) Sin embargo, los casos en los que el producto\(\mathrm{PV}\) es un término exponencial, no cumple. El valor de la constante es\(\mathrm{nRT}\), donde n es el número de moles de gas presentes y R es la constante de gas ideal. Es decir, se\(\mathrm{PV = nRT}\) aplica la ley de gas ideal. Esto significa que
\[\mathrm{P=\dfrac{nRT}{V}=\dfrac{constant}{V}}\]
sostiene.
Cálculo de Obra
En la termodinámica, el trabajo que implica cuando un gas cambia del estado A al estado B es simplemente
\[\mathrm{W_{A→B}=∫_{V_A}^{V_B}P \; dV.}\]
Para un proceso isotérmico reversible, esta integral equivale al área bajo la isoterma presión-volumen relevante, y se indica en azul para un gas ideal. Nuevamente,\(\mathrm{P =\frac{nRT}{V}}\) aplica y con T siendo constante (ya que este es un proceso isotérmico), tenemos

Trabajo realizado por gas durante la expansión: El área azul representa el “trabajo” realizado por el gas durante la expansión para este cambio isotérmico.
\[\mathrm{W_{A→B}=nRT∫_{V_A}^{V_B}\dfrac{1}{V}dV=nRT \ln \dfrac{V_B}{V_A}.}\]
También vale la pena señalar que, para muchos sistemas, si la temperatura se mantiene constante, la energía interna del sistema también es constante, y así ΔU=0ΔU=0. De la primera ley de la termodinámica, se deduce que Q=−WQ=−W para este mismo proceso isotérmico.
Procesos adiabáticos
Un proceso adiabático es cualquier proceso que ocurre sin ganancia o pérdida de calor dentro de un sistema.
objetivos de aprendizaje
- Evaluar los entornos en los que suelen ocurrir procesos isotérmicos
Un proceso isotérmico es un cambio de un sistema, en el que la temperatura permanece constante:\(\mathrm{ΔT = 0}\). Esto ocurre típicamente cuando un sistema está en contacto con un depósito térmico exterior (baño de calor), y el cambio ocurre lo suficientemente lento como para permitir que el sistema se ajuste continuamente a la temperatura del depósito a través del intercambio de calor. En contraste, un proceso adiabático es donde un sistema no intercambia calor con su entorno (\(\mathrm{Q = 0}\)). (Ver nuestro átomo en “Proceso adiabático. “) En otras palabras, en un proceso isotérmico, el valor\(\mathrm{ΔT = 0}\) pero\(\mathrm{Q ≠ 0}\), mientras que en un proceso adiabático,\(\mathrm{ΔT ≠ 0}\) pero\(\mathrm{Q = 0}\).
Gas Ideal en un Proceso Isotérmico
Para un ideal, el producto de presión y volumen (PV) es una constante si el gas se mantiene en condiciones isotérmicas. (A esto se le llama históricamente ley de Boyle.) Sin embargo, los casos en los que el producto PV es un término exponencial, no cumple. El valor de la constante es\(\mathrm{nRT}\), donde n es el número de moles de gas presentes y R es la constante de gas ideal. Es decir, se\(\mathrm{PV = nRT}\) aplica la ley de gas ideal. Esto significa que
\[\mathrm{P=\dfrac{nRT}{V}=\dfrac{constant}{V}}\]
sostiene. La familia de curvas generada por esta ecuación se muestra en. Cada curva se llama isoterma.

Isotermas de un Gas Ideal: Varias isotermas de un gas ideal en un diagrama PV.
Cálculo de Obra
En la termodinámica, el trabajo que implica cuando un gas cambia del estado A al estado B es simplemente
\[\mathrm{W_{A→B}=∫_{V_A}^{V_B} P \; dV.}\]
Para un proceso isotérmico reversible, esta integral equivale al área bajo la isoterma presión-volumen relevante, y se indica en azul para un gas ideal. Nuevamente, se aplica P = nRT/V y siendo T constante (ya que este es un proceso isotérmico), tenemos

Trabajo realizado por gas durante la expansión: El área azul representa el “trabajo” realizado por el gas durante la expansión para este cambio isotérmico.
\[\mathrm{W_{A→B}=nRT∫_{V_A}^{V_B}\dfrac{1}{V} \; dV=nRT \ln \dfrac{V_B}{V_A}.}\]
También vale la pena señalar que, para muchos sistemas, si la temperatura se mantiene constante, la energía interna del sistema también es constante, y así\(\mathrm{ΔU=0}\). De la primera ley de la termodinámica, se deduce que\(\mathrm{Q=−W}\) para este mismo proceso isotérmico.
Metabolismo Humano
La 1ª ley de la termodinámica explica el metabolismo humano: la conversión de los alimentos en energía que es utilizada por el cuerpo para realizar actividades.
objetivos de aprendizaje
- Catabolismo de contraste y anabolismo en lo que respecta a la energía
El metabolismo en los seres humanos es la conversión de los alimentos en energía, que luego es utilizada por el cuerpo para realizar actividades. Es un ejemplo de la primera ley de la termodinámica en acción. Considerando el cuerpo como el sistema de interés, podemos usar la primera ley para examinar la transferencia de calor, el trabajo y la energía interna en actividades que van desde el sueño hasta el ejercicio intenso. Por ejemplo, un factor importante en tales actividades es la temperatura corporal, normalmente mantenida constante por transferencia de calor a los alrededores, lo que significa que Q es negativo (es decir, nuestro cuerpo pierde calor). Otro factor es que el cuerpo suele trabajar en el mundo exterior, lo que significa que W es positivo. Así, en tales situaciones el cuerpo pierde energía interna, ya que\(\mathrm{ΔU=Q−W}\) es negativo.
Comer
Ahora considera los efectos de comer. El cuerpo metaboliza todos los alimentos que consumimos. Comer aumenta la energía interna del cuerpo al agregar energía potencial químico. En esencia, el metabolismo utiliza un proceso de oxidación en el que se libera la energía potencial química de los alimentos. Esto implica que el aporte alimentario es en forma de trabajo. La energía alimentaria se reporta en una unidad especial, conocida como la Caloría. Esta energía se mide quemando alimentos en un calorímetro, que es como se determinan las unidades.
Catabolismo y anabolismo
El catabolismo es la vía que descompone las moléculas en unidades más pequeñas y produce energía. El anabolismo es la construcción de moléculas a partir de unidades más pequeñas. El anabolismo consume la energía producida por la descomposición catabólica de tu comida para crear moléculas más útiles para tu cuerpo.
Energía interna
Nuestro cuerpo pierde energía interna, y hay tres lugares a los que esta energía interna puede ir: a la transferencia de calor, al trabajo y a la grasa almacenada (una pequeña fracción también va a la reparación y crecimiento celular). Como se muestra en la Fig. 1, la transferencia de calor y el trabajo sacan la energía interna del cuerpo, y luego la comida la devuelve. Si comes la cantidad justa de comida, entonces tu energía interna promedio permanece constante. Todo lo que pierda por la transferencia de calor y hacer el trabajo es reemplazado por alimentos, de manera que, a la larga, ΔU=0. Si comes en exceso repetidamente, entonces ΔU siempre es positivo, y tu cuerpo almacena esta energía interna extra como grasa. Lo contrario es cierto si comes muy poco. Si ΔU es negativo por unos días, entonces el cuerpo metaboliza su propia grasa para mantener la temperatura corporal y hacer un trabajo que tome energía del cuerpo. Este proceso es como la dieta produce pérdida de peso.
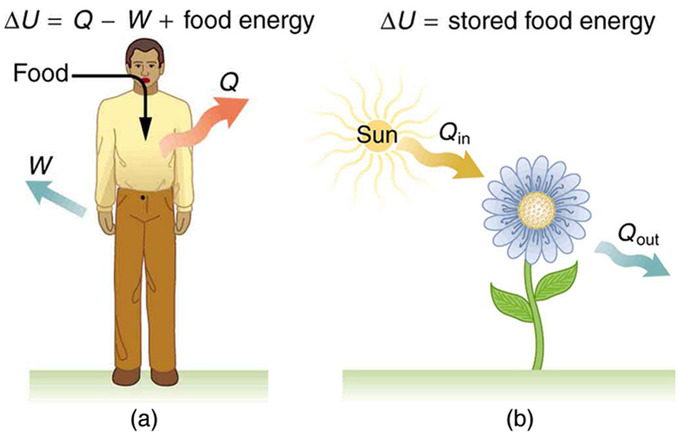
Metabolismo: a) La primera ley de la termodinámica aplicada al metabolismo. El calor transferido fuera del cuerpo (Q) y el trabajo realizado por el cuerpo (W) eliminan la energía interna, mientras que la ingesta de alimentos la reemplaza. (La ingesta de alimentos puede considerarse como un trabajo realizado en el cuerpo.) (b) Las plantas convierten parte de la transferencia de calor radiante en la luz solar en energía química almacenada, un proceso llamado fotosíntesis.
Metabolismo
La vida no siempre es así de simple, como sabe cualquier persona que hace dieta. El cuerpo almacena grasa o la metaboliza sólo si la ingesta de energía cambia por un periodo de varios días. Una vez que has estado en una dieta importante, la siguiente es menos exitosa porque tu cuerpo altera la forma en que responde a la baja ingesta de energía. Tu tasa metabólica basal es la velocidad a la que los alimentos se convierten en transferencia de calor y trabajo realizado mientras el cuerpo está en completo reposo. El cuerpo ajusta su tasa metabólica basal para compensar (parcialmente) por comer en exceso o subcomer. El cuerpo disminuirá la tasa metabólica en lugar de eliminar su propia grasa para reemplazar la ingesta de alimentos perdida. Te enfriarás más fácilmente y te sentirás menos enérgico como resultado de la menor tasa metabólica, y no perderás peso tan rápido como antes. El ejercicio ayuda con la pérdida de peso porque produce tanto transferencia de calor desde tu cuerpo como desde el trabajo, y eleva tu tasa metabólica incluso cuando estás en reposo.
Irreversibilidad
El cuerpo nos proporciona una excelente indicación de que muchos procesos termodinámicos son irreversibles. Un proceso irreversible puede ir en una dirección pero no en la inversa, bajo un conjunto dado de condiciones. Por ejemplo, aunque la grasa corporal se puede convertir para hacer trabajo y producir transferencia de calor, el trabajo realizado en el cuerpo y la transferencia de calor en él no se pueden convertir en grasa corporal. De lo contrario, podríamos saltarnos el almuerzo tomando el sol nosotros mismos o bajando las escaleras. Otro ejemplo de un proceso termodinámico irreversible es la fotosíntesis. Este proceso es la ingesta de una forma de energía, la luz, por parte de las plantas y su conversión a energía potencial química. Ambas aplicaciones de la primera ley de la termodinámica se ilustran en. Una gran ventaja de tales leyes de conservación es que describen con precisión los puntos de inicio y finalización de procesos complejos (como el metabolismo y la fotosíntesis) sin tener en cuenta las complicaciones intermedias.
Puntos Clave
- La primera ley de la termodinámica es una versión de la ley de conservación de la energía, especializada para sistemas termodinámicos.
- En forma de ecuación, la primera ley de la termodinámica es\(\mathrm{ΔU=Q−W}\).
- Los motores térmicos son un buen ejemplo de la aplicación de la 1ª ley; la transferencia de calor a ellos se lleva a cabo para que puedan hacer trabajo.
- Un proceso isobárico ocurre a presión constante. Dado que la presión es constante, la fuerza ejercida es constante y el trabajo realizado se da como\(\mathrm{PΔV}\).
- Una expansión isobárica de un gas requiere transferencia de calor para mantener la presión constante.
- Un proceso isocórico es aquel en el que el volumen se mantiene constante, es decir, que el trabajo realizado por el sistema será cero. El único cambio será que un gas gane energía interna.
- Para un gas ideal, el producto de presión y volumen (PV) es una constante si el gas se mantiene en condiciones isotérmicas.
- Para un gas ideal, el trabajo involucrado cuando un gas cambia del estado A al estado B a través de un proceso isotérmico se da como\(\mathrm{W_{A→B}=nRT \ln \frac{V_B}{V_A}}\).
- Para muchos sistemas, si la temperatura se mantiene constante, la energía interna del sistema también es constante. De ello se deduce que\(\mathrm{Q =-W}\) en este caso.
- Los procesos adiabáticos pueden ocurrir si el contenedor del sistema tiene paredes térmicamente aisladas o el proceso ocurre en un tiempo extremadamente corto.
- Para un gas monatómico ideal en expansión adiabática que funciona en su entorno (W es positivo), la energía interna del gas debería disminuir.
- En cierto sentido, el proceso isotérmico puede considerarse como el extremo opuesto del proceso adiabático. En los procesos isotérmicos, el intercambio de calor es lo suficientemente lento como para que la temperatura del sistema permanezca constante.
- El metabolismo humano es un proceso complicado. La 1ª ley de la termodinámica describe los puntos de inicio y fin de estos procesos.
- Nuestro cuerpo pierde energía interna. Hay tres lugares a los que esta energía interna puede ir: a la transferencia de calor, al trabajo y a la grasa almacenada.
- Nuestro cuerpo proporciona un buen ejemplo de procesos irreversibles. Aunque la grasa corporal se puede convertir para hacer trabajo y producir transferencia de calor, el trabajo realizado en el cuerpo y la transferencia de calor en él no se pueden convertir en grasa corporal.
Términos Clave
- energía interna: La suma de toda la energía presente en el sistema, incluyendo la energía cinética y potencial; equivalentemente, la energía necesaria para crear un sistema, excluyendo la energía necesaria para desplazar su entorno.
- calor: energía transferida de un cuerpo a otro por interacciones térmicas
- ley de conservación de energía: La ley que establece que la cantidad total de energía en cualquier sistema aislado permanece constante, y no puede crearse ni destruirse, aunque puede cambiar de forma.
- energía interna: La suma de toda la energía presente en el sistema, incluyendo la energía cinética y potencial; equivalentemente, la energía necesaria para crear un sistema, excluyendo la energía necesaria para desplazar su entorno.
- reversible: Capaz de regresar al estado original sin consumo de energía libre y aumento de entropía.
- gas ideal: Un gas hipotético cuyas moléculas no exhiben interacción y experimentan colisión elástica entre sí y con las paredes del contenedor.
- Ley de Boyle: La observación de que la presión de un gas ideal es inversamente proporcional a su volumen a temperatura constante.
- gas ideal: Un gas hipotético cuyas moléculas no exhiben interacción y experimentan colisión elástica entre sí y con las paredes del contenedor.
- metabolismo: El conjunto completo de reacciones químicas que ocurren en las células vivas.
- oxidación: Una reacción en la que los átomos de un elemento pierden electrones y la valencia del elemento aumenta.
- caloría: La energía necesaria para aumentar la temperatura de 1 kilogramo de agua en 1 kelvin. Equivale a 1,000 (pequeñas) calorías.
LICENCIAS Y ATRIBUCIONES
CONTENIDO CON LICENCIA CC, COMPARTIDO PREVIAMENTE
- Curación y Revisión. Proporcionado por: Boundless.com. Licencia: CC BY-SA: Atribución-CompartirIgual
CC CONTENIDO LICENCIADO, ATRIBUCIÓN ESPECÍFICA
- Colegio OpenStax, La Primera Ley de la Termodinámica. 17 de septiembre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42232/latest/. Licencia: CC BY: Atribución
- Primera ley de la termodinámica. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/First_l... termodinámica. Licencia: CC BY-SA: Atribución-CompartirIgual
- calor. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Heat. Licencia: CC BY-SA: Atribución-CompartirIgual
- Sin límites. Proporcionado por: Boundless Learning. Ubicado en: www.boundless.com//fisics/de... nternal-energia. Licencia: CC BY-SA: Atribución-CompartirIgual
- ley de conservación de la energía. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/law_of... tion_of_energy. Licencia: CC BY-SA: Atribución-CompartirIgual
- Primera Ley de la Termodinámica. Ubicado en: http://www.youtube.com/watch?v=Ih1NJ0aQI6s. Licencia: Dominio Público: Sin Derechos de Autor Conocidos. Términos de licencia: Licencia estándar de YouTube
- Colegio OpenStax, La Primera Ley de la Termodinámica. 1 de octubre de 2012. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42232/latest/. Licencia: CC BY: Atribución
- Proceso termodinámico. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Thermodynamic_process. Licencia: CC BY-SA: Atribución-CompartirIgual
- Colegio OpenStax, La Primera Ley de la Termodinámica y Algunos Procesos Simples. 17 de septiembre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42233/latest/. Licencia: CC BY: Atribución
- Sin límites. Proporcionado por: Boundless Learning. Ubicado en: www.boundless.com//fisics/de... nternal-energia. Licencia: CC BY-SA: Atribución-CompartirIgual
- Primera Ley de la Termodinámica. Ubicado en: http://www.youtube.com/watch?v=Ih1NJ0aQI6s. Licencia: Dominio Público: Sin Derechos de Autor Conocidos. Términos de licencia: Licencia estándar de YouTube
- Colegio OpenStax, La Primera Ley de la Termodinámica. 1 de octubre de 2012. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42232/latest/. Licencia: CC BY: Atribución
- Colegio OpenStax, La Primera Ley de la Termodinámica y Algunos Procesos Simples. 4 de febrero de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42233/latest/. Licencia: CC BY: Atribución
- gas ideal. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/ideal_gas. Licencia: CC BY-SA: Atribución-CompartirIgual
- Proceso isotérmico. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Isothermal_process. Licencia: CC BY-SA: Atribución-CompartirIgual
- Reversible. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/reversible. Licencia: CC BY-SA: Atribución-CompartirIgual
- Ley de Boyle. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/Boyle's_law. Licencia: CC BY-SA: Atribución-CompartirIgual
- Primera Ley de la Termodinámica. Ubicado en: http://www.youtube.com/watch?v=Ih1NJ0aQI6s. Licencia: Dominio Público: Sin Derechos de Autor Conocidos. Términos de licencia: Licencia estándar de YouTube
- Colegio OpenStax, La Primera Ley de la Termodinámica. 1 de octubre de 2012. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42232/latest/. Licencia: CC BY: Atribución
- Colegio OpenStax, La Primera Ley de la Termodinámica y Algunos Procesos Simples. 4 de febrero de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42233/latest/. Licencia: CC BY: Atribución
- Proceso isotérmico. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Isothermal_process. Licencia: CC BY: Atribución
- gas ideal. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/ideal_gas. Licencia: CC BY-SA: Atribución-CompartirIgual
- Ley de Boyle. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/Boyle's_law. Licencia: CC BY-SA: Atribución-CompartirIgual
- Proceso isotérmico. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Isothermal_process. Licencia: CC BY-SA: Atribución-CompartirIgual
- Reversible. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/reversible. Licencia: CC BY-SA: Atribución-CompartirIgual
- Primera Ley de la Termodinámica. Ubicado en: http://www.youtube.com/watch?v=Ih1NJ0aQI6s. Licencia: Dominio Público: Sin Derechos de Autor Conocidos. Términos de licencia: Licencia estándar de YouTube
- Colegio OpenStax, La Primera Ley de la Termodinámica. 1 de octubre de 2012. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42232/latest/. Licencia: CC BY: Atribución
- Colegio OpenStax, La Primera Ley de la Termodinámica y Algunos Procesos Simples. 4 de febrero de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42233/latest/. Licencia: CC BY: Atribución
- Proceso isotérmico. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Isothermal_process. Licencia: CC BY: Atribución
- Proceso isotérmico. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Isothermal_process. Licencia: CC BY: Atribución
- Proceso isotérmico. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Isothermal_process. Licencia: CC BY: Atribución
- Colegio OpenStax, La Primera Ley de la Termodinámica. 17 de septiembre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42232/latest/. Licencia: CC BY: Atribución
- metabolismo. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/metabolism. Licencia: CC BY-SA: Atribución-CompartirIgual
- caloría. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/caloría. Licencia: CC BY-SA: Atribución-CompartirIgual
- oxidación. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/oxidación. Licencia: CC BY-SA: Atribución-CompartirIgual
- Primera Ley de la Termodinámica. Ubicado en: http://www.youtube.com/watch?v=Ih1NJ0aQI6s. Licencia: Dominio Público: Sin Derechos de Autor Conocidos. Términos de licencia: Licencia estándar de YouTube
- Colegio OpenStax, La Primera Ley de la Termodinámica. 1 de octubre de 2012. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42232/latest/. Licencia: CC BY: Atribución
- Colegio OpenStax, La Primera Ley de la Termodinámica y Algunos Procesos Simples. 4 de febrero de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42233/latest/. Licencia: CC BY: Atribución
- Proceso isotérmico. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Isothermal_process. Licencia: CC BY: Atribución
- Proceso isotérmico. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Isothermal_process. Licencia: CC BY: Atribución
- Proceso isotérmico. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Isothermal_process. Licencia: CC BY: Atribución
- Colegio OpenStax, La Primera Ley de la Termodinámica. 12 de febrero de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42232/latest/. Licencia: CC BY: Atribución


