9.2: Relación de Presión, Volumen, Cantidad y Temperatura - La Ley de Gas Ideal
- Page ID
- 75791
- Identificar las relaciones matemáticas entre las diversas propiedades de los gases
- Utilice la ley de gas ideal, y las leyes de gas relacionadas, para calcular los valores de diversas propiedades del gas bajo condiciones específicas
Durante los siglos XVII y especialmente XVIII, impulsados tanto por el deseo de entender la naturaleza como por la búsqueda de hacer globos en los que pudieran volar (Figura\(\PageIndex{1}\)), varios científicos establecieron las relaciones entre las propiedades físicas macroscópicas de los gases, es decir, presión, volumen, temperatura y cantidad de gas. Aunque sus mediciones no fueron precisas según los estándares actuales, pudieron determinar las relaciones matemáticas entre pares de estas variables (por ejemplo, presión y temperatura, presión y volumen) que se mantienen para un gas ideal, una construcción hipotética que los gases reales se aproximan bajo ciertas condiciones. Finalmente, estas leyes individuales se combinaron en una sola ecuación, la ley de gas ideal, que relaciona las cantidades de gas para los gases y es bastante precisa para bajas presiones y temperaturas moderadas. Consideraremos los desarrollos clave en las relaciones individuales (por razones pedagógicas no del todo en orden histórico), luego los juntaremos en la ley ideal del gas.

Presión y Temperatura: Ley de Amontons
Imagínese llenar con gas un contenedor rígido unido a un manómetro y luego sellar el contenedor para que ningún gas pueda escapar. Si el contenedor se enfría, el gas en su interior también se enfría y se observa que su presión disminuye. Dado que el contenedor es rígido y herméticamente sellado, tanto el volumen como el número de moles de gas permanecen constantes. Si calentamos la esfera, el gas del interior se calienta más (Figura\(\PageIndex{2}\)) y la presión aumenta.
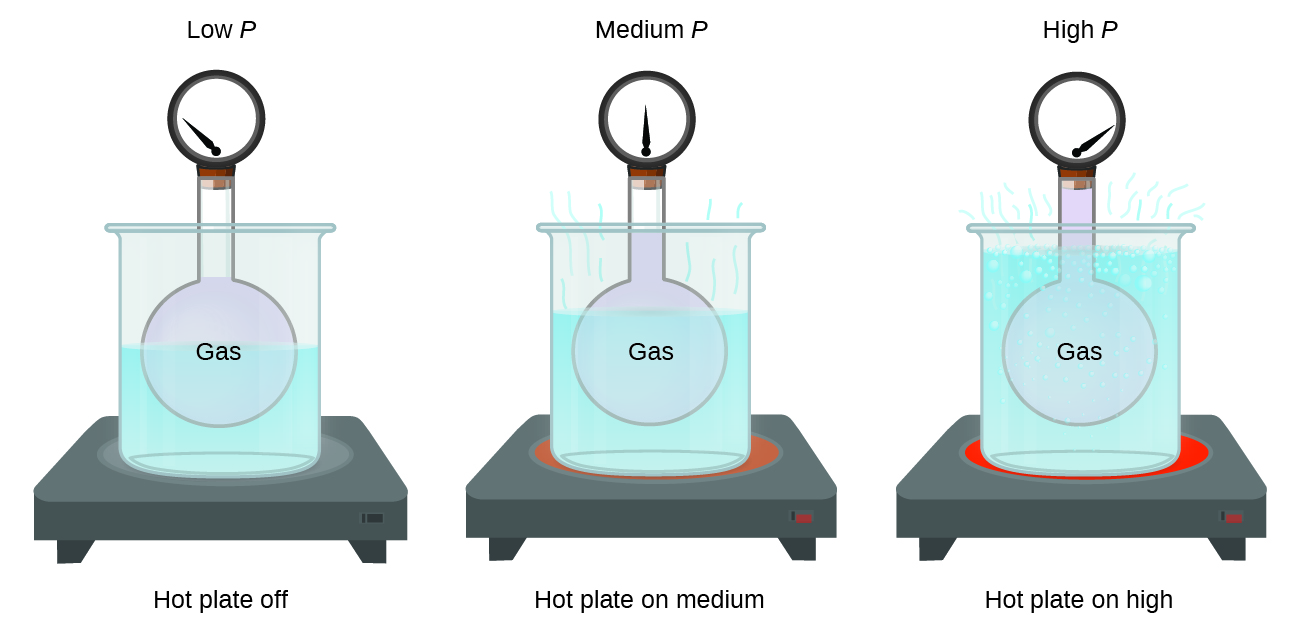
Esta relación entre temperatura y presión se observa para cualquier muestra de gas confinada a un volumen constante. Un ejemplo de datos experimentales de presión-temperatura se muestra para una muestra de aire bajo estas condiciones en la Figura\(\PageIndex{3}\). Encontramos que la temperatura y la presión están linealmente relacionadas, y si la temperatura está en la escala Kelvin, entonces P y T son directamente proporcionales (nuevamente, cuando el volumen y los moles de gas se mantienen constantes); si la temperatura en la escala Kelvin aumenta en cierto factor, la presión del gas aumenta por el mismo factor.
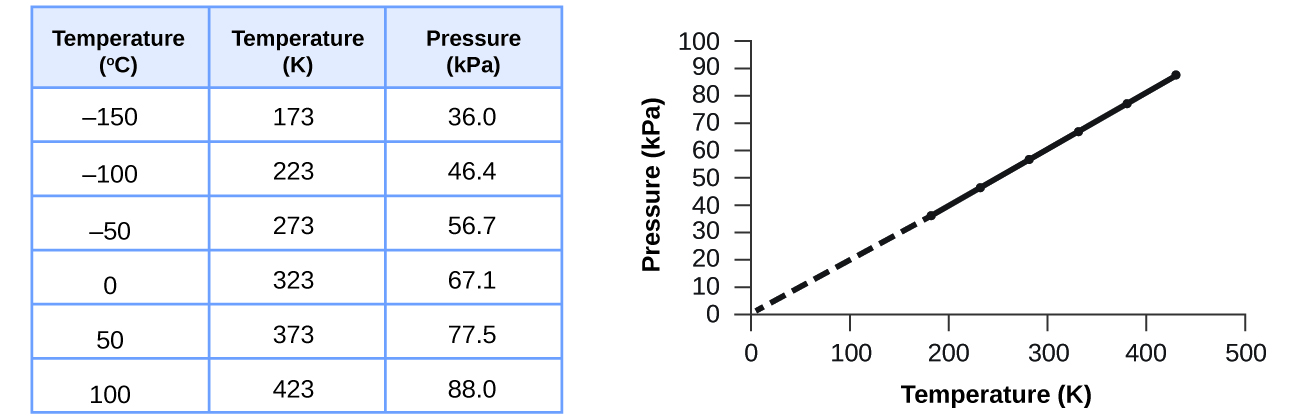
Guillaume Amontons fue el primero en establecer empíricamente la relación entre la presión y la temperatura de un gas (~1700), y Joseph Louis Gay-Lussac determinó la relación con mayor precisión (~1800). Debido a esto, la relación P - T para los gases se conoce como ley de Amontons o ley de Gay-Lussac. Bajo cualquier nombre, establece que la presión de una cantidad dada de gas es directamente proporcional a su temperatura en la escala Kelvin cuando el volumen se mantiene constante. Matemáticamente, esto se puede escribir:
\[P∝T\ce{\:or\:}P=\ce{constant}×T\ce{\:or\:}P=k×T \nonumber \]
donde ∝ significa “es proporcional a”, y k es una constante de proporcionalidad que depende de la identidad, cantidad y volumen del gas.
Para un volumen de gas confinado y constante, la relación\(\dfrac{P}{T}\) es, por lo tanto, constante (es decir,\(\dfrac{P}{T}=k\)). Si el gas está inicialmente en “Condición 1” (con P = P 1 y T = T 1), y luego cambia a “Condición 2” (con P = P 2 y T = T 2), tenemos eso \(\dfrac{P_1}{T_1}=k\)y\(\dfrac{P_2}{T_2}=k\), lo que reduce a\(\dfrac{P_1}{T_1}=\dfrac{P_2}{T_2}\). Esta ecuación es útil para cálculos de presión-temperatura para un gas confinado a volumen constante. Tenga en cuenta que las temperaturas deben estar en la escala Kelvin para cualquier cálculo de la ley de gases (0 en la escala Kelvin y la temperatura más baja posible se llama cero absoluto). (También tenga en cuenta que hay al menos tres formas en las que podemos describir cómo cambia la presión de un gas a medida que cambia su temperatura: Podemos usar una tabla de valores, una gráfica o una ecuación matemática).
Se usa una lata de spray para el cabello hasta que esté vacía excepto por el propelente, el gas isobutano.
- En la lata está la advertencia “Almacenar solo a temperaturas inferiores a 120 °F (48.8 °C). No incinere”. ¿Por qué?
- El gas en la lata está inicialmente a 24 °C y 360 kPa, y la lata tiene un volumen de 350 mL. Si la lata se deja en un automóvil que alcanza los 50 °C en un día caluroso, ¿cuál es la nueva presión en la lata?
Solución
- La lata contiene una cantidad de gas isobutano a un volumen constante, por lo que si la temperatura se incrementa por calentamiento, la presión aumentará proporcionalmente. La alta temperatura podría conducir a una alta presión, haciendo que la lata explote. (Además, el isobutano es combustible, por lo que la incineración podría hacer que la lata explote).
- Estamos buscando un cambio de presión debido a un cambio de temperatura a volumen constante, por lo que usaremos la ley de Amontons/Gay-Lussac. Tomando P 1 y T1 como valores iniciales, T 2 como temperatura donde se desconoce la presión y P 2 como presión desconocida, y convirtiendo °C a K, tenemos:
Reorganizar y resolver da:
\(P_2=\mathrm{\dfrac{360\:kPa×323\cancel{K}}{297\cancel{K}}=390\:kPa}\)
Una muestra de nitrógeno, N 2, ocupa 45.0 mL a 27 °C y 600 torr. ¿Qué presión tendrá si se enfría a —73 °C mientras el volumen permanece constante?
- Contestar
-
400 torr
Volumen y Temperatura: Ley de Carlos
Si llenamos un globo con aire y lo sellamos, el globo contiene una cantidad específica de aire a presión atmosférica, digamos 1 atm. Si ponemos el globo en un refrigerador, el gas en su interior se enfría y el globo se contrae (aunque tanto la cantidad de gas como su presión permanecen constantes). Si hacemos el globo muy frío, se encogerá mucho, y se expande de nuevo cuando se calienta.
Estos ejemplos del efecto de la temperatura sobre el volumen de una cantidad dada de un gas confinado a presión constante son ciertos en general: El volumen aumenta a medida que aumenta la temperatura, y disminuye a medida que disminuye la temperatura. Los datos de volumen-temperatura para una muestra de 1 mol de gas metano a 1 atm se enumeran y grafican en la Figura\(\PageIndex{2}\).
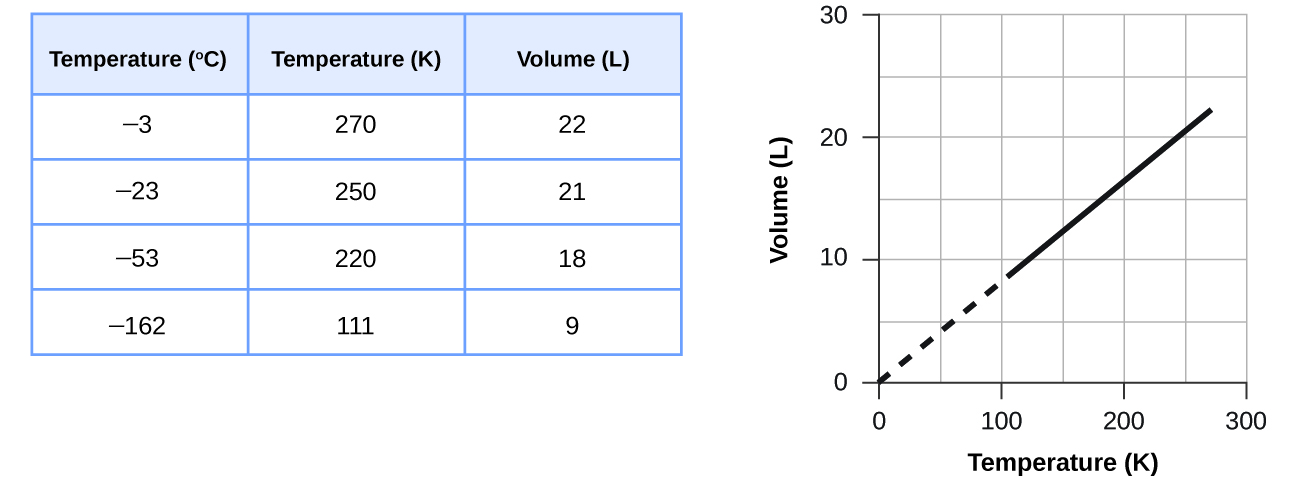
La relación entre el volumen y la temperatura de una determinada cantidad de gas a presión constante se conoce como ley de Charles en reconocimiento al científico francés y pionero del vuelo en globo Jacques Alexandre César Charles. La ley de Charles establece que el volumen de una cantidad dada de gas es directamente proporcional a su temperatura en la escala Kelvin cuando la presión se mantiene constante.
Matemáticamente, esto se puede escribir como:
\[VαT\ce{\:or\:}V=\ce{constant}·T\ce{\:or\:}V=k·T \nonumber \]
siendo k una constante de proporcionalidad que depende de la cantidad y presión del gas.
Para una muestra de gas confinada a presión constante,\(\dfrac{V}{T}\) es constante (es decir, la relación = k), y como se ve con la relación P - T, esto lleva a otra forma de ley de Carlos:\(\dfrac{V_1}{T_1}=\dfrac{V_2}{T_2}\).
Una muestra de dióxido de carbono, CO 2, ocupa 0.300 L a 10 °C y 750 torr. ¿Qué volumen tendrá el gas a 30 °C y 750 torr?
Solución
Debido a que estamos buscando el cambio de volumen causado por un cambio de temperatura a presión constante, este es un trabajo para la ley de Charles. Tomando V 1 y T1 como valores iniciales, T 2 como la temperatura a la que se desconoce el volumen y V 2 como el volumen desconocido, y convirtiendo °C en K tenemos:
Reorganizar y resolver da:\(V_2=\mathrm{\dfrac{0.300\:L×303\cancel{K}}{283\cancel{K}}=0.321\:L}\)
Esta respuesta respalda nuestra expectativa de la ley de Charles, a saber, que elevar la temperatura del gas (de 283 K a 303 K) a una presión constante producirá un aumento en su volumen (de 0.300 L a 0.321 L).
Una muestra de oxígeno, O 2, ocupa 32.2 mL a 30 °C y 452 torr. ¿Qué volumen ocupará a —70 °C y la misma presión?
- Contestar
-
21.6 mL
Cambio La temperatura a veces se mide con un termómetro de gas observando el cambio en el volumen del gas a medida que la temperatura cambia a presión constante. El hidrógeno en un termómetro de gas hidrógeno en particular tiene un volumen de 150.0 cm 3 cuando se sumerge en una mezcla de hielo y agua (0.00 °C). Cuando se sumerge en amoníaco líquido hirviendo, el volumen del hidrógeno, a la misma presión, es de 131.7 cm 3. Encuentra la temperatura del amoníaco hirviendo en las escalas Kelvin y Celsius.
Solución
Un cambio de volumen causado por un cambio de temperatura a presión constante significa que debemos usar la ley de Charles. Tomando V 1 y T1 como valores iniciales, T 2 como la temperatura a la que se desconoce el volumen y V 2 como el volumen desconocido, y convirtiendo °C en K tenemos:
\[\dfrac{V_1}{T_1}=\dfrac{V_2}{T_2}\textrm{ which means that }\mathrm{\dfrac{150.0\:cm^3}{273.15\:K}}=\dfrac{131.7\:\ce{cm}^3}{T_2} \nonumber \]
Reordenamiento da\(T_2=\mathrm{\dfrac{131.7\cancel{cm}^3×273.15\:K}{150.0\:cm^3}=239.8\:K}\)
Al restar 273.15 de 239.8 K, encontramos que la temperatura del amoníaco hirviendo en la escala Celsius es —33.4 °C.
¿Cuál es el volumen de una muestra de etano a 467 K y 1.1 atm si ocupa 405 mL a 298 K y 1.1 atm?
- Contestar
-
635 mL
Volumen y Presión: Ley de Boyle
Si llenamos parcialmente una jeringa hermética con aire, la jeringa contiene una cantidad específica de aire a temperatura constante, digamos 25 °C. Si empujamos lentamente el émbolo manteniendo la temperatura constante, el gas en la jeringa se comprime en un volumen menor y su presión aumenta; si sacamos el émbolo, el volumen aumenta y la presión disminuye. Este ejemplo del efecto del volumen sobre la presión de una cantidad dada de un gas confinado es cierto en general. Disminuir el volumen de un gas contenido aumentará su presión, y al aumentar su volumen disminuirá su presión. De hecho, si el volumen aumenta en cierto factor, la presión disminuye por el mismo factor, y viceversa. Los datos de volumen-presión para una muestra de aire a temperatura ambiente se representan gráficamente en la Figura\(\PageIndex{5}\).

A diferencia de las relaciones P-T y V-T, la presión y el volumen no son directamente proporcionales entre sí. En cambio,\(P\) y\(V\) exhibir proporcionalidad inversa: El aumento de la presión resulta en una disminución del volumen del gas. Matemáticamente esto se puede escribir:
\[P \propto \dfrac{1}{V} \nonumber \]
o
\[P=k⋅ \dfrac{1}{V} \nonumber \]
o
\[PV=k \nonumber \]
o
\[P_1V_1=P_2V_2 \nonumber \]
con\(k\) ser una constante. Gráficamente, esta relación se muestra por la línea recta que resulta al trazar la inversa de la presión\(\left(\dfrac{1}{P}\right)\) versus el volumen (V), o la inversa del volumen\(\left(\dfrac{1}{V}\right)\) frente a la presión (\(P\)). Las gráficas con líneas curvas son difíciles de leer con precisión a valores bajos o altos de las variables, y son más difíciles de usar para ajustar ecuaciones teóricas y parámetros a datos experimentales. Por esas razones, los científicos suelen tratar de encontrar la manera de “linealizar” sus datos. Si trazamos P versus V, obtenemos una hipérbola (Figura\(\PageIndex{6}\)).

La relación entre el volumen y la presión de una determinada cantidad de gas a temperatura constante fue publicada por primera vez por el filósofo natural inglés Robert Boyle hace más de 300 años. Se resume en el comunicado ahora conocido como ley de Boyle: El volumen de una cantidad dada de gas mantenido a temperatura constante es inversamente proporcional a la presión bajo la que se mide.
La muestra de gas tiene un volumen de 15.0 mL a una presión de 13.0 psi. Determinar la presión del gas a un volumen de 7.5 mL, usando:
- la gráfica P - V en la Figura\(\PageIndex{6a}\)
- la gráfica\(\dfrac{1}{P}\) vs. V en la Figura\(\PageIndex{6b}\)
- la ecuación de la ley de Boyle
Comente sobre la probable precisión de cada método.
Solución
- La estimación a partir de la gráfica P - V da un valor para P en algún lugar alrededor de 27 psi.
- La estimación a partir de la gráfica\(\dfrac{1}{P}\) versus V da un valor de aproximadamente 26 psi.
- De la ley de Boyle, sabemos que el producto de presión y volumen (PV) para una muestra dada de gas a temperatura constante siempre es igual al mismo valor. Por lo tanto tenemos P 1 V 1 = k y P 2 V 2 = k lo que significa que P 1 V 1 = P 2 V 2.
Usando P 1 y V 1 como los valores conocidos 13.0 psi y 15.0 mL, P 2 como la presión a la que se desconoce el volumen, y V 2 como el volumen desconocido, tenemos:
\[P_1V_1=P_2V_2\mathrm{\:or\:13.0\:psi×15.0\:mL}=P_2×7.5\:\ce{mL} \nonumber \]
Resolviendo:
\[P_2=\mathrm{\dfrac{13.0\:psi×15.0\cancel{mL}}{7.5\cancel{mL}}=26\:psi} \nonumber \]
Fue más difícil estimar bien a partir de la gráfica P - V, por lo que (a) es probable que sea más inexacta que (b) o (c). El cálculo será tan preciso como lo permitan la ecuación y las mediciones.
La muestra de gas tiene un volumen de 30.0 mL a una presión de 6.5 psi. Determine el volumen del gas a una presión de 11.0 psi, usando:
- la gráfica P - V en la Figura\(\PageIndex{6a}\)
- la gráfica\(\dfrac{1}{P}\) vs. V en la Figura\(\PageIndex{6b}\)
- la ecuación de la ley de Boyle
Comente sobre la probable precisión de cada método.
- Contestar a
-
aproximadamente 17—18 mL
- Respuesta b
-
~18 mL
- Respuesta c
-
17.7 mL; fue más difícil estimar bien a partir de la gráfica P - V, por lo que (a) es probable que sea más inexacto que (b); el cálculo será tan preciso como lo permitan la ecuación y las mediciones
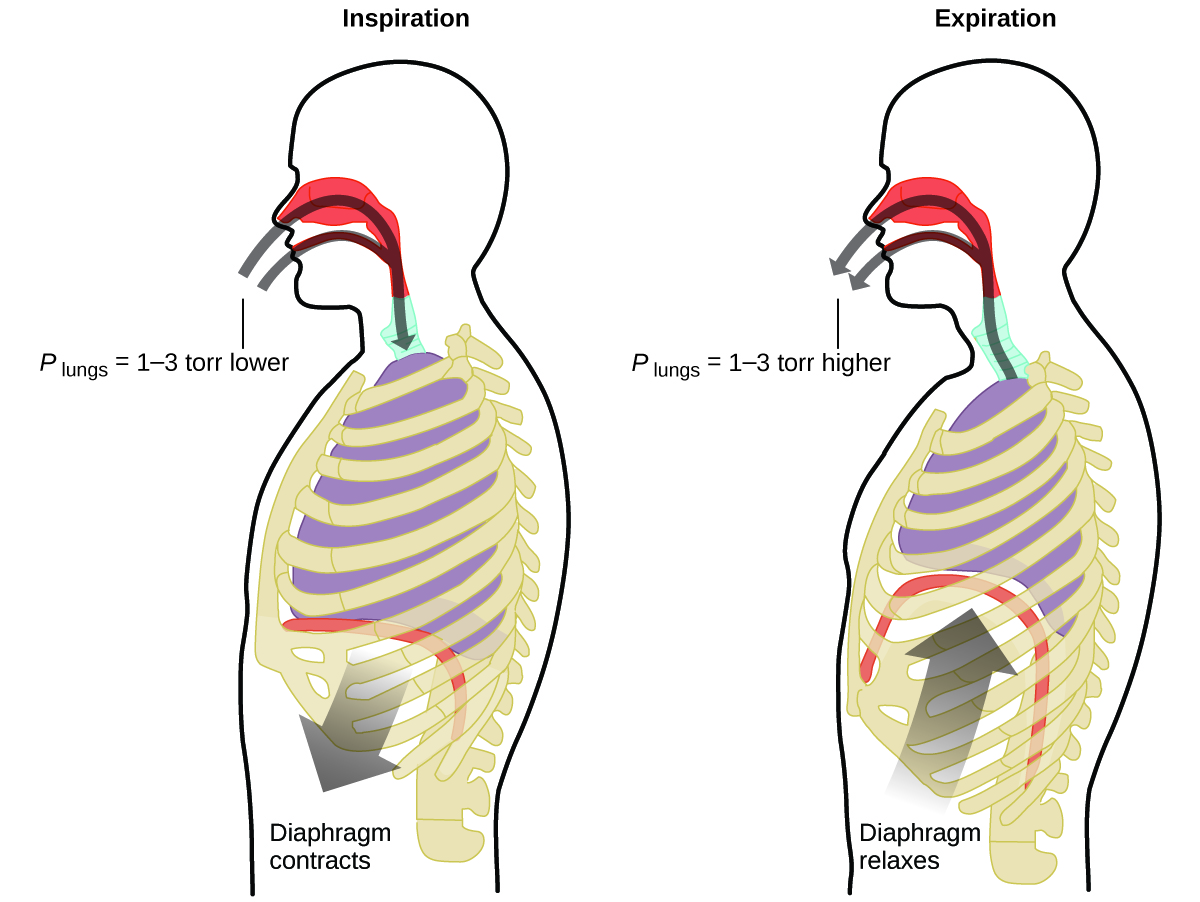
¿Qué haces unas 20 veces por minuto durante toda tu vida, sin descanso, y muchas veces sin siquiera ser consciente de ello? La respuesta, por supuesto, es la respiración, o la respiración. ¿Cómo funciona? Resulta que aquí se aplican las leyes de gas. Tus pulmones absorben el gas que tu cuerpo necesita (oxígeno) y se deshacen de los gases residuales (dióxido de carbono). Los pulmones están hechos de tejido esponjoso y elástico que se expande y se contrae mientras respira. Al inhalar, el diafragma y los músculos intercostales (los músculos entre las costillas) se contraen, expandiendo la cavidad torácica y haciendo que su volumen pulmonar sea más grande. El incremento de volumen conduce a una disminución de la presión (ley de Boyle). Esto hace que el aire fluya hacia los pulmones (de alta presión a baja presión). Al exhalar, el proceso se invierte: Tu diafragma y los músculos de las costillas se relajan, tu cavidad torácica se contrae y tu volumen pulmonar disminuye, haciendo que la presión aumente (la ley de Boyle nuevamente), y el aire sale de los pulmones (de alta presión a baja presión). Luego inhalas y exhalas una y otra vez, repitiendo este ciclo de leyes de Boyle por el resto de tu vida (Figura\(\PageIndex{7}\)).
Moles de Gas y Volumen: Ley de Avogadro
El científico italiano Amedeo Avogadro adelantó una hipótesis en 1811 para dar cuenta del comportamiento de los gases, afirmando que volúmenes iguales de todos los gases, medidos en las mismas condiciones de temperatura y presión, contienen el mismo número de moléculas. A lo largo del tiempo, esta relación fue apoyada por muchas observaciones experimentales expresadas por la ley de Avogadro: Para un gas confinado, el volumen (V) y el número de moles (n) son directamente proporcionales si la presión y la temperatura permanecen constantes.
En forma de ecuación, esto está escrito como:
\[V∝n\textrm{ or }V=k×n\textrm{ or }\dfrac{V_1}{n_1}=\dfrac{V_2}{n_2} \nonumber \]
Las relaciones matemáticas también se pueden determinar para los otros pares de variables, como P versus n, y n versus T.
Visite esta simulación interactiva de PhET para investigar las relaciones entre la presión, el volumen, la temperatura y la cantidad de gas. Utilice la simulación para examinar el efecto de cambiar un parámetro sobre otro mientras se mantienen constantes los otros parámetros (como se describe en las secciones anteriores sobre las diversas leyes de gas).
La Ley de Gas Ideal
A este punto, se han discutido cuatro leyes separadas que relacionan la presión, el volumen, la temperatura y el número de moles del gas:
- Ley de Boyle: PV = constante a T y n constantes
- Ley de Amontons:\(\dfrac{P}{T}\) = constante a V y n constantes
- Ley de Carlos:\(\dfrac{V}{T}\) = constante a P y n constantes
- Ley de Avogadro:\(\dfrac{V}{n}\) = constante a P y T constantes
La combinación de estas cuatro leyes produce la ley de gas ideal, una relación entre la presión, el volumen, la temperatura y el número de moles de un gas:
\[PV=nRT \nonumber \]
donde P es la presión de un gas, V es su volumen, n es el número de moles del gas, T es su temperatura en la escala Kelvin, y R es una constante llamada constante de gas ideal o constante de gas universal. Las unidades utilizadas para expresar presión, volumen y temperatura determinarán la forma adecuada de la constante de gas según lo requiera el análisis dimensional, siendo los valores más comúnmente encontrados 0.08206 L atm mol —1 K —1 y 8.3145 kPa L mol —1 K —1.
La ley de gas ideal es fácil de recordar y aplicar en la solución de problemas, siempre y cuando se utilicen los valores y unidades adecuados para la constante de gas, R.
Se dice que los gases cuyas propiedades de P, V y T se describen con precisión por la ley de gas ideal (o las otras leyes de gas) exhiben un comportamiento ideal o se aproximan a los rasgos de un gas ideal. Un gas ideal es un constructo hipotético que puede ser utilizado junto con la teoría molecular cinética para explicar efectivamente las leyes de gas como se describirá en un módulo posterior de este capítulo. Aunque todos los cálculos presentados en este módulo asumen un comportamiento ideal, esta suposición sólo es razonable para gases bajo condiciones de presión relativamente baja y alta temperatura. En el módulo final de este capítulo, se introducirá una ley de gas modificada que da cuenta del comportamiento no ideal observado para muchos gases a presiones relativamente altas y bajas temperaturas.
La ecuación de gas ideal contiene cinco términos, la constante de gas R y las propiedades variables P, V, n y T. Especificar cuatro de estos términos permitirá el uso de la ley de gas ideal para calcular el quinto término como se demuestra en los siguientes ejercicios de ejemplo.
El metano, CH 4, está siendo considerado para su uso como combustible automotriz alternativo para reemplazar la gasolina. Un galón de gasolina podría ser reemplazado por 655 g de CH 4. ¿Cuál es el volumen de esta cantidad de metano a 25 °C y 745 torr?
Solución
Calcular la presión en bar de 2520 moles de hidrógeno gaseoso almacenado a 27 °C en el tanque de almacenamiento de 180 litros de un moderno automóvil impulsado por hidrógeno.
- Contestar
-
350 bar
Si el número de moles de un gas ideal se mantiene constante bajo dos conjuntos diferentes de condiciones, se obtiene una relación matemática útil llamada ley de gas combinado:\(\dfrac{P_1V_1}{T_1}=\dfrac{P_2V_2}{T_2}\) usando unidades de atm, L y K. Ambos conjuntos de condiciones son iguales al producto de n × R (donde n = el número de moles del gas y R es la constante ideal de la ley del gas).
Cuando se llena de aire, un tanque de buceo típico con un volumen de 13.2 L tiene una presión de 153 atm (Figura\(\PageIndex{8}\)). Si la temperatura del agua es de 27 °C, ¿cuántos litros de aire proporcionará dicho tanque a los pulmones de un buceador a una profundidad de aproximadamente 70 pies en el océano donde la presión es de 3.13 atm?

Dejando 1 representar el aire en el tanque de buceo y 2 representar el aire en los pulmones, y observando que la temperatura corporal (la temperatura que el aire estará en los pulmones) es de 37 °C, tenemos:
\[\dfrac{P_1V_1}{T_1}=\dfrac{P_2V_2}{T_2}⟶\mathrm{\dfrac{(153\:atm)(13.2\:L)}{(300\:K)}=\dfrac{(3.13\:atm)(\mathit{V}_2)}{(310\:K)}} \nonumber \]
Resolviendo para V 2:
\[V_2=\mathrm{\dfrac{(153\cancel{atm})(13.2\:L)(310\cancel{K})}{(300\cancel{K})(3.13\cancel{atm})}=667\:L} \nonumber \]
(Nota: Tenga en cuenta que este ejemplo en particular es aquel en el que el supuesto de comportamiento ideal del gas no es muy razonable, ya que involucra gases a presiones relativamente altas y bajas temperaturas. A pesar de esta limitación, el volumen calculado puede ser visto como una buena estimación de “estadio de béisbol”.)
Se encontró que una muestra de amoníaco ocupa 0.250 L en condiciones de laboratorio de 27 °C y 0.850 atm. Encuentra el volumen de esta muestra a 0 °C y 1.00 atm.
- Contestar
-
0.193 L
Ya sea buceando en la Gran Barrera de Coral en Australia (se muestra en la Figura\(\PageIndex{9}\)) o en el Caribe, los buceadores deben entender cómo la presión afecta una serie de cuestiones relacionadas con su comodidad y seguridad.

La presión aumenta con la profundidad del océano y la presión cambia más rápidamente a medida que los buceadores llegan a la superficie. La presión que experimenta un buceador es la suma de todas las presiones por encima del buceador (del agua y del aire). La mayoría de las mediciones de presión se dan en unidades de atmósferas, expresadas como “atmósferas absolutas” o ATA en la comunidad de buceo: Cada 33 pies de agua salada representa 1 ATA de presión además de 1 ATA de presión de la atmósfera al nivel del mar. A medida que un buceador desciende, el aumento de la presión hace que las bolsas de aire del cuerpo en los oídos y los pulmones se compriman; en el ascenso, la disminución de la presión hace que estas bolsas de aire se expandan, rompiendo potencialmente los tímpanos o estallando los pulmones. Por lo tanto, los buzos deben someterse a la ecualización agregando aire a los espacios aéreos del cuerpo en el descenso respirando normalmente y agregando aire a la máscara respirando por la nariz o agregando aire a las orejas y senos paranasales mediante técnicas de ecualización; el corolario también es cierto en el ascenso, los buzos deben liberar aire del cuerpo para mantener la ecualización. La flotabilidad, o la capacidad de controlar si un buceador se hunde o flota, es controlada por el compensador de flotabilidad (BCD). Si un buceador está ascendiendo, el aire en su BCD se expande debido a una menor presión según la ley de Boyle (disminuir la presión de los gases aumenta el volumen). El aire en expansión aumenta la flotabilidad del buceador, y ella o él comienza a ascender. El buceador debe ventilar el aire del BCD o arriesgarse a un ascenso incontrolado que pueda romperle los pulmones. Al descender, el aumento de presión hace que el aire en el BCD se comprima y el buceador se hunda mucho más rápidamente; el buceador debe agregar aire al BCD o arriesgarse a un descenso incontrolado, enfrentando presiones mucho más altas cerca del fondo oceánico. La presión también impacta cuánto tiempo un buceador puede permanecer bajo el agua antes de ascender. Cuanto más profundo se sumerge un buzo, más comprimido es el aire que se respira debido al aumento de la presión: Si un buceador se sumerge 33 pies, la presión es de 2 ATA y el aire se comprimiría a la mitad de su volumen original. El buzo consume el aire disponible dos veces más rápido que en la superficie.
Condiciones estándar de temperatura y presión
Hemos visto que el volumen de una cantidad dada de gas y el número de moléculas (moles) en un volumen dado de gas varían con los cambios de presión y temperatura. Los químicos a veces hacen comparaciones con una temperatura y presión estándar (STP) para reportar propiedades de los gases: 273.15 K (0.00 °C) y 1 atm (101.325 kPa). En STP, un gas ideal tiene un volumen de aproximadamente 22.4 L, esto se conoce como el volumen molar estándar (Figura\(\PageIndex{10}\)).
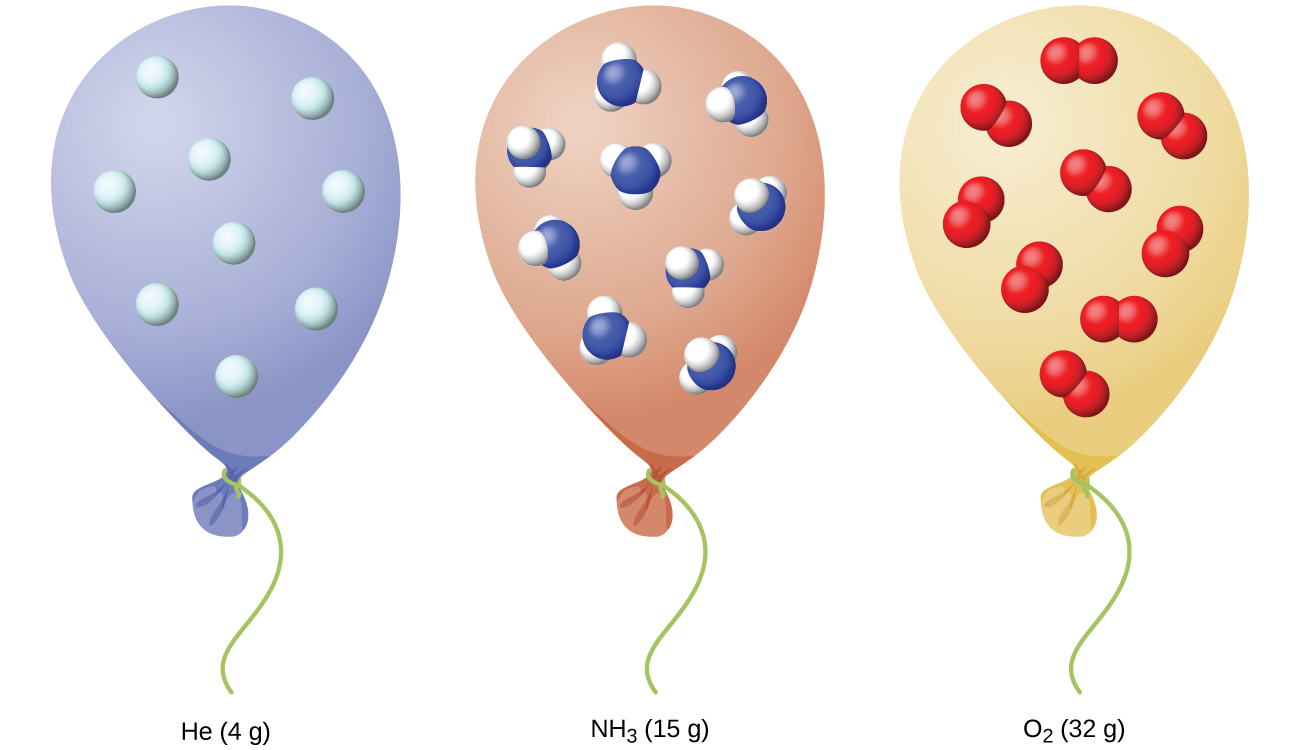
Resumen
El comportamiento de los gases puede ser descrito por varias leyes basadas en observaciones experimentales de sus propiedades. La presión de una cantidad dada de gas es directamente proporcional a su temperatura absoluta, siempre que el volumen no cambie (ley de Amontons). El volumen de una muestra de gas dada es directamente proporcional a su temperatura absoluta a presión constante (ley de Charles). El volumen de una cantidad dada de gas es inversamente proporcional a su presión cuando la temperatura se mantiene constante (ley de Boyle). Bajo las mismas condiciones de temperatura y presión, volúmenes iguales de todos los gases contienen el mismo número de moléculas (ley de Avogadro).
Las ecuaciones que describen estas leyes son casos especiales de la ley de gas ideal, PV = nRT, donde P es la presión del gas, V es su volumen, n es el número de moles del gas, T es su temperatura kelvin y R es la constante de gas ideal (universal).
Ecuaciones Clave
- PV = nRT
Resumen
- cero absoluto
- temperatura a la que el volumen de un gas sería cero según la ley de Charles.
- Ley de Amontons
- (también, ley de Gay-Lussac) la presión de un número dado de moles de gas es directamente proporcional a su temperatura Kelvin cuando el volumen se mantiene constante
- Ley de Avogadro
- volumen de un gas a temperatura y presión constantes es proporcional al número de moléculas de gas
- Ley de Boyle
- el volumen de un número dado de moles de gas mantenido a temperatura constante es inversamente proporcional a la presión bajo la cual se mide
- Ley de Carlos
- el volumen de un número dado de moles de gas es directamente proporcional a su temperatura Kelvin cuando la presión se mantiene constante
- gas ideal
- gas hipotético cuyas propiedades físicas están perfectamente descritas por las leyes de gas
- constante de gas ideal (R)
- constante derivada de la ecuación de gas ideal R = 0.08226 L atm mol —1 K —1 o 8.314 L kPa mol —1 K —1
- ley de gas ideal
- relación entre la presión, el volumen, la cantidad y la temperatura de un gas en condiciones derivadas de la combinación de las leyes de gas simples
- condiciones estándar de temperatura y presión (STP)
- 273.15 K (0 °C) y 1 atm (101.325 kPa)
- volumen molar estándar
- volumen de 1 mol de gas a STP, aproximadamente 22.4 L para gases que se comportan idealmente


