1.3: Las propiedades físicas y químicas
- Page ID
- 1795
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)habilidades para desarrollar
- Identificar propiedades y cambios en la materia como físicos o químicos
- Identificar propiedades de la materia como extensas o intensivas
Las características que nos permiten distinguir una sustancia de otra se llaman propiedades. Una propiedad física es una característica de la materia que no está asociada con un cambio en su composición química. Ejemplos familiares de propiedades físicas incluyen densidad, color, dureza, puntos de fusión, ebullición y conductividad eléctrica. Podemos observar algunas propiedades físicas, como la densidad y el color, sin cambiar el estado físico de la materia observada. Otras propiedades físicas, como la temperatura de fusión del hierro o la temperatura de congelación del agua, solo se pueden observar cuando la materia experimenta un cambio físico. Un cambio físico es un cambio en el estado o las propiedades de la materia sin ningún cambio acompañante en su composición química (las identidades de las sustancias contenidas en la materia). Observamos un cambio físico cuando la cera se derrite, cuando el azúcar se disuelve en el café y cuando el vapor se condensa en agua líquida (Figura \(\PageIndex{1}\)). Otros ejemplos de cambios físicos incluyen la magnetización y desmagnetización de metales (como se hace con las etiquetas de seguridad antirrobo comunes) y la molienda de sólidos en polvos (que a veces pueden producir cambios notables en el color). En cada uno de estos ejemplos, hay un cambio en el estado físico, la forma o las propiedades de la sustancia, pero ningún cambio en su composición química.

El cambio de un tipo de materia a otro tipo (o la incapacidad de cambiar) es una propiedad química. Los ejemplos de propiedades químicas incluyen inflamabilidad, toxicidad, acidez, reactividad (muchos tipos) y calor de combustión. El hierro, por ejemplo, se combina con el oxígeno en presencia de agua para formar óxido; el cromo no se oxida (Figura \(\PageIndex{2}\)). La nitroglicerina es muy peligrosa porque explota fácilmente; el neón casi no presenta peligro porque no es muy reactivo.

Para identificar una propiedad química, buscamos un cambio químico. Un cambio químico siempre produce uno o más tipos de materia que son diferentes de la materia presente antes del cambio. La formación del óxido es un cambio químico porque el óxido es una materia diferente que el hierro, el oxígeno, y el agua, que están presentes antes de que se forma el óxido. La explosión de la nitroglicerina es un cambio químico porque los gases producidos son tipos de materia muy diferentes de la sustancia original. Otros ejemplos de cambios químicos incluyen reacciones que se realizan en un laboratorio (como el cobre que reacciona con ácido nítrico), todas las formas de combustión (quema) y alimentos que se cocinan, digieren o se pudren (Figura \(\PageIndex{3}\)).

Las propiedades de la materia caen en una de dos categorías. Si la propiedad depende de la cantidad de materia presente, es una propiedad extensa. La masa y el volumen de una sustancia son ejemplos de propiedades extensivas; por ejemplo, un galón de leche tiene más masa y volumen que una taza de leche. El valor de una propiedad extensa es directamente proporcional a la cantidad de materia en cuestión. Si la propiedad de una muestra de materia no depende de la cantidad de materia presente, es una propiedad intensiva. La temperatura es un ejemplo de una propiedad intensiva. Si el galón y la taza de leche están a 20°C (temperatura ambiente), cuando se combinan, la temperatura se mantiene en 20°C. Como otro ejemplo, considere las propiedades distintas pero relacionadas del calor y la temperatura. Una gota de aceite de cocina caliente salpicado en su brazo causa una breve molestia, mientras que una olla de aceite caliente produce quemaduras graves. Tanto la gota como la olla de aceite están a la misma temperatura (una propiedad intensiva), pero la olla claramente contiene mucho más calor (propiedad extensa).
El diamante del peligro
Es posible que haya visto el símbolo que se muestra en la Figura \(\PageIndex{4}\) en recipientes de productos químicos en un laboratorio o lugar de trabajo. A veces llamado “diamante de fuego” o “diamante de peligro”, este diamante de riesgo químico proporciona información valiosa que resume brevemente los diversos peligros de los que debe estar atento al trabajar con una sustancia en particular.
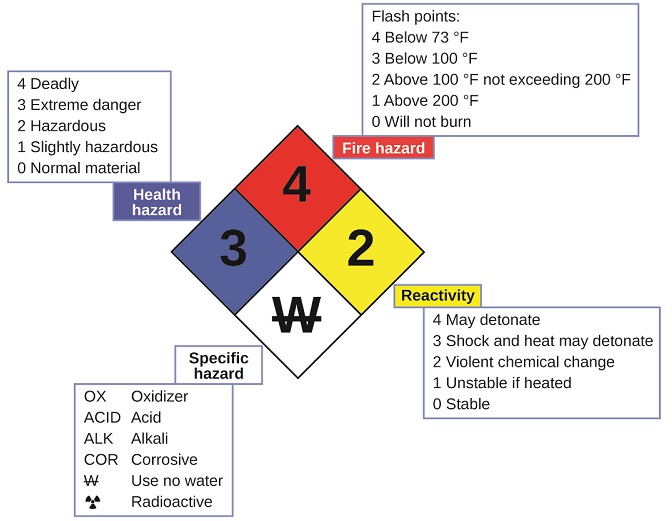
El Sistema de Identificación de Peligros 704 de la Agencia Nacional de Protección contra Incendios (NFPA) fue desarrollado por NFPA para dar información de seguridad sobre ciertas sustancias. El sistema detalla la inflamabilidad, la reactividad, la salud y otros peligros. Dentro del símbolo de diamante general, el diamante superior (rojo) especifica el nivel de riesgo de incendio (rango de temperatura para el punto de inflamación). El diamante azul (izquierdo) indica el nivel de peligro para la salud. El diamante amarillo (a la derecha) describe los peligros de reactividad, como la facilidad con que la sustancia experimentará la detonación o un cambio químico violento. El diamante blanco (abajo) señala peligros especiales, como si se trata de un oxidante (que permite que la sustancia se queme en ausencia de aire/oxígeno), sufre una reacción inusual o peligrosa con el agua, es corrosivo, ácido, alcalino, un peligro biológico, radioactivo, etc. Cada peligro se clasifica en una escala de 0 a 4, donde 0 no es peligroso y 4 es muy peligroso.
Aunque muchos elementos difieren dramáticamente en sus propiedades químicas y físicas, algunos elementos tienen propiedades similares. Podemos identificar grupos de elementos que exhiben comportamientos comunes. Por ejemplo, muchos elementos conducen bien el calor y la electricidad, mientras que otros son malos conductores. Estas propiedades se pueden usar para clasificar los elementos en tres clases: metales (elementos que conducen bien), no metales (elementos que conducen mal) y metaloides (elementos que tienen propiedades de metales y no metales).
La tabla periódica es una tabla de elementos que coloca elementos con propiedades similares juntos (Figura \(\PageIndex{5}\)). Aprenderás más sobre la tabla periódica si continúes con tu estudio de química.
Resumen
Todas las sustancias tienen propiedades físicas y químicas diferentes, y pueden sufrir cambios físicos o químicos. Las propiedades físicas, como la dureza y el punto de ebullición, y los cambios físicos, como la fusión o la congelación, no involucran un cambio en la composición de la materia. Las propiedades químicas, como la inflamabilidad y la acidez, y los cambios químicos, como la oxidación, implican la producción de materia que es diferente de la materia con la que empezó.
Las propiedades medibles caen en una de dos categorías. Las propiedades extensivas dependen de la cantidad de materia presente, por ejemplo, la masa de oro. Las propiedades intensivas no dependen de la cantidad de materia presente, por ejemplo, la densidad del oro. El calor es un ejemplo de una propiedad extensa, y la temperatura es un ejemplo de una propiedad intensiva.
Glosario
- cambio químico
- Cambio produciendo un tipo diferente de materia del tipo original de materia.
- propiedad química
- Comportamiento relacionado con el cambio de un tipo de materia a otro tipo de materia.
- propiedad extensiva
- Propiedad de una sustancia que depende de la cantidad de la sustancia.
- propiedad intensiva
- Propiedad de una sustancia que es independiente de la cantidad de la sustancia.
- cambio físico
- Cambio en el estado o propiedades de la materia que no implica un cambio en su composición química.
- propiedad física
- Característica de la materia que no está asociada con ningún cambio en su composición química.
Contributors and Attributions
Paul Flowers (Universidad de Carolina del Norte - Pembroke), Klaus Theopold (Universidad de Delaware) y Richard Langley (Stephen F. Austin Universidad del Estado) con autores contribuyentes. Contenido del libro de texto producido por la Universidad de OpenStax tiene licencia de Atribución de Creative Commons Licencia 4.0 licencia. Descarge gratis en http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110)."
Ana Martinez (amartinez02@saintmarys.edu) contribuyó a la traducción de este texto.


