2.4: Las fórmulas químicas
- Page ID
- 1805
habilidades para desarrollar
- Simbolizar la composición de moléculas usando fórmulas moleculares y fórmulas empíricas.
- Representar el arreglo del enlace de los átomos dentro de las moléculas usando fórmulas estructurales.
Una fórmula molecular es una representación de una molécula que usa símbolos químicos para indicar los tipos de átomos seguidos de subíndices para mostrar el número de átomos de cada tipo en la molécula. (Un subíndice se usa solo cuando está presente más de un átomo de un tipo). Las fórmulas moleculares también se usan como abreviaturas para los nombres de los compuestos.
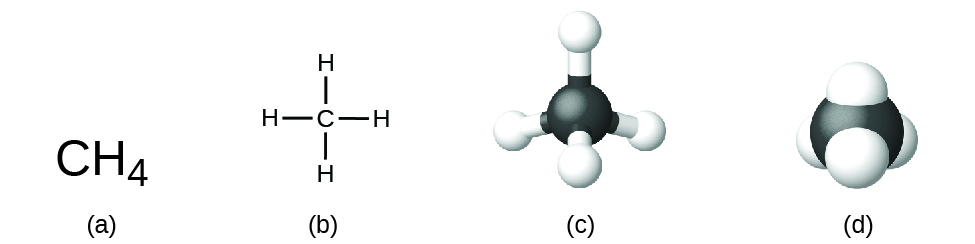
La fórmula estructural para un compuesto da la misma información que su fórmula molecular (los tipos y números de átomos en la molécula), pero también muestra cómo los átomos están conectados en la molécula. La fórmula estructural para el metano contiene símbolos para un átomo de C y cuatro átomos de H, que indican el número de átomos en la molécula (Figura \(\PageIndex{1}\)). Las líneas representan enlaces que unen a los átomos. (Un enlace químico es una atracción entre átomos o iones que los mantiene unidos en una molécula o en un cristal). Discutiremos los enlaces químicos y veremos cómo predicen los arreglos de los átomos en una molécula más adelante. Por ahora, simplemente sepa que las líneas indican cómo los átomos están conectados en una molécula. Un modelo de bola y palo muestra el arreglo geométrica de los átomos con tamaños atómicos no a escala, y un modelo de relleno de espacio que muestra los tamaños relativos de los átomos.
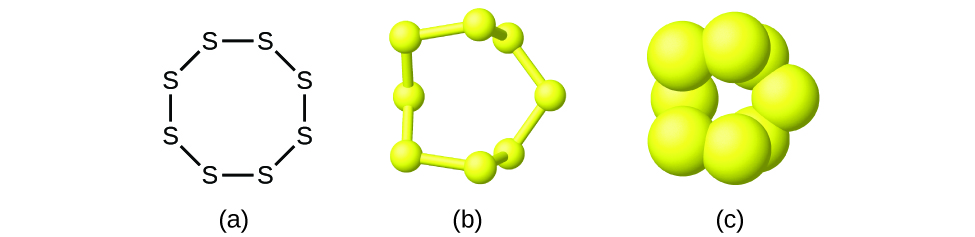
Aunque muchos elementos están formados por átomos individuales, algunos existen como moléculas formadas por dos o más átomo del elemento unidos juntos químicamente. Por ejemplo, la mayoría de las muestras de los elementos hidrógeno, oxígeno y nitrógeno están compuestas por moléculas que contienen dos átomos cada una (llamadas moléculas diatómicas) y, por lo tanto, tienen las fórmulas moleculares H2, O2 y N2, respectivamente. Otros elementos que se encuentran comúnmente como moléculas diatómicas son el flúor (F2), el cloro (Cl2), el bromo (Br2) y el yodo (I2). La forma más común del elemento azufre está compuesta por moléculas que constituyen de ocho átomos de azufre; su fórmula molecular es S8 (Figura \(\PageIndex{2}\)).
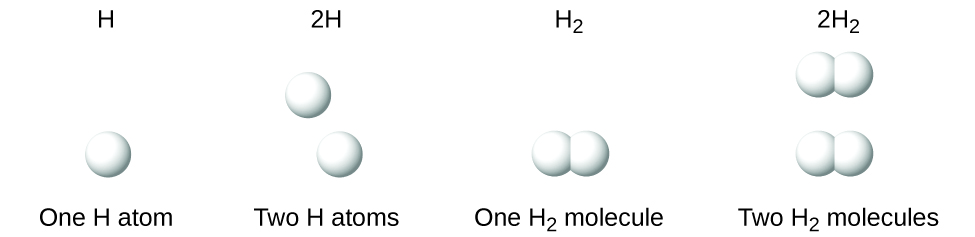
Es importante tener en cuenta que un subíndice que sigue un símbolo y un número adelante de un símbolo no representan la misma cosa; por ejemplo, H2 y 2H representan dos especies claramente diferentes. H2 es una fórmula molecular; representando una molécula diatómica de hidrógeno, que consiste en dos átomos del elemento que están unidos juntos químicamente. La expresión 2H, por el otro lado, indica dos átomos de hidrógeno separados, que no son una unidad. La expresión 2H2 representa dos moléculas de hidrógeno diatómico.(Figure \(\PageIndex{3}\)).
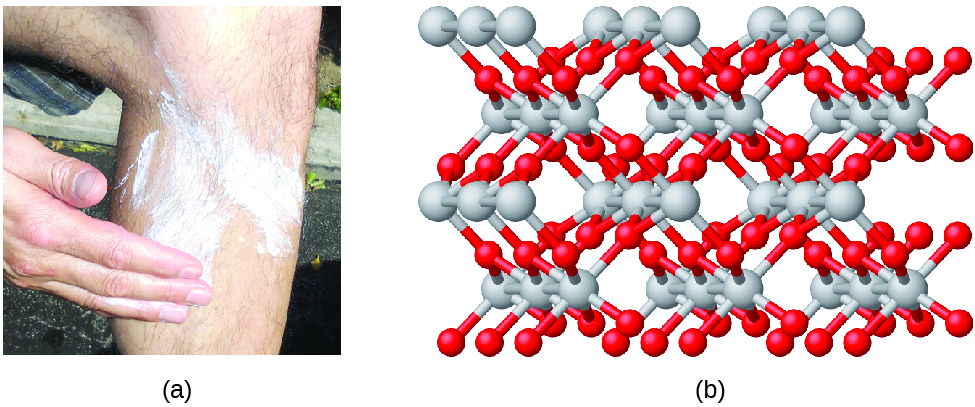
Los compuestos se forman cuando dos o más elementos se combinan químicamente, esto resulta en la formación de enlaces. Por ejemplo, el hidrógeno y el oxígeno pueden reaccionar para formar el agua, y el sodio y el cloro pueden reaccionar para formar la sal de mesa. Algunas veces describimos la composición de estos compuestos con una fórmula empírica, esta fórmula indica los tipos de átomos presentes y la proporción de números enteros más simple del número de átomos (o iones) en el compuesto. Por ejemplo, el dióxido de titanio (usado como pigmento en pintura blanca y en el protector solar de color blanco y grueso) tiene una fórmula empírica de TiO2 . Esto identifica los elementos titanio (Ti) y oxígeno (O) como los constituyentes del dióxido de titanio, y también indica la presencia de dos veces más átomos del elemento oxígeno que átomos del elemento titanio. (Figura \(\PageIndex{4}\)).
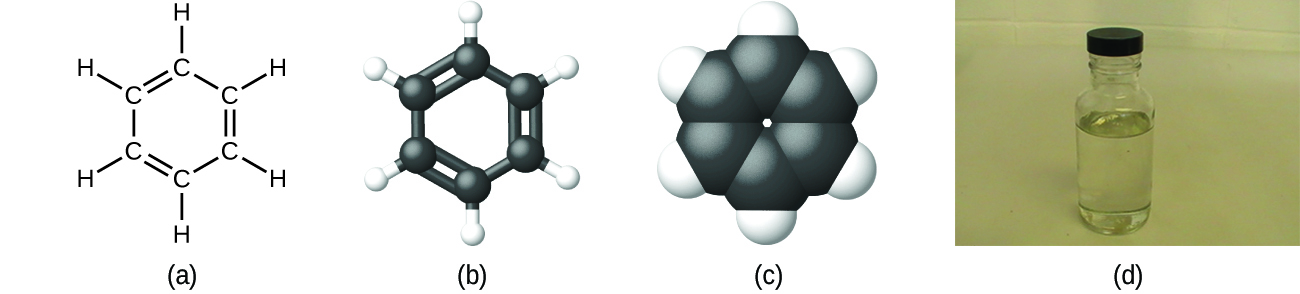
Como se discutió anteriormente, podemos describir un compuesto con una fórmula molecular, en esta fórmula, los subíndices indican el número real de átomos de cada elemento en una molécula del compuesto. En muchos casos, la fórmula molecular de una sustancia se derive de la determinación experimental de su fórmula empírica y su masa molecular (la suma de las masas atómicas para todos los átomos que componen la molécula). Por ejemplo, se puede determinar experimentalmente que el benceno contiene dos elementos, el carbono (C) y el hidrógeno (H), y que, por cada átomo de carbono en el benceno, hay un átomo de hidrógeno. Así, la fórmula empírica es CH. Una determinación experimental de la masa molecular revela que una molécula de benceno contiene seis átomos de carbono y seis átomos de hidrógeno, por eso la fórmula molecular para el benceno es C6H6 (Figura \(\PageIndex{5}\)).
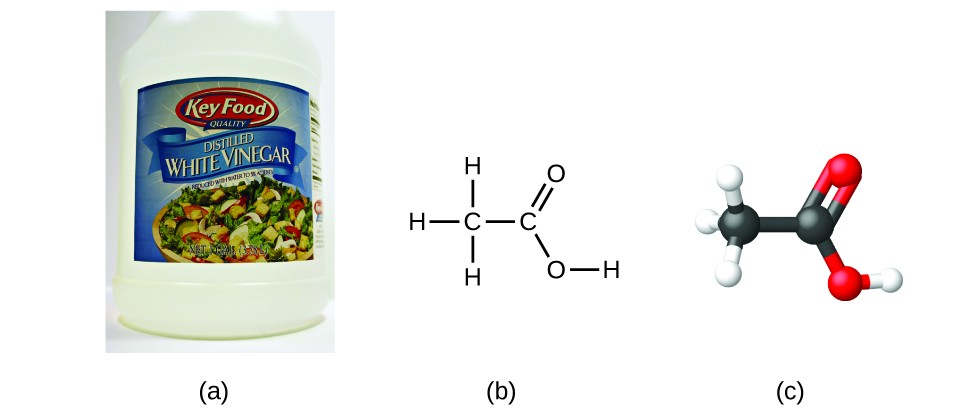
Si sabemos la fórmula de un compuesto, podemos fácilmente determinar la fórmula empírica. (Esto es como un ejercicio académico; la cronología inversa generalmente se sigue en la práctica real). Por ejemplo, la fórmula molecular para el ácido acético, el componente que le da al vinagre su sabor intenso, es C2H4O2. Esta fórmula indica que una molécula de ácido acético (Figura \(\PageIndex{6}\)) contiene dos átomos de carbono, cuatro átomos de hidrógeno, y dos átomos de oxígeno. La proporción de átomos es 2:4:2. Dividiendo por el común denominador más pequeño (2) da la relación más simple de números enteros de átomos, 1:2:1, por eso la fórmula empírica es CH2O. Tenga en cuenta que una fórmula molecular es siempre un múltiplo entero de una fórmula empírica.
Ejemplo \(\PageIndex{1}\): FÓRMULAS EMPÍRICAS Y MOLECULARES
Las moléculas de glucosa (azúcar en la sangre) contienen 6 átomos de carbono, 12 átomos de hidrógeno y 6 átomos de oxígeno. ¿Cuáles son las fórmulas moleculares y empíricas de la glucosa?
Solución
La fórmula molecular es C6H12O6 porque en realidad una molécula contiene 6 átomos de carbono, 12 H, y 6 O. La proporción más simple de números enteros de C a H a O en la glucosa es 1: 2: 1, por eso la fórmula empírica es C2HO.
Ejercicio \(\PageIndex{1}\)
Una molécula de metaldehído (un pesticida usado para caracoles y babosas) contiene 8 átomos de carbono, 16 átomos de hidrógeno y 4 átomos de oxígeno. ¿Cuáles son las fórmulas moleculares y empíricas del metaldehído?
- Respuesta
-
fórmula molecular, C8H16O4; fórmula empírica, C2H4O
Es importante tener en cuenta que puede ser posible que los mismos átomos estén arreglados en diferentes maneras: los compuestos con la misma fórmula molecular pueden tener diferentes enlaces de átomo a átomo y estructuras diferentes. Por ejemplo, ¿Podría haber otro compuesto con la misma fórmula que el ácido acético, C2H4O2? Y si es verdad, ¿Cuál sería la estructura de sus moléculas?
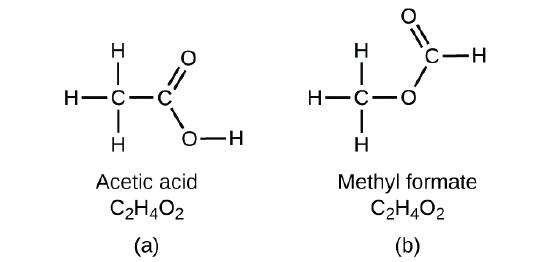
Si usted predice que podría existir otro compuesto con la fórmula C2H4O2, entonces demostró una buena comprensión química y es correcto. También se pueden organizar dos átomos de C, cuatro átomos de H y dos átomos de O para formar formiato de metilo, que se usa en la fabricación, como insecticida y para acabados de secado rápido. Las moléculas de formiato de metilo tienen uno de los átomos de oxígeno entre los dos átomos de carbono, esto es diferente del arreglo de las moléculas de ácido acético. El ácido acético y el formiato de metilo son ejemplos de isómeros: compuestos con la misma fórmula química pero diferentes estructuras moleculares (Figura \(\PageIndex{7}\)). Tenga en cuenta que esta pequeña diferencia en la disposición de los átomos tiene un efecto importante en sus respectivas propiedades químicas. Seguramente no querrá usar una solución de formiato de metilo como sustituto de una solución de ácido acético (vinagre) cuando prepare el aderezo para ensaladas.
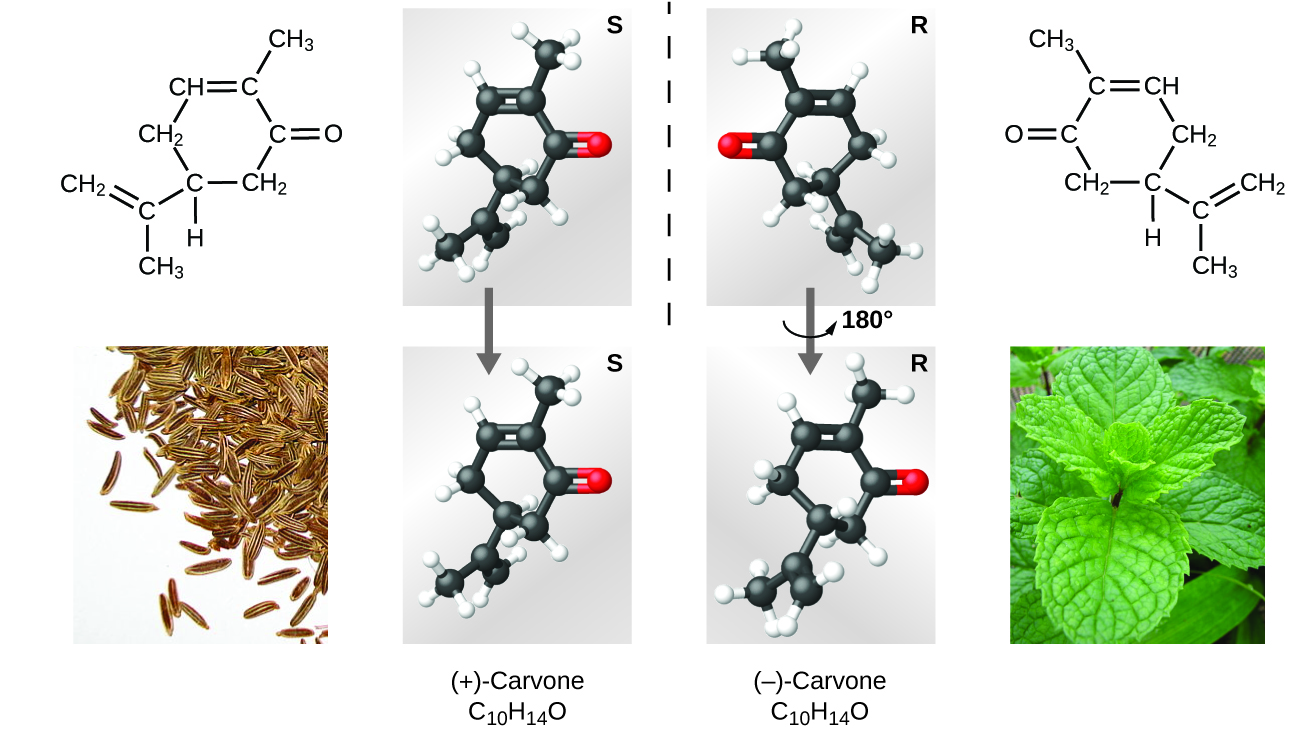
Existen muchos tipos de isómeros (Figura \(\PageIndex{8}\)). El ácido acético y el formiato de metilo son isómeros estructurales, compuestos que tienen las moléculas en diferentes formas y los átomos están conectados diferentemente. También hay varios tipos de isómeros espaciales, las orientaciones relativas de los átomos en el espacio pueden ser diferentes. Por ejemplo, el compuesto carvona (que se encuentra en las semillas de alcaravea, la menta verde y las cáscaras de naranja mandarina) consiste en dos isómeros que son imágenes especulares entre sí. La carvona S -(+) huele a alcaravea, y la carvona R -(-) huele a menta verde.
Resumen
Una fórmula molecular usa símbolos químicos y subíndices para indicar los números exactos de diferentes átomos en una molécula o compuesto. Una fórmula empírica da la proporción más simple de números enteros de átomos en un compuesto. Una fórmula estructural indica el arreglo de enlace de los átomos en la molécula. Los modelos de bola y palo, y de relleno de espacio muestran el arreglo geométrico de los átomos en una molécula. Los isómeros son compuestos con la misma fórmula molecular pero diferentes arreglos de átomos.
Glosario
- formula empírica
- fórmula que muestra la composición de un compuesto como la proporción más simple de átomos enteros
- isómeros
- Compuestos con la misma fórmula química pero diferentes estructuras.
- fórmula molecular
- fórmula que indica la composición de una molécula de un compuesto y da el número real de átomos de cada elemento en una molécula del compuesto.
- isómeros espaciales
- Compuestos en los que las orientaciones relativas de los átomos en el espacio son diferentes.
- isómero estructural
- una de las dos sustancias que tienen la misma fórmula molecular pero diferentes propiedades físicas y químicas porque sus átomos están unidos en una manera diferente
- fórmula estructural
- Muestra los átomos en una molécula y cómo están conectados.
Contribuyentes
Paul Flowers (Universidad de Carolina del Norte - Pembroke), Klaus Theopold (Universidad de Delaware) y Richard Langley (Stephen F. Austin Universidad del Estado) con autores contribuyentes. Contenido del libro de texto producido por la Universidad de OpenStax tiene licencia de Atribución de Creative Commons Licencia 4.0 licencia. Descarge gratis en http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110)."
Ana Martinez (amartinez02@saintmarys.edu) contribuyó a la traducción de este texto.


