2.5: La tabla periodica
- Page ID
- 1806
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)habilidades para desarrollar
- Indique la ley periódica y explique la organización de los elementos en la tabla periódica.
- Predice las propiedades generales de los elementos basado en sus ubicaciones dentro de la tabla periódica
- Identifique metales, no metales y metaloides por sus propiedades y / o ubicación en la tabla periódica
Cuando los primeros químicos trabajaron para purificar minerales y descubrieron más elementos, se dieron cuenta de que varios elementos podían agruparse por sus comportamientos químicos similares. Uno de estos grupos incluye el litio (Li), el sodio (Na) y el potasio (K): todos estos elementos son brillantes, conducen bien el calor y la electricidad, y tienen propiedades químicas similares. Un segundo grupo incluye el calcio (Ca), el estroncio (Sr) y el bario (Ba), estos elementos también son brillantes, buenos conductores del calor y la electricidad, y tienen propiedades químicas en común. Sin embargo, las propiedades específicas de estos dos grupos son notablemente diferentes de uno al otro. Por ejemplo: Li, Na, y K son mucho más reactivos que el Ca, Sr y Ba; Li, Na y K forman compuestos con oxígeno en una relación de dos de sus átomos a un átomo de oxígeno, mientras que el Ca, Sr y Ba forman compuestos con uno de sus átomos y con un átomo de oxígeno. El flúor (F), el cloro (Cl), el bromo (Br), y el yodo (I) también exhiben propiedades similares entre sí, pero estas propiedades son drásticamente diferentes de las de los elementos anteriores.
En Rusia, Dimitri Mendeleev (1869) y Lothar Meyer en Alemania (1870) reconocieron independientemente que existía una relación periódica entre las propiedades de los elementos conocidos en ese momento. Ambas tablas publicadas con los elementos arreglados de acuerdo con el aumento de la masa atómica. Pero Mendeleev tomo un paso más que Meyer: usó su tabla para predecir la existencia de elementos que tendrían propiedades similares al aluminio y al silicio, pero que aún no se conocían. Los descubrimientos de galio (1875) y germanio (1886) brindaron un gran apoyo al trabajo de Mendeleev. Aunque Mendeleev y Meyer tuvieron una larga disputa sobre la prioridad, las contribuciones de Mendeleev al desarrollo de la tabla periódica ahora son más reconocidas (Figura \(\PageIndex{1}\)).

En el siglo veinte, se hizo evidente que la relación periódica involucraba números atómicos en lugar de masas atómicas. La declaración moderna de esta relación, la ley periódica, es la siguiente: las propiedades de los elementos son funciones periódicas de sus números atómicos. Una tabla periódica moderna organiza los elementos en orden creciente de sus números atómicos y agrupa los átomos con propiedades similares en la misma columna vertical (Figura \(\PageIndex{2}\)). Cada caja representa un elemento y contiene su número atómico, símbolo, masa atómica promedio y (a veces) su nombre. Los elementos están organizados en siete filas horizontales, llamadas períodos o series, y 18 columnas verticales, llamadas grupos. Los grupos están etiquetados en la parte superior de cada columna. En los Estados Unidos, las etiquetas tradicionalmente son números con letras mayúsculas. Sin embargo, IUPAC recomienda que se utilicen los números del 1 al 18, y estas etiquetas son más comunes. Para que la tabla se ajuste a una sola página, las partes de dos de las filas, un total de 14 columnas, generalmente se escriben debajo de la parte principal de la tabla.
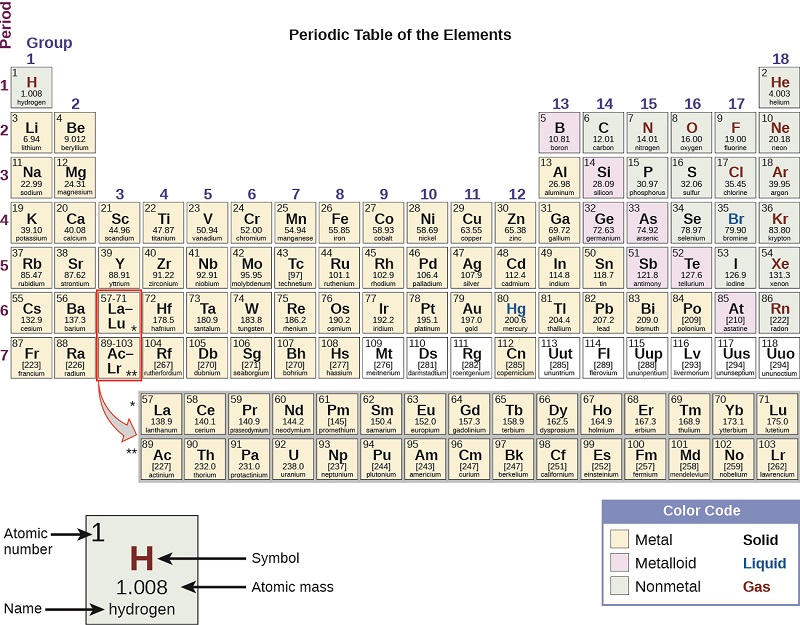
Muchos elementos difieren dramáticamente en sus propiedades químicas y físicas, pero algunos elementos son similares en sus comportamientos. Por ejemplo, muchos elementos aparecen brillantes, son maleables (se pueden deformar sin romperse) y dúctiles (se pueden hacer a cables) y conducen bien el calor y la electricidad. Otros elementos no son brillantes, maleables o dúctiles, y son malos conductores del calor y la electricidad. Podemos clasificar los elementos en clases grandes con propiedades comunes: los metales (elementos que son brillantes, maleables, buenos conductores de calor y electricidad: amarillo sombreado); los no metales (elementos que parecen opacos, malos conductores de calor y electricidad, verde sombreado); y los metaloides (elementos que conducen el calor y la electricidad moderadamente bien, y poseen algunas propiedades de los metales y algunas propiedades de los no metales: púrpura sombreada).
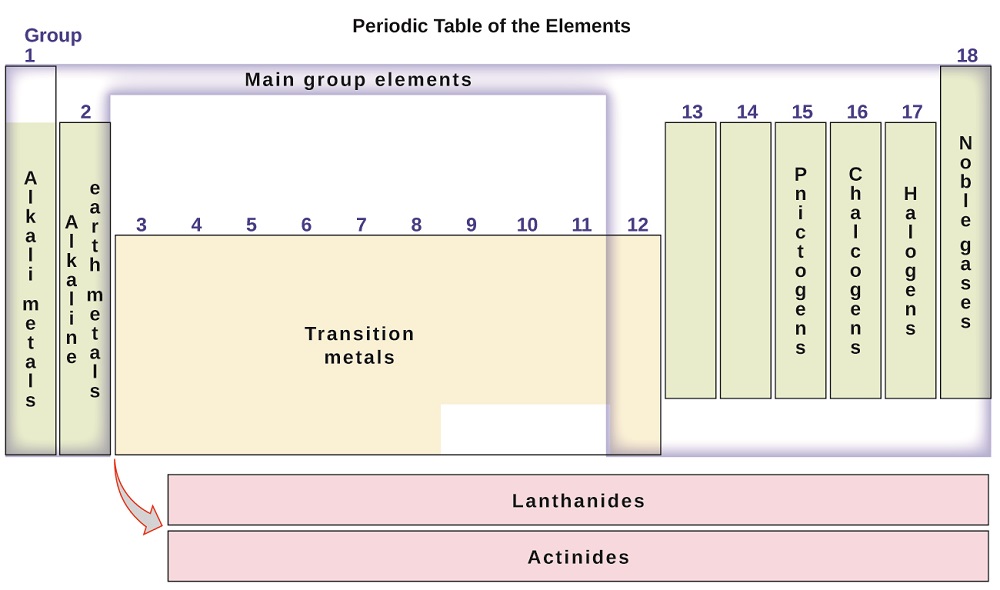
Los elementos también se pueden clasificar como los elementos del grupo principal (o elementos representativos) en las columnas etiquetadas 1, 2 y 13–18; los metales de transición en las columnas etiquetadas 3–12; y los metales de transición interna en las dos filas en la parte inferior de la tabla (los elementos de la fila superior se llaman lantánidos y los elementos de la fila inferior son actínidos; Figura \(\PageIndex{3}\)). Los elementos se pueden subdividir aún más por propiedades más específicas, como la composición de los compuestos que forman. Por ejemplo, los elementos del grupo 1 (la primera columna) forman compuestos que consisten en un átomo del elemento y un átomo de hidrógeno. Estos elementos (excepto el hidrógeno) se conocen como metales alcalinos y todos tienen propiedades químicas similares. Los elementos del grupo 2 (la segunda columna) forman compuestos que consisten en un átomo del elemento y dos átomos de hidrógeno: estos se llaman metales alcalinotérreos, con propiedades similares entre los miembros de ese grupo. Otros grupos con nombres específicos son los pnictógenos (grupo 15), los calcógenos (grupo 16), los halógenos (grupo 17) y los gases nobles (grupo 18, también conocidos como los gases inertes). El primer elemento del grupo también puede hacer referencia a los grupos: por ejemplo, los calcógenos se pueden llamar el grupo de oxígeno o familia de oxígeno. El hidrógeno es un elemento único, no metálico, con propiedades similares a los elementos del grupo 1 y del grupo 17. Por esa razón, el hidrógeno se puede mostrar en la parte superior de ambos grupos, o solo.
Ejemplo \(\PageIndex{1}\): NOMBRANDO GRUPOS DE ELEMENTOS
Los átomos de cada uno de los siguientes elementos son esenciales para la vida. Dé el nombre del grupo para los siguientes elementos:
- cloro
- calcio
- sodio
- azufre
Solución
Los nombres de las familia son:
- halógeno
- metal alcalinotérreo
- metal alcalino
- calcógeno
EJercicio \(\PageIndex{1}\)
Dé el nombre del grupo para cada uno de los siguientes elementos:
- criptón
- selenio
- barrio
- litio
- Respuesta a
-
gas noble
- Respuesta b
-
calcógeno
- Respuesta c
-
metal alcalinotérreo
- Respuesta d
-
metal alcalino
Al estudiar la tabla periódica, es posible que hayas notado algo de las masas atómicas de algunos de los elementos. El elemento 43 (tecnecio), el elemento 61 (prometio) y la mayoría de los elementos con números atómicos más altos que 84 (polonio) dados entre corchetes. Esto se hace para los elementos que consisten completamente en isótopos radiactivos inestables (aprenderá más sobre la radiactividad en el capítulo de química nuclear). No se puede determinar un peso atómico promedio para estos elementos porque sus radioisótopos pueden variar significativamente en abundancia relativa, dependiendo de la fuente, o incluso pueden no existir en la naturaleza. El número entre corchetes es el número de masa atómica (y la masa atómica aproximada) del isótopo más estable de ese elemento.
Resumen
El descubrimiento de la recurrencia periódica de las propiedades similares entre los elementos llevo a la formulación de la tabla periódica, en la cual los elementos se organizan en orden creciente de número atómico en filas conocidas como períodos y columnas conocidas como grupos. Los elementos en el mismo grupo de la tabla periódica tienen propiedades químicas similares. Los elementos se pueden clasificar como metales, metaloides y no metales, o como elementos del grupo principal, los metales de transición y los metales de transición internos. Los grupos están numerados del 1 al 18 de izquierda a derecha. Los elementos en el grupo 1 son conocidos como los metales alcalinos; los del grupo 2 son los metales alcalinotérreos; los de 15 son los pnictógenos; los de 16 son los calcógenos; los de 17 son los halógenos; y los de 18 son los gases nobles.
Glosario
- actinida
- Metal de transición interior en la parte inferior de las dos filas inferiores de la tabla periódica.
- metal alcalino
- Elemento en el grupo 1.
- metal alcalinotérreo
- Elemento en el grupo 2.
- calcógeno
- Element en el grupo 16.
- grupo
- Columna vertical de la tabla periódica.
- halógeno
- Elemento en grupo 17.
- gas inerte
- Elemento (también, gas noble) en el grupo 18.
- metal de transición interior
- (también, lantánido o actínido) Elemento en las dos filas inferiores; si está en la primera fila, también se llama lantánido, o si está en la segunda fila, también se llama actínido.
- lantánido
- Metal de transición interior en la parte superior de las dos filas inferiores de la tabla periódica.
- elemento del grupo principal
- (también, elemento representativo) Elemento en las columnas 1, 2 y 12-18.
- metal
- Elemento brillante, maleable, buen conductor de calor y electricidad.
- metaloide
- Elemento que conduce el calor y la electricidad moderadamente bien, y posee algunas propiedades de los metales y algunas propiedades de los no metales.
- gas noble
- Elemento (también, gas inerte) en el grupo 18.
- no metal
- Elemento que aparece opaco, mal conductor de calor y electricidad.
- período
- (también, serie) Fila horizontal de la tabla periódica.
- ley periódica
-
Las propiedades de los elementos son función periódica de sus números atómicos.
- tabla periódica
- Tabla de los elementos que colocan elementos con propiedades químicas similares muy juntos.
- pnictogen
- Element en el grupo 15.
- elemento representativo
- (también, elemento del grupo principal) Elemento en las columnas 1, 2 y 12–18.
- metal de transición
- Elemento en las columnas 3–11.
- serie
- (también, período) Fila horizontal de la tabla de períodos.
Contribuyentes
Paul Flowers (Universidad de Carolina del Norte - Pembroke), Klaus Theopold (Universidad de Delaware) y Richard Langley (Stephen F. Austin Universidad del Estado) con autores contribuyentes. Contenido del libro de texto producido por la Universidad de OpenStax tiene licencia de Atribución de Creative Commons Licencia 4.0 licencia. Descarge gratis en http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110)."
Ana Martinez (amartinez02@saintmarys.edu) contribuyó a la traducción de este texto.


