2.E: Los átomos, moléculas e iones (ejercicios)
( \newcommand{\kernel}{\mathrm{null}\,}\)
Template:MapOpenSTAXSpanishSpanish
2.1: Ideas Tempranas en la Teoría Atómica
En el siguiente dibujo, las esferas verdes representan átomos de un determinado elemento. Las esferas azules representan átomos de otro elemento. Si las esferas de diferentes elementos se tocan, son parte de una sola unidad de un compuesto. El siguiente cambio químico representado por estas esferas puede violar una de las ideas de la teoría atómica de Dalton. ¿Cúal?
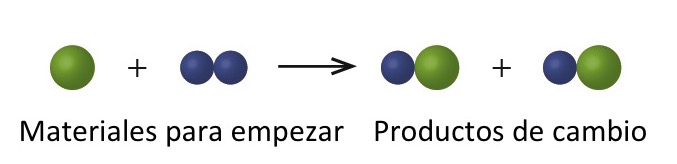
Los materiales de empiezo consisten en una esfera verde y dos esferas azules. Los productos consisten en dos esferas verdes y dos esferas azules. Esto viola el postulado de Dalton de que los átomos no se crean durante un cambio químico, sino que simplemente se redistribuyen.
¿Qué postulado de la teoría de Dalton es consistente con la siguiente observación con respecto a los pesos de los reactivos y productos? Cuando se calientan 100 gramos de carbonato de calcio sólido, se producen 44 gramos de dióxido de carbono y 56 gramos de óxido de calcio.
Identifique el postulado de la teoría de Dalton que es violado por las siguientes observaciones: 59,95% de una muestra de dióxido de titanio es titanio; El 60,10% de una muestra diferente de dióxido de titanio es titanio.
Esta declaración viola el cuarto postulado de Dalton: en un compuesto dado, los números de átomos de cada tipo (y por lo tanto también el porcentaje) siempre tienen la misma proporción.
Las muestras del compuesto X, Y y Z se analizan, con los resultados que se muestran aquí.
| Compuesto | Descripción | Masa de Carbón | Masa de Hidrógeno |
|---|---|---|---|
| X | Líquido claro, sin color, con fuerte olor. | 1,776 g | 0.148 g |
| Y | Líquido claro, sin color, con fuerte olor. | 1,974 g | 0.329 g |
| Z | Líquido claro, sin color, con fuerte olor. | 7,812 g | 0.651 g |
¿Estos datos dan ejemplo(s) de la ley de proporciones definidas, la ley de proporciones múltiples, de ninguna o de ambas? ¿Qué le dicen estos datos sobre los compuestos X, Y y Z?
2.2: Evolución de la Teoría Atómica
Ejercicios
- La existencia de isótopos viola una de las ideas originales de la teoría atómica de Dalton. ¿Cúal?
- ¿En qué se parecen los electrones y los protones? ¿En qué se diferencian?
- ¿En qué se parecen los protones y los neutrones? ¿En qué se diferencian?
- Prediga y pruebe el comportamiento de las partículas α disparadas contra un átomo modelo de "pudín de ciruela".
- Prediga los caminos que toman las partículas α que se disparan a los átomos con la estructura del modelo de pudín de ciruelas de Thomson. Explique por qué espera que las partículas α tomen estos caminos.
- Si las partículas α de mayor energía que las de (a) se disparan contra átomos de pudín de ciruela, prediga cómo sus trayectorias diferirán de las trayectorias de partículas α de menor energía. Explique su razonamiento.
- Ahora pruebe sus predicciones de (a) y (b). Abra la simulación de dispersión de Rutherford y seleccione la pestaña "Plum Pudding Atom". Establezca "Energía de partículas alfa" en "min" y seleccione " show traces ". Haga clic en el arma para comenzar a disparar partículas α. ¿Coincide esto con su predicción de (a)? Si no, explique por qué la ruta real sería la que se muestra en la simulación. Presione el botón de pausa, o " Reset All". Ajuste "Energía de partículas alfa" a "max" y comience a disparar partículas α. ¿Coincide esto con su predicción de (b)? Si no, explique el efecto del aumento de energía en las rutas reales como se muestra en la simulación.
- Prediga y pruebe el comportamiento de las partículas α disparadas en un modelo de átomo de Rutherford.
- (a) Prediga los caminos que toman las partículas α que se disparan a los átomos con una estructura de modelo de átomo de Rutherford. Explique por qué espera que las partículas α tomen estos caminos.
- (b) Si las partículas α de mayor energía que las de (a) se disparan contra los átomos de Rutherford, prediga cómo sus trayectorias diferirán de las trayectorias de partículas α de menor energía. Explique su razonamiento.
- (c) Prediga cómo los caminos que tomarán las partículas α diferirán si se disparan a átomos de Rutherford de elementos distintos del oro. ¿Qué factor espera que cause esta diferencia en los caminos y por qué?
- (d) Ahora pruebe sus predicciones de (a), (b) y (c). Abra la simulación de dispersión de Rutherford y seleccione la pestaña "Rutherford Atom". Debido a la escala de la simulación, es mejor comenzar con un núcleo pequeño, así que seleccione "20" para los protones y los neutrones, "min" para la energía, muestre los rastros y luego comience a disparar partículas α. ¿Coincide esto con su predicción de (a)? Si no, explique por qué la ruta real sería la que se muestra en la simulación. Haga una pausa o reinicie, establezca la energía en "max" y comience a disparar partículas α. ¿Coincide esto con su predicción de (b)? Si no, explique el efecto del aumento de energía en la ruta real como se muestra en la simulación. Haga una pausa o reinicie, seleccione "40" para los protones y los neutrones, "min" para la energía, muestre las huellas y dispare. ¿Esto coincide con su predicción de (c)? Si no, explique por qué la ruta real sería la que se muestra en la simulación. Repita esto con un mayor número de protones y neutrones. ¿Qué generalización puede hacer con respecto al tipo de átomo y el efecto en el camino de las partículas α? Sea claro y específico en su respuesta.
Soluciones
1 Dalton originalmente pensó que todos los átomos de un elemento particular tenían propiedades idénticas, incluyendo la masa. Por lo tanto, el concepto de isótopos, en el que un elemento tiene masas diferentes, fue una violación de la idea original. Para explicar la existencia de isótopos, el segundo postulado de su teoría atómica se modificó para establecer que los átomos del mismo elemento deben tener propiedades químicas idénticas.
2 Ambas son partículas subatómicas que residen en el núcleo de un átomo. Ambos tienen aproximadamente la misma masa. Los protones están cargados positivamente, mientras que los neutrones no tienen carga.3 Ambas son partículas subatómicas que residen en el núcleo de un átomo. Ambos tienen aproximadamente la misma masa. Los protones están cargados positivamente, mientras que los neutrones no tienen carga.
4. (a) El modelo de pudín de ciruela indica que la carga positiva se distribuye uniformemente por todo el átomo, por eso esperamos que las partículas α (tal vez) se reduzcan un poco por la repulsión positiva-positiva, pero que sigan caminos en línea recta (es decir, para no ser desviados) a medida que pasan a través de los átomos. (b) Las partículas α de mayor energía viajarán más rápido (y quizás disminuyan su velocidad) y también seguirán caminos de línea recta a través de los átomos. (c) Las partículas α siguieron líneas rectas a través del átomo de pudín de ciruela. No hubo una disminución aparente de las partículas α a medida que pasaban a través de los átomos.
5. (a) El átomo de Rutherford tiene un núcleo pequeño, cargado positivamente, por eso la mayoría de las partículas α pasarán a través del espacio vacío lejos del núcleo y no se desviarán. Las partículas α que pasan cerca del núcleo se desviarán de sus caminos debido a la repulsión positiva-positiva. Lo más directamente hacia el núcleo que se dirijan las partículas α, el ángulo de desviación será más grande. (b) Las partículas α de mayor energía que pasan cerca del núcleo seguirán siendo desviadas, pero los más rápido que viajen, el ángulo de desviación será más menos que lo esperado. (c) Si el núcleo es más pequeño, la carga positiva es más pequeña y las deflexiones esperadas son más pequeñas, tanto en términos de que cerca las partículas α pasan por el núcleo sin desviarse como el ángulo de desviación. Si el núcleo es más grande, la carga positiva es más grande y las deflexiones esperadas son más grandes: se desviarán más partículas α y los ángulos de desviación serán más grandes. (d) Las rutas seguidas por las partículas α coinciden con las predicciones de (a), (b) y (c).
2.3: La Estructura Atómica y el Simbolismo
¿De qué manera los isótopos de un elemento dado son siempre diferentes? ¿De qué manera(s) son siempre iguales?
Escriba el símbolo para cada uno de los siguientes iones:
- (a) el ión con una carga de 1+, el número atómico 55 y el número de masa 133
- (b) el ion con 54 electrones, 53 protones, y 74 neutrones
- (c) el ion con número atómico 15, número de masa 31 y una carga de 3
- (d) el ion con 24 electrones, 30 neutrones y una carga de 3+
(a) 133Cs+; (b) 127I−; (c) 31P3−; (d) 57Co3+
Escriba el símbolo para cada uno de los siguientes iones:
- (a) el ion con una carga de 3+, 28 electrones y un número de masa de 71
- (b) el ion con 36 electrones, 35 protones, y 45 neutrones
- (c) el ion con 86 electrones, 142 neutrones y una carga de 4+
- (d) el ion con una carga de 2+, número atómico 38 y número de masa 87
Abra la simulación construir un átomo y haga clic en el icono del átomo.
- (a) Elija cualquiera de los primeros 10 elementos que le gustaría construir e indique su símbolo.
- (b) Arrastre protones, neutrones, y electrones a la plantilla del átomo para formar un átomo de su elemento. Indique el número de protones, neutrones, y electrones en su átomo, también indique la carga neta y el número de masa.
- (c) Haga clic en "Carga neta" y "Número de masa", verifique sus respuestas en (b) y corrija, si es necesario.
- (d) Prediga si su átomo será estable o inestable. Indique su razonamiento.
- (e) Marque la casilla "Estable / Inestable". ¿Fue correcta su respuesta a (d)? Si no es así, primero prediga lo que pueda hacer para hacer un átomo estable de su elemento, y luego haga lo y vea si funciona. Explique su razonamiento.
(a) Carbono-12, 12C; (b) Este átomo contiene seis protones y seis neutrones. Hay seis electrones en un átomo neutro de 12C. La carga neta de dicho átomo neutro es cero y el número de masa es 12. (c) Las respuestas anteriores son correctas. (d) El átomo será estable ya que C-12 es un isótopo estable de carbono. (e) La respuesta anterior es correcta. Otras respuestas para este ejercicio son posibles si se elige un elemento diferente del isótopo.
Abra la simulación construir un átomo
(a) Arrastre protones, neutrones, y electrones a la plantilla del átomo para crear un átomo neutro de Oxígeno-16 y dé el símbolo isotópico para este átomo.
(b) Ahora agregue dos electrones más para formar un ion y dé el símbolo para el ion que ha hecho.
Abra la simulación construir un átomo
(a) Arrastre protones, neutrones, y electrones a la plantilla del átomo para hacer un átomo neutro de Litio-6 y dé el símbolo de isótopo para este átomo.
(b) Ahora quite un electrón para formar un ion y dé el símbolo del ion que ha hecho.
(a) El litio-6 contiene tres protones, tres neutrones, y tres electrones. El símbolo del isótopo es 6Li o Li63. (b) 6Li+ o Li+63
Determine la cantidad de protones, neutrones, y electrones en los siguientes isótopos que se usan en los diagnósticos médicos:
(a) número atómico 9, número de masa 18, carga de 1−
(b) número atómico 43, número de masa 99, carga de 7+
(c) número atómico 53, número de masa atómica 131, carga de 1−
(d) número atómico 81, número de masa atómica 201, carga de 1+
(e) Nombre los elementos en las partes (a), (b), (c) y (d).
Las siguientes son propiedades de los isótopos de dos elementos que son esenciales en nuestra dieta.Determine el número de protones, neutrones y electrones en cada uno y nómbrelos.
(a) número atómico 26, número de masa 58, carga de 2+
(b) número atómico 53, número de masa 127, carga de 1−
(a) Hierro, 26 protones, 24 electrones y 32 neutrones; (b) yodo, 53 protones, 54 electrones y 74 neutrones
Indique el número de protones, electrones y neutrones en los átomos neutros de cada uno de los siguientes isótopos:
(a) B105
(b) Hg19980
(c) Cu6329
(d) C136
(e) Se7734
Indique el número de protones, electrones y neutrones en los átomos neutros de cada uno de los siguientes isótopos:
(a) Li73
(b) Te12552
(c) Ag10947
(d) N157
(e) P3115
(a) 3 protones, 3 electrones, 4 neutrones; (b) 52 protones, 52 electrones, 73 neutrones; (c) 47 protones, 47 electrones, 62 neutrones; (d) 7 protones, 7 electrones, 8 neutrones; (e) 15 protones, 15 electrones, 16 neutrones
Haga clic en el sitio y seleccione la pestaña "mezclar isótopos", oculte los cuadros "composición porcentual" y "masa atómica promedio", y luego seleccione el elemento boro.
(a) Escriba los símbolos de los isótopos del boro que se muestran como naturales en cantidades significativas.
(b) Prediga las cantidades relativas (porcentajes) de estos isótopos de boro que se encuentran en la naturaleza. Explique el razonamiento detrás de su elección.
(c) Agregue isótopos a la caja negra para hacer una mezcla que coincida con su predicción en (b). Puede arrastrar isótopos desde sus bandejas o hacer clic en "Más" y luego mover los controles deslizantes a las cantidades adecuadas.
(d) Revele las casillas "Composición porcentual" y "Masa atómica promedio". ¿Qué tan bien coincide su mezcla con su predicción? Si es necesario, ajuste las cantidades de isótopos para que coincidan con su predicción.
(e) Seleccione la mezcla de isótopos de la "Naturaleza" y compárela con su predicción. ¿Qué tan bien se compara su predicción con la mezcla natural? Explique. Si es necesario, ajuste sus cantidades para que coincidan con las cantidades de "Naturaleza" lo más cerca posible.
Repita el ejercicio usando un elemento que tenga tres isótopos naturales.
Usemos el neón como ejemplo. El neón tiene tres isótopos y no hay manera de asegurarse de predecir con precisión las abundancias para hacer un total de 20.18 amu de masa atómica promedio. Supongamos que las abundancias son 9% Ne-22, 91% Ne-20 y solo un rastro de Ne-21. La masa promedio sería de 20.18 amu. La comprobación de la mezcla natural de isótopos muestra que las abundancias son 90.48% Ne-20, 9.25% Ne-22 y 0.27% Ne-21, por eso nuestras cantidades estimadas deben ajustarse un poco.
Un elemento tiene las siguientes abundancias naturales y masas isotópicas: 90,92% de abundancia con 19,99 amu, 0,26% de abundancia con 20,99 amu y 8,82% de abundancia con 21,99 amu. Calcule la masa atómica promedio de este elemento.
Las masas atómicas promedio enumeradas por IUPAC se basan en un estudio de resultados experimentales. El bromo tiene dos isótopos 79Br y 81Br, cuyas masas (78.9183 y 80.9163 amu) y abundancias (50.69% y 49.31%) se determinaron en experimentos anteriores. Calcule la masa atómica promedio de bromo basándose en estos experimentos.
79.904 amu
Se pueden observar variaciones en la masa atómica promedio para elementos obtenidos de diferentes fuentes. El litio es un ejemplo de esto. La composición isotópica del litio a partir de minerales naturales es 7,5% 6Li y 92,5% 7Li, que tienen masas de 6,01512 amu y 7,01600 amu, respectivamente. Una fuente comercial de litio, reciclada de una fuente militar, fue de 3,75% 6Li (y el resto 7Li). Calcule los valores promedio de masa atómica para cada una de estas dos fuentes.
Las masas atómicas promedio de algunos elementos pueden variar, dependiendo de las fuentes de sus minerales. El boro natural consiste en dos isótopos con masas conocidas con precisión (10B, 10,0129 amu y 11B, 11,0931 amu). La masa atómica real del boro puede variar de 10,807 a 10,819, dependiendo de si la fuente mineral es de Turquía o Estados Unidos. Calcule el porcentaje de abundancia que conduce a los dos valores de las masas atómicas promedio de boro de estos dos países.
Fuente de Turquía: 0,2649 (de 10,0129 isótopo amu); Fuente estadounidense: 0,2537 (de 10,0129 isótopo amu)
La relación de abundancia de 18O: 16O en algunos meteoritos es más que la que se usa para calcular la masa atómica promedio de oxígeno en la tierra. ¿Es la masa promedio de un átomo de oxígeno en estos meteoritos más que, menos, o igual a la de un átomo de oxígeno terrestre?
2.4: Fórmulas Químicas
Explique por qué el símbolo para un átomo del elemento oxígeno y la fórmula para una molécula de oxígeno son diferentes.
El símbolo para el elemento oxígeno, O, representa tanto el elemento como un átomo de oxígeno. Una molécula de oxígeno, O2, contiene dos átomos de oxígeno; El subíndice 2 en la fórmula se debe usar para distinguir la molécula diatómica de dos átomos de oxígeno individuales.
Explique por qué el símbolo para el elemento azufre y la fórmula para una molécula de azufre son diferentes.
Escriba las fórmulas moleculares y empíricas de los siguientes compuestos:
(a)

(b)

(c)

(d)

(a) molecular CO2, empíricoCO2; (b) molecular C2H2, empírico CH; (c) molecular C2H4, empírico CH2; (d) molecular H2SO4, empírico H2SO4
Escriba las fórmulas moleculares y empíricas de los siguientes compuestos:
(a)

(b)

(c)

(d)

Determine las fórmulas empíricas para los siguientes compuestos:
- (a) cafeína, C8H10N4O2
- (b) fructosa, C12H22O11
- (c) peróxido de hidrógeno, H2O2
- (d) glucosa, C6H12O6
- (e) ácido ascórbico (vitamina C), C6H8O6
(a) C4H5N2O; (b) C12H22O11; (c) HO; (d) CH2O; (e) C3H4O3
Determine las fórmulas empíricas para los siguientes compuestos:
- (a) ácido acético, C2H4O2
- (b) ácido cítrico, C6H8O7
- (c) hidracina, N2H4
- (d) nicotina, C10H14N2
- (e) butano, C4H10
Escriba las fórmulas empíricas para los siguientes compuestos:
(a)

(b)

(a) CH2O; (b) C2H4O
Abra la simulación construir una molécula y seleccione la pestaña "moléculas más grandes". Seleccione un "Kit" de átomos apropiado para construir una molécula con dos átomos de carbono y seis de hidrógeno. Arrastre los átomos al espacio sobre el "Kit" para formar una molécula. Aparecerá un nombre cuando haya creado una molécula que existe (incluso si no es la que usted desea). Puede usar la herramienta “Tijeras” para separar los átomos si desea cambiar las conexiones. Haga clic en "3D" para ver la molécula, y observe las posibilidades de llenado de espacio y de bola y palo.
- (a) Dibuje la fórmula estructural de esta molécula e indique su nombre.
- (b) ¿Puede organizar estos átomos de alguna manera para hacer un compuesto diferente?
Use la simulación construir una molécula para repetir el ejercicio, pero construya una molécula con dos carbonos, seis hidrógenos y un oxígeno.
- (a) Dibuje la fórmula estructural de esta molécula e indique su nombre.
- (b) ¿Puede organizar estos átomos para formar una molécula diferente? Si es así, dibuje su fórmula estructural e indique su nombre.
- (c) ¿Cómo se dibujan las moléculas en (a) y (b) igual? ¿En qué se diferencian? Cómo se llaman (el tipo de relación entre estas moléculas, no sus nombres).
(a) etanol

(b) metoximetano, más comúnmente llamado dimetil éter

(c) Estas moléculas tienen la misma composición química (tipos y número de átomos) pero diferentes estructuras químicas. Son isómeros estructurales.
Use la simulación construir una molécula para repetir el ejercicio, pero construya una molécula con tres carbonos, siete hidrógenos y un cloro.
a. Dibuje la fórmula estructural de esta molécula e indique su nombre.
b. ¿Puede organizar estos átomos para hacer una molécula diferente? Si es así, dibuje su fórmula estructural e indique su nombre.
c. ¿Cómo se dibujan las moléculas en (a) y (b) igual? ¿Cómo son diferentes? ¿Cómo se llaman (el tipo de relación entre estas moléculas, no sus nombres)?
2.5: La Tabla Periódica
Usando la tabla periódica, clasifique cada uno de los siguientes elementos como un metal o un no metal, y luego clasifique cada uno como un elemento del grupo principal (representativo), metal de transición o metal de transición interno:
- uranio
- bromo
- estroncio
- neón
- oro
- americio
- rodio
- azufre
- carbono
- potasio
(a) metal, metal de transición interior; (b) elemento no metálico, representativo; (c) metal, elemento representativo; (d) elemento no metálico, representativo; (e) metal, metal de transición; (f) metal, metal de transición interior; (g) metal, metal de transición; (h) elemento no metálico, representativo; (i) elemento no metálico, representativo; (j) metal, elemento representativo
Usando la tabla periódica, clasifique cada uno de los siguientes elementos como un metal o un no metal, y luego clasifique cada uno como elemento del grupo principal (representativo), metal de transición o metal de transición interno:
- (a) cobalto
- (b) europio
- (c) yodo
- (d) indio
- (e) litio
- (f) oxígeno
- (g) cadmio
- (h) terbio
- (i) rhenio
Usando la tabla periódica, identifique el miembro más liviano de cada uno de los siguientes grupos:
- (a) gases nobles
- (b) metales alcalinotérreos
- (c) metales alcalinos
- (d) calcogenos
(a) He; (b) Be; (c) Li; (d) O
Usando la tabla periódica, identifique el miembro más pesado de cada uno de los siguientes grupos:
- (a) metales alcalinos
- (b) calcogenos
- (c) gases nobles
- (d) metales alcalinotérreos
- Use la tabla periódica para dar el nombre y el símbolo para cada uno de los siguientes elementos:
- (a) el gas noble en el mismo período que el germanio
- (b) el metal alcalinotérreo en el mismo período que el selenio
- (c) El halógeno en el mismo período que el litio.
- (d) el calcógeno en el mismo período que el cadmio
(a) criptón, Kr; (b) calcio, Ca; (c) flúor, F; (d) telurio, Te
Use la tabla periódica para dar el nombre y el símbolo para cada uno de los siguientes elementos:
- (a) el halógeno en el mismo período que el metal alcalino con 11 protones
- (b) el metal alcalinotérreo en el mismo período con el gas noble neutro con 18 electrones
- (c) el gas noble en la misma fila que un isótopo con 30 neutrones y 25 protones
- (d) El gas noble en el mismo período que el oro.
Escriba un símbolo para cada uno de los siguientes isótopos neutrales. Incluya el número atómico y el número de masa para cada uno.
- (a) el metal alcalino con 11 protones y un número de masa de 23
- (b) el elemento de gas noble con 75 neutrones en su núcleo y 54 electrones en el átomo neutro
- (c) El isótopo con 33 protones y 40 neutrones en su núcleo.
- (d) El metal alcalinotérreo con 88 electrones y 138 neutrones.
(a) Na2311; (b) Xe12954; (c) As7333; (d) Ra22688
Escriba un símbolo para cada uno de los siguientes isótopos neutrales. Incluya el número atómico y el número de masa para cada uno.
- (a) el calcógeno con una masa de 125
- (b) el halógeno cuyo isótopo de vida más larga es radioactivo
- (c) el gas noble, usado en iluminación, con 10 electrones y 10 neutrones.
- (d) el metal alcalino más ligero con tres neutrones.
2.6: Los Compuestos Moleculares e Iónicos
Usando la tabla periódica, prediga si los siguientes cloruros son iónicos o covalentes: KCl, NCl3, ICl, MgCl2, PCl5, y CCl4.
Iónico: KCl, MgCl2; Covalente: NCl3, ICl, PCl5, CCl4
Usando la tabla periódica, prediga si los siguientes cloruros son iónicos o covalentes: SiCl4, PCl3, CaCl2, CsCl, CuCl2, y CrCl3.
Para cada uno de los siguientes compuestos, indique si el compuesto es iónico o covalente. Si es iónico, escriba los símbolos para los iones involucrados:
- (a) NF3
- (b) BaO,
- (c) (NH4)2CO3
- (d) Sr(H2PO4)2
- (e) IBr
- (f) Na2O
(a) covalente; (b) iónico, Ba2+, O2−; (c) iónico, NH+4, CO2−3; (d) iónico, Sr2+, H2PO−4; (e) covalente (f) iónico, Na+, O2−
Para cada uno de los siguientes compuestos, indique si es iónico o covalente, y si es iónico, escriba los símbolos para los iones involucrados:
- (a) KClO4
- (b) MgC2H3O2
- (c) H2S
- (d) Ag2S
- (e) N2Cl4
- (f) Co(NO3)2
Para cada uno de los siguientes pares de iones, escriba el símbolo para la fórmula del compuesto que formará:
- (a) Ca2+, S2−
- (b) NH+4, SO2−4
- (c) Al3+, Br−
- (d) Na+, HPO2−4
- (e) Mg2+, PO3−4
(a) CaS; (b) (NH4)2CO3; (c) AlBr3; (d) Na2HPO4; (e) Mg3 (PO4)2
Para cada uno de los siguientes pares de iones, escriba el símbolo para la fórmula del compuesto que formará:
- (a) K+, O2−
- (b) NH+4, PO3−4
- (c) Al3+, O2−
- (d) Na+, CO2−3
- (e) Ba2+, PO3−4
2.7: Nomenclatura Química
Nombre los siguientes compuestos:
- (a) CsCl
- (b) BaO
- (c) K2S
- (d) BeCl2
- (e) HBr
- (f) AlF3
(a) cloruro de cesio; (b) óxido de bario; (c) sulfuro de potasio; (d) cloruro de berilio; (e) bromuro de hidrógeno; (f) fluoruro de aluminio
Nombre los siguientes compuestos:
- (a) NaF
- (b) Rb2O
- (c) BCl3
- (d) H2Se
- (e) P4O6
- (f) ICl3
Escriba las fórmulas de los siguientes compuestos:
- (a) bromuro de rubidio
- (b) seleniuro de magnesio
- (c) óxido de sodio
- (d) cloruro de calcio
- (e) fluoruro de hidrógeno
- (f) fosfuro de galio
- (g) bromuro de aluminio
- (h) sulfato de amonio
(a) RbBr; (b) MgSe; (c) Na2O; (d) CaCl2; (e) HF; (f) GaP; (g) AlBr3; (h) (NH4)2SO4
Escriba las fórmulas de los siguientes compuestos:
- (a) carbonato de litio
- (b) perclorato de sodio
- (c) hidróxido de bario
- (d) carbonato de amonio
- (e) ácido sulfúrico
- (f) acetato de calcio
- (g) fosfato de magnesio
- (h) sulfito de sodio
Escriba las fórmulas de los siguientes compuestos:
- (a) dióxido de cloro
- (b) tetraóxido de dinitrógeno
- (c) fosfuro de potasio
- (d) sulfuro de plata (I)
- (e) nitruro de aluminio
- (f) dióxido de silicio
(a) ClO2; (b) N2O4; (c) K3P; (d) Ag2S; (e) AlN; (f) SiO2
Escriba las fórmulas de los siguientes compuestos:
- (a) cloruro de bario
- (b) nitruro de magnesio
- (c) dióxido de azufre
- (d) tricloruro de nitrógeno
- (e) trióxido de dinitrógeno
- (f) cloruro de estaño (IV)
Cada uno de los siguientes compuestos contienen un metal que puede exhibir más de una carga iónica. Nombre estos compuestos:
- (a) Cr2O3
- (b) FeCl2
- (c) CrO3
- (d) TiCl4
- (e) CoO
- (f) MoS2
(a) óxido de cromo (III); (b) cloruro de hierro (II); (c) óxido de cromo (VI); (d) cloruro de titanio (IV); (e) óxido de cobalto (II); (f) sulfuro de molibdeno (IV)
Cada uno de los siguientes compuestos contiene un metal que puede exhibir más de una carga iónica. Nombre estos compuestos:
- (a) NiCO3
- (b) MoO3
- (c) Co(NO3)2
- (d) V2O5
- (e) MnO2
- (f) Fe2O3
Los siguientes compuestos iónicos se encuentran en productos domésticos comunes. Escriba las fórmulas para cada compuesto:
- (a) fosfato de potasio
- (b) sulfato de cobre (II)
- (c) cloruro de calcio
- (d) dióxido de titanio
- (e) nitrato de amonio
- (f) bisulfato de sodio (el nombre común para el hidrógeno sulfato de sodio)
(a) K3PO4; (b) CuSO4; (c) CaCl2; (d) TiO2; (e) NH4NO3; (f) NaHSO4
Los siguientes compuestos iónicos se encuentran en productos domésticos comunes. Nombre cada uno de los compuestos:
- (a) Ca(H2PO4)2
- (b) FeSO4
- (c) CaCO3
- (d) MgO
- (e) NaNO2
- (f) KI
¿Cuáles son los nombres IUPAC de los siguientes compuestos?
- (a) dióxido de manganeso
- (b) cloruro de mercurio (Hg2Cl2)
- (c) nitrato férrico [Fe(NO3)3]
- (d) tetracloruro de titanio
- (e) bromuro cúprico (CuBr2)
(a) óxido de manganeso (IV); (b) cloruro de mercurio (I); (c) nitrato de hierro (III); (d) cloruro de titanio (IV); (e) bromuro de cobre (II)


