2.2: Concentración
- Page ID
- 76000
La concentración es una unidad de medición general que reporta la cantidad de soluto presente en una cantidad conocida de solución
\[\text{concentration} = \dfrac {\text{amount of solute}} {\text{amount of solution}} \label{2.1}\]
Aunque asociamos los términos “soluto” y “solución” con muestras líquidas, podemos extender su uso a muestras en fase gaseosa y en fase sólida también. En el cuadro 2.2.1 se enumeran las unidades de concentración más comunes.
| Nombre | Unidades | Símbolo |
|---|---|---|
| molaridad | \(\dfrac {\text{moles solute}} {\text{liters solution}}\) | M |
| formalidad | \(\dfrac {\text{moles solute}} {\text{liters solution}}\) | F |
| normalidad | \(\dfrac {\text{equivalents solute}} {\text{liters solution}}\) | N |
| molalidad | \(\dfrac {\text{moles solute}} {\text{kilograms solvent}}\) | m |
| por ciento en peso | \(\dfrac {\text{grams solute}} {\text{100 grams solution}}\) | % p/p |
| por ciento en volumen | \(\dfrac {\text{mL solute}} {\text{100 mL solution}}\) | % v/v |
| porcentaje peso a volumen | \(\dfrac {\text{grams solute}} {\text{100 mL solution}}\) | % p/v |
| partes por millón | \(\dfrac {\text{grams solute}} {10^6 \text{ grams solution}}\) | ppm |
| partes por mil millones | \(\dfrac {\text{grams solute}} {10^9 \text{ grams solution}}\) | ppb |
Una expresión alternativa para el porcentaje en peso es
\[\dfrac {\text{grams solute}} {\text{grams solution}} \times 100\ \nonumber\]
Puede usar expresiones alternativas similares para el porcentaje de volumen y para el porcentaje de peso a volumen.
Molaridad y Formalidad
Tanto la molaridad como la formalidad expresan concentración como moles de soluto por litro de solución; sin embargo, existe una sutil diferencia entre ellos. La molaridad es la concentración de una especie química particular. La formalidad, por otro lado, es la concentración total de una sustancia sin tener en cuenta su forma química específica. No hay diferencia entre la molaridad de un compuesto y la formalidad si se disuelve sin disociarse en iones. La concentración formal de una solución de glucosa, por ejemplo, es la misma que su molaridad.
Para un compuesto que se ioniza en solución, como CaCl 2, la molaridad y la formalidad son diferentes. Cuando disolvemos 0.1 moles de CaCl 2 en 1 L de agua, la solución contiene 0.1 moles de Ca 2 + y 0.2 moles de Cl —. La molaridad de CaCl 2, por lo tanto, es cero ya que no hay CaCl 2 no disociado en solución; en cambio, la solución es 0.1 M en Ca 2 + y 0.2 M en Cl —. La formalidad de CaCl 2, sin embargo, es 0.1 F ya que representa la cantidad total de CaCl 2 en solución. Esta definición más rigurosa de molaridad, para bien o para mal, se ignora en gran medida en la literatura actual, como lo es en este libro de texto. Cuando afirmamos que una solución es 0.1 M CaCl 2 entendemos que consiste en iones Ca 2 + y Cl —. Reservaremos la unidad de formalidad a situaciones en las que proporcione una descripción más clara de la química de la solución.
La molaridad se usa con tanta frecuencia que utilizamos una notación simbólica para simplificar su expresión en ecuaciones y en escritura. Los corchetes alrededor de una especie indican que nos estamos refiriendo a la molaridad de esa especie. Así, [Ca 2 +] se lee como “la molaridad de los iones de calcio”.
Para un soluto que se disuelve sin sufrir ionización, la molaridad y la formalidad tienen el mismo valor. Una solución que es 0.0259 M en glucosa, por ejemplo, es 0.0259 F en glucosa también.
Normalidad
La normalidad es una unidad de concentración que ya no es de uso común; sin embargo, debido a que puede encontrar normalidad en manuales antiguos de métodos analíticos, es útil comprender su significado. La normalidad define la concentración en términos de un equivalente, que es la cantidad de una especie química que reacciona estequiométricamente con otra especie química. Obsérvese que esta definición hace un equivalente, y por lo tanto la normalidad, una función de la reacción química en la que participa la especie. Si bien una solución de H 2 SO 4 tiene una molaridad fija, su normalidad depende de cómo reaccione. Encontrará un tratamiento más detallado de la normalidad en el Apéndice 1.
Un manual que todavía usa normalidad es Standard Methods for the Examination of Water and Wastewater, una publicación conjunta de la American Public Health Association, la American Water Works Association y la Water Environment Federation. Este manual es uno de los principales recursos para el análisis ambiental del agua y las aguas residuales.
Molalidad
La molalidad se utiliza en cálculos termodinámicos donde se necesita una unidad de concentración independiente de la temperatura. La molaridad se basa en el volumen de solución que contiene el soluto. Dado que la densidad es una propiedad dependiente de la temperatura, el volumen de una solución, y por lo tanto su concentración molar, cambia con la temperatura. Al usar la masa del disolvente en lugar del volumen de la solución, la concentración resultante se vuelve independiente de la temperatura.
Porcentaje de peso, volumen y peso a volumen
El porcentaje en peso (% w/w), el porcentaje en volumen (% v/v) y el porcentaje peso-volumen (% p/v) expresan la concentración como las unidades de soluto presentes en 100 unidades de solución. Una solución que es 1.5% p/v NH 4 NO 3, por ejemplo, contiene 1.5 gramos de NH 4 NO 3 en 100 mL de solución.
Piezas por millón y partes por mil millones
Partes por millón (ppm) y partes por mil millones (ppb) son proporciones que dan los gramos de soluto en, respectivamente, un millón o mil millones de gramos de muestra. Por ejemplo, una muestra de acero que es 450 ppm en Mn contiene 450 μg de Mn por cada gramo de acero. Si aproximamos la densidad de una solución acuosa como 1.00 g/mL, entonces podemos expresar las concentraciones de solución en ppm o ppb usando las siguientes relaciones.
\[\text{ppm} = \dfrac {\mu \text{g}} {\text{g}} = \dfrac {\text{mg}} {\text{L}} = \dfrac {\mu \text{g}} {\text{mL}} \quad \text{ppb} = \dfrac {\text{ng}} {\text{g}} = \dfrac {\mu \text{g}} {\text{L}} = \dfrac {\text{ng}} {\text{mL}} \nonumber\]
Para los gases una parte por millón generalmente se expresa como una relación de volumen; por ejemplo, una concentración de helio de 6.3 ppm significa que un litro de aire contiene 6.3 μL de He.
Debe tener cuidado al usar partes por millón y partes por mil millones para expresar la concentración de un soluto acuoso. La diferencia entre la concentración de un soluto en mg/L y ng/g, por ejemplo, es significativa si la densidad de la solución no es de 1.00 g/mL. Por esta razón muchas organizaciones desaconsejan usar las abreviaturas ppm y ppb (ver sección 7.10.3 en www.nist.gov). En caso de duda, incluir las unidades exactas, como 0.53 μg Pb 2 + /L para la concentración de plomo en una muestra de agua de mar.
Conversión entre unidades de concentración
Las formas más comunes de expresar la concentración en la química analítica son la molaridad, el porcentaje en peso, el porcentaje en volumen, el porcentaje peso a volumen, las partes por millón y las partes por mil millones. La definición general de concentración en la Ecuación\ ref {2.1} hace que sea fácil convertir entre unidades de concentración.
Una solución concentrada de amoníaco es 28.0% w/w NH 3 y tiene una densidad de 0.899 g/mL. ¿Cuál es la concentración molar de NH 3 en esta solución?
Solución
\[\dfrac {28.0 \text{ g } \ce{NH3}} {100 \text{ g soln}} \times \dfrac {0.899 \text{ g soln}} {\text{ml soln}} \times \dfrac {1 \text{ mol } \ce{NH3}} {17.03 \text{ g } \ce{NH3}} \times \dfrac {1000 \text{mL}} {\text{L}} = 14.8 \text{ M} \nonumber\]
La concentración máxima permisible de ion cloruro en un suministro municipal de agua potable es\(2.50 \times 10^2\) ppm Cl —. Cuando el suministro de agua supera este límite suele tener un sabor salado distintivo. ¿Cuál es la concentración molar equivalente de Cl —?
Solución
\[\dfrac {2.50 \times 10^2 \text{ mg } \ce{Cl-}} {\text{L}} \times \dfrac {1 \text{ g}} {1000 \text{ mg}} \times \dfrac {1 \text{ mol } \ce{Cl-}} {35.453 \text{ g} \ce{Cl-}} = 7.05 \times 10^{-3} \text{ M} \nonumber\]
¿Qué solución —NaCl 0.50 M o SrCl 2 0.25 M— tiene la mayor concentración cuando se expresa en mg/mL?
- Responder
-
Las concentraciones de las dos soluciones son
\[\dfrac {0.50 \text{ mol NaCl}} {\text{L}} \times \dfrac {58.44 \text{ g NaCl}} {\text{mol NaCl}} \times \dfrac {10^6 \: \mu \text{g}} {\text{g}} \times \dfrac {1 \text{L}} {1000 \text{ mL}} = 2.9 \times 10^{4} \: \mu \text{g/mL NaCl} \nonumber\]
\[\dfrac {0.25 \text{ mol } \ce{SrCl2}} {\text{L}} \times \dfrac {158.5 \text{ g } \ce{SrCl2}} {\text{mol } \ce{SrCl2}} \times \dfrac {10^6 \: \mu \text{g}} {\text{g}} \times \dfrac {1 \text{L}} {1000 \text{ mL}} = 4.0 \times 10^{4} \: \mu \text{g/ml } \ce{SrCl2} \nonumber\]
La solución de SrCl 2 tiene la mayor concentración cuando se expresa en μg/mL en lugar de en mol/L.
P-funciones
En ocasiones resulta inconveniente usar las unidades de concentración en la Tabla 2.2.1 . Por ejemplo, durante una reacción química la concentración de una especie puede cambiar en muchos órdenes de magnitud. Si queremos mostrar gráficamente el progreso de la reacción, podríamos querer trazar la concentración del reactivo en función del volumen de un reactivo agregado a la reacción. Tal es el caso en la Figura 2.2.1 para la titulación de HCl con NaOH. El eje y en el lado izquierdo de la figura muestra el [H +] en función del volumen de NaOH. El [H +] inicial es 0.10 M y su concentración después de agregar 80 mL de NaOH es\(4.3 \times 10^{-13}\) M. Podemos seguir fácilmente el cambio en [H +] para la adición de los primeros 50 mL de NaOH; sin embargo, para los volúmenes restantes de NaOH el cambio en [H +] es demasiado pequeño para verlo.
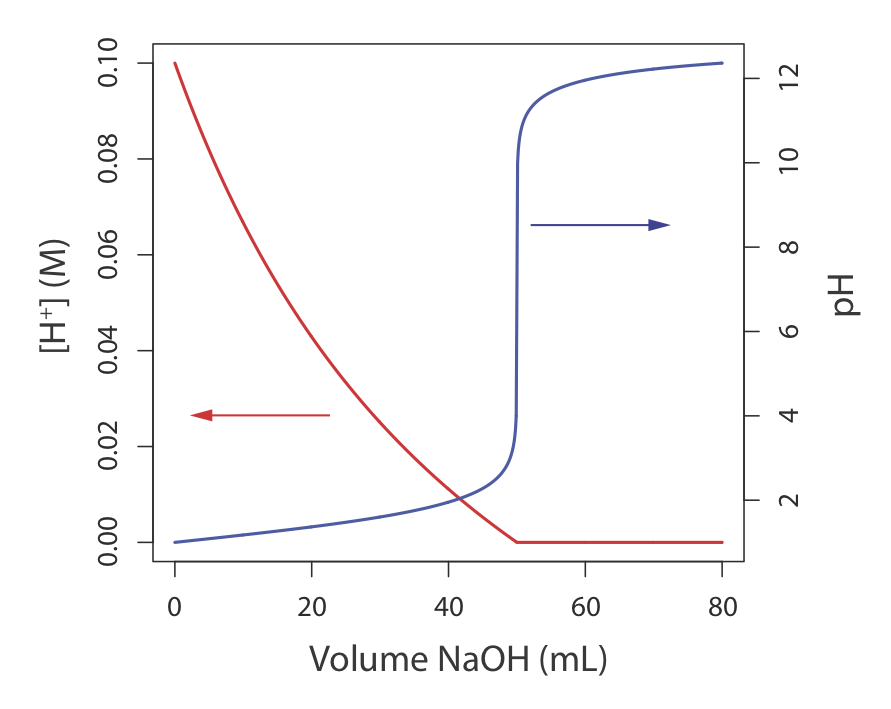
Cuando se trabaja con concentraciones que abarcan muchos órdenes de magnitud, a menudo es más conveniente expresar la concentración usando una función p. La función p de X se escribe como p X y se define como
\[\text{p} X = - \log (X) \nonumber\]
El pH de una solución que es 0.10 M H + por ejemplo, es
\[\text{pH} = - \log [\ce{H+}] = - \log (0.10) = 1.00 \nonumber\]
y el pH de\(4.3 \times 10^{-13}\) M H + es
\[\text{pH} = - \log [\ce{H+}] = - \log (4.3 \times 10^{-13}) = 12.37 \nonumber\]
La Figura 2.2.1 muestra que graficar el pH en función del volumen de NaOH proporciona información más útil sobre cómo cambia la concentración de H + durante la titulación.
Una ecuación más apropiada para el pH es\(\text{pH} = - \log (a_{\ce{H+}})\) dónde\(a_{\ce{H+}}\) está la actividad del ión hidrógeno. Consulte el Capítulo 6.9 para más detalles. Por ahora la ecuación aproximada\(\text{pH} = - \log [\ce{H+}]\) es suficiente.
¿Qué es el pNA para una solución de\(1.76 \times 10^{-3}\) M Na 3 PO 4?
Solución
Dado que cada mol de Na 3 PO 4 contiene tres moles de Na +, la concentración de Na + es
\[[\ce{Na+}] = (1.76 \times 10^{-3} \text{ M}) \times \dfrac {3 \text{ mol } \ce{Na+}} {\text{mol } \ce{Na3PO4}} = 5.28 \times 10^{-3} \text{ M} \nonumber\]
y pNA es
\[\text{pNa} = - \log [\ce{Na+}] = - \log (5.28 \times 10^{-3}) = 2.277 \nonumber\]
Recuerda que un PnA de 2.777 tiene tres, no cuatro, cifras significativas; el 2 que aparece en el lugar del uno indica la potencia de 10 cuando escribimos [Na +] como\(0.528 \times 10^{-2}\) M.
¿Cuál es el [H +] en una solución que tiene un pH de 5.16?
Solución
La concentración de H + es
\[\text{pH} = - \log [\ce{H+}] = 5.16 \nonumber\]
\[\log [\ce{H+}] = -5.16 \nonumber\]
\[[\ce{H+}] = 10^{-5.16} = 6.9 \times 10^{-6} \text{ M} \nonumber\]
Recordemos que si log (X) = a, entonces X = 10 a.
¿Cuáles son los valores para pNA y PSO 4 si disolvemos 1.5 g Na 2 SO 4 en un volumen total de solución de 500.0 mL?
- Responder
-
Las concentraciones de Na + y\(\ce{SO4^{2-}}\) son
\[\dfrac {1.5 \text{ g } \ce{Na2SO4}} {0.500 \text{L}} \times \dfrac {1 \text{ mol } \ce{Na2SO4}} {142.0 \text{ g } \ce{Na2SO4}} \times \dfrac {2 \text{ mol } \ce{Na+}} {\text{mol } \ce{mol } \ce{Na2SO4}} = 4.23 \times 10^{-2} \text{ M } \ce{Na+} \nonumber\]
\[\dfrac {1.5 \text{ g } \ce{Na2SO4}} {0.500 \text{L}} \times \dfrac {1 \text{ mol } \ce{Na2SO4}} {142.0 \text{ g } \ce{Na2SO4}} \times \dfrac {1 \text{ mol } \ce{SO4^{2-}}} {\text{mol } \ce{mol } \ce{Na2SO4}} = 2.11 \times 10^{-2} \text{ M } \ce{SO4^{2-}} \nonumber\]
Los valores de pNA y PSO 4 son
\[\text{pNa} = - \log (4.23 \times 10^{-2} \text{ M } \ce{Na+}) = 1.37 \nonumber\]
\[\text{pSO}_4 = - \log (2.11 \times 10^{-2} \text{ M } \ce{SO4^{2-}}) = 1.68 \nonumber\]


