2.3: Cálculos estequiométricos
- Page ID
- 75993
Una reacción equilibrada, que define la relación estequiométrica entre los moles de reactivos y los moles de productos, proporciona la base para muchos cálculos analíticos. Consideremos, por ejemplo, un análisis para ácido oxálico, H 2 C 2 O 4, en el que Fe 3 + oxida el ácido oxálico a CO 2
\[2\ce{Fe^{3+}}(aq) + \ce{H2C2O4}(aq) + 2\ce{H2O}(l) \ce{->} 2\ce{Fe^{2+}}(aq) + 2\ce{CO2}(g) + 2\ce{H3O+}(aq) \nonumber\]
La reacción equilibrada nos muestra que un mol de ácido oxálico reacciona con dos moles de Fe 3 +. Como se muestra en el siguiente ejemplo, podemos utilizar esta reacción equilibrada para determinar la cantidad de H 2 C 2 O 4 en una muestra de ruibarbo si conocemos los moles de Fe 3 + necesarios para reaccionar completamente con ácido oxálico.
En cantidades suficientes, el ácido oxálico, cuya estructura se muestra a continuación, es tóxico. A concentraciones fisiológicas más bajas conduce a la formación de cálculos renales. Las hojas de la planta de ruibarbo contienen concentraciones relativamente altas de ácido oxálico. El tallo, que a muchos individuos les gusta comer, contiene concentraciones mucho más pequeñas de ácido oxálico.
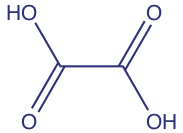
En los ejemplos que siguen, tenga en cuenta que conservamos una cifra extra significativa a lo largo del cálculo, redondeando al número correcto de cifras significativas al final. Seguiremos esta convención en cualquier cálculo que implique más de un paso. Si olvidamos que estamos conservando una cifra extra significativa, podríamos reportar la respuesta final con demasiadas cifras significativas. Aquí marcamos el dígito extra en rojo para énfasis. Asegúrese de elegir un sistema para realizar un seguimiento de cifras significativas.
La cantidad de ácido oxálico en una muestra de ruibarbo se determinó por reacción con Fe 3 +. Después de extraer un 10.62 g de ruibarbo con un solvente, la oxidación del ácido oxálico requirió 36.44 mL de 0.0130 M Fe 3 +. ¿Cuál es el porcentaje en peso de ácido oxálico en la muestra de ruibarbo?
Solución
Comenzamos calculando los moles de Fe 3 + utilizados en la reacción
\[\frac {0.0130 \text{ mol } \ce{Fe^{3+}}} {\text{L}} \times 0.03644 \text{ M} = 4.73{\color{Red} 7} \times 10^{-4} \text{ mol } \ce{Fe^{3+}} \nonumber\]
Los moles de ácido oxálico que reaccionan con el Fe 3 +, por lo tanto, son
\[4.73{\color{Red} 7} \times 10^{-4} \text{ mol } \ce{Fe^{3+}} \times \frac {1 \text{ mol } \ce{H2C2O4}} {2 \text{ mol } \ce{Fe^{3+}}} = 2.36{\color{Red} 8} \times 10^{-4} \text{ mol } \ce{H2C2O4} \nonumber\]
Conversión de los moles de ácido oxálico en gramos de ácido oxálico
\[2.36{\color{Red} 8} \times 10^{-4} \text{ mol } \ce{H2C2O4} \times \frac {90.03 \text{ g } \ce{H2C2O4}} {\text{mol } \ce{H2C2O4}} = 2.13{\color{Red} 2} \times 10^{-2} \text{ g } \ce{H2C2O4} \nonumber\]
y calcular el porcentaje en peso da la concentración de ácido oxálico en la muestra de ruibarbo como
\[\frac {2.13{\color{Red} 2} \times 10^{-2} \text{ g } \ce{H2C2O4}} {10.62 \text{ g rhubarb}} \times 100 = 0.201 \text{% w/w } \ce{H2C2O4} \nonumber\]
Se puede disolver un precipitado de AgBr haciéndolo reaccionar con Na 2 S 2 O 3, como se muestra aquí.
\[\ce{AgBr}(s) + 2\ce{Na2S2O3}(aq) \ce{->} \ce{Ag(S2O3)_2^{3-}}(aq) + \ce{Br-}(aq) + 4\ce{Na+}(aq) \nonumber\]
¿Cuántos mL de 0.0138 M Na 2 S 2 O 3 necesitas para disolver 0.250 g de AgBr?
- Contestar
-
Primero, encontramos los moles de AgBr
\[0.250 \text{ g AgBr} \times \frac {1 \text{ mol AgBr}} {187.8 \text{ g AgBr}} = 1.331 \times 10^{-3} \text{ mol AgBr} \nonumber\]
y luego los moles y volumen de Na 2 S 2 O 3
\[1.331 \times 10^{-3} \text{ mol AgBr} \times \frac {2 \text{ mol } \ce{Na2S2O3}} {\text{mol AgBr}} = 2.662 \times 10^{-3} \text{ mol } \ce{Na2S2O3} \nonumber\]
\[2.662 \times 10^{-3} \text{ mol } \ce{Na2S2O3} \times \frac {1 \text{ L}} {0.0138 \text{ mol } \ce{Na2S2O3}} \times \frac {1000 \text{ mL}} {\text{L}} = 193 \text{ mL} \nonumber\]
El analito en el Ejemplo 2.3.1 , ácido oxálico, se encuentra en una forma químicamente útil porque hay un reactivo, Fe 3 +, que reacciona con él cuantitativamente. En muchos métodos analíticos, primero debemos convertir el analito en una forma más accesible antes de poder completar el análisis. Por ejemplo, un método para el análisis cuantitativo del disulfiram, C 10 H 20 N 2 S 4 —el ingrediente activo en el medicamento Antarusa, y cuya estructura se muestra a continuación— requiere que primero convidamos el azufre a SO 2 por combustión, y luego oxidemos el SO 2 a H 2 SO 4 burbujeándolo a través de una solución de H 2 O 2. Cuando se completa la conversión, la cantidad de H 2 SO 4 se determina valorando con NaOH.
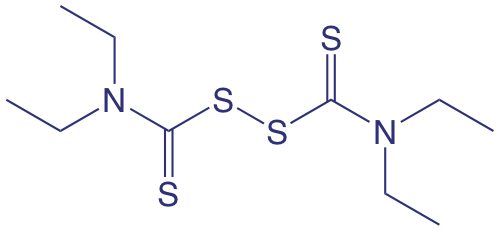
Para convertir los moles de NaOH utilizados en la titulación a los moles de disulfiram en la muestra, necesitamos conocer la estequiometría de cada reacción. Escribir una reacción equilibrada para H 2 SO 4 y NaOH es sencillo
\[\ce{H2SO4}(aq) + 2\ce{NaOH}(aq) \ce{->} 2\ce{H2O}(l) + \ce{Na2SO4}(aq) \nonumber\]
pero las reacciones equilibradas para las oxidaciones de C 10 H 20 N 2 S 4 a SO 2, y de SO 2 a H 2 SO 4 no son tan inmediatamente obvias. Aunque podemos equilibrar estas reacciones redox, a menudo es más fácil deducir la estequiometría general mediante el uso de un poco de lógica química.
Se realiza un análisis para disulfiram, C 10 H 20 N 2 S 4, en Antabuse oxidando el azufre a H 2 SO 4 y titulando el H 2 SO 4 con NaOH. Si una muestra de 0.4613-g de Antabuse requiere 34.85 mL de NaOH 0.02500 M para valorar el H 2 SO 4, ¿cuál es el% w/w de disulfiram en la muestra?
Solución
Calcular los moles de H 2 SO 4 es fácil; primero, calculamos los moles de NaOH utilizados en la titulación
\[(0.02500 \text{ M}) \times (0.03485 \text{ L}) = 8.712{\color{Red} 5} \times 10^{-4} \text{ mol NaOH} \nonumber\]
y luego usamos la estequiometría de la reacción de titulación para calcular los moles correspondientes de H 2 SO 4.
\[8.712{\color{Red} 5} \times 10^{-4} \text{ mol NaOH} \times \frac {1 \text{ mol } \ce{H2SO4}} {2 \text{ mol NaOH}} = 4.356{\color{Red} 2} \times 10^{-4} \text{ mol } \ce{H2SO4} \nonumber\]
Aquí es donde usamos un poco de lógica química. En lugar de equilibrar las reacciones para la combustión de C 10 H 20 N 2 S 4 a SO 2 y para la posterior oxidación de SO 2 a H 2 SO 4, reconocemos que una conservación de la masa requiere que todo el azufre en C 10 H 20 N 2 S 4 termina en el H 2 SO 4; así
\[4.356{\color{Red} 2} \times 10^{-4} \text{ mol } \ce{H2SO4} \times \frac {1 \text{ mol S}} {\text{mol } \ce{H2SO4}} \times \frac {1 \text{ mol } \ce{C10H20N2S4}} {4 \text{ mol S}} = 1.089{\color{Red} 0} \times 10^{-4} \text{ mol } \ce{C10H20N2S4} \nonumber\]
\[1.089{\color{Red} 0} \times 10^{-4} \text{ mol } \ce{C10H20N2S4} \times \frac {296.54 \text{ g } \ce{C10H20N2S4}} {\text{mol } \ce{C10H20N2S4}} = 0.03229{\color{Red} 3} \text{ g } \ce{C10H20N2S4} \nonumber\]
\[\frac {0.03229{\color{Red} 3} \text{ g } \ce{C10H20N2S4}} {0.4613 \text{ g sample}} \times 100 = 7.000 \text{% w/w } \ce{C10H20N2S4} \nonumber\]
¡Una conservación de la masa es la esencia de la estequiometría!


