3.4: Selección de un Método Analítico
- Page ID
- 75778
Un método es la aplicación de una técnica a un analito específico en una matriz específica. Podemos desarrollar un método analítico para determinar la concentración de plomo en el agua potable utilizando cualquiera de las técnicas mencionadas en el apartado anterior. Un método gravimétrico, por ejemplo, podría precipiar el plomo como PbSO 4 o como PbCro 4, y usar la masa del precipitado como señal analítica. El plomo forma varios complejos solubles, que podemos usar para diseñar un método titrimétrico de complejación. Como se muestra en la Figura 3.2.1, podemos utilizar espectroscopía de absorción atómica de horno de grafito para determinar la concentración de plomo en el agua potable. Finalmente, los estados de oxidación múltiple del plomo (Pb 0, Pb 2 +, Pb 4+) hacen factible una variedad de métodos electroquímicos.
En última instancia, los requisitos del análisis determinan el mejor método. Al elegir entre los métodos disponibles, consideramos algunos o todos los siguientes criterios de diseño: precisión, precisión, sensibilidad, selectividad, robustez, robustez, escala de operación, tiempo de análisis, disponibilidad de equipos y costo.
Precisión
La precisión es lo cerca que el resultado de un experimento concuerda con el resultado “verdadero” o esperado. Podemos expresar la precisión como un error absoluto, e
\[e = \text{obtained result} - \text{expected result} \nonumber\]
o como porcentaje de error relativo,% e r
\[\% e_r = \frac {\text{obtained result} - \text{expected result}} {\text{expected result}} \times 100 \nonumber\]
La precisión de un método depende de muchas cosas, incluyendo la fuente de la señal, el valor de k A en la Ecuación 3.3.1 o la Ecuación 3.3.2, y la facilidad de manejo de las muestras sin pérdida ni contaminación. Una técnica de análisis total, como la gravimetría y la titrimetría, a menudo producen resultados más precisos que una técnica de concentración porque podemos medir masa y volumen con alta precisión, y porque el valor de k A se conoce exactamente a través de la estequiometría.
Debido a que es poco probable que sepamos el resultado verdadero, utilizamos un resultado esperado o aceptado para evaluar la precisión. Por ejemplo, podríamos usar un material de referencia estándar, que tiene un valor aceptado, para establecer la precisión de un método analítico. Encontrará un tratamiento más detallado de la exactitud en el Capítulo 4, incluyendo una discusión sobre las fuentes de errores.
Precisión
Cuando una muestra se analiza varias veces, los resultados individuales varían de un ensayo a otro. La precisión es una medida de esta variabilidad. Cuanto más cerca esté la concordancia entre los análisis individuales, más precisos serán los resultados. Por ejemplo, los resultados mostrados en la mitad superior de la Figura 3.4.1 para la concentración de K + en una muestra de suero son más precisos que los de la mitad inferior de la Figura 3.4.1 . Es importante entender que la precisión no implica exactitud. Que los datos en la mitad superior de la Figura 3.4.1 sean más precisos no significa que el primer conjunto de resultados sea más preciso. De hecho, ninguno de los dos conjuntos de resultados puede ser exacto.
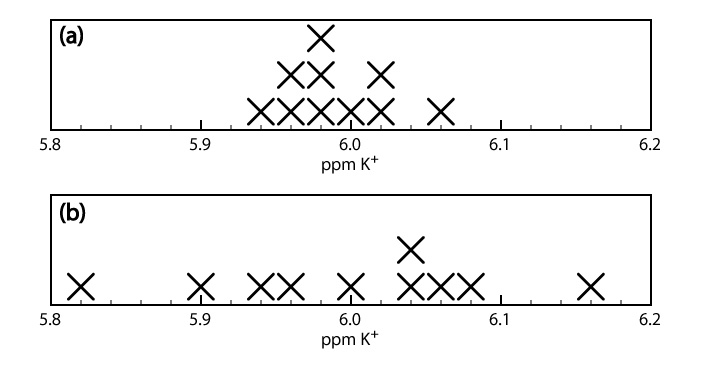
La precisión de un método depende de varios factores, entre ellos la incertidumbre en la medición de la señal y la facilidad de manejo de las muestras de manera reproducible. En la mayoría de los casos podemos medir la señal para una técnica de análisis total con una mayor precisión que la que es el caso de un método de concentración.
Confundir precisión y precisión es un error común. Ver Ryder, J.; Clark, A. U. Chem. Ed. 2002, 6, 1—3, y Tomlinson, J.; Dyson, P. J.; Garratt, J. U. Chem. Ed. 2001, 5, 16—23 para discusiones sobre este y otros conceptos erróneos comunes sobre el significado del error. Encontrará un tratamiento más detallado de la precisión en el Capítulo 4, incluyendo una discusión de fuentes de errores.
Sensibilidad
La capacidad de demostrar que dos muestras tienen diferentes cantidades de analito es una parte esencial de muchos análisis. La sensibilidad de un método es una medida de su capacidad para establecer que tal diferencia es significativa. La sensibilidad a menudo se confunde con el límite de detección de un método, que es la menor cantidad de analito que podemos determinar con confianza.
La confianza, como veremos en el Capítulo 4, es un concepto estadístico que se basa en la idea de una población de resultados. Por esta razón, pospondremos nuestra discusión sobre los límites de detección al Capítulo 4. Por ahora, la definición de un límite de detección que se da aquí es suficiente.
La sensibilidad es equivalente a la constante de proporcionalidad, k A, en la Ecuación 3.3.1 y la Ecuación 3.3.2 [Compendio de Terminología Química de la IUPAC, versión electrónica]. Si\(\Delta S_A\) es la diferencia más pequeña que podemos medir entre dos señales, entonces la diferencia detectable más pequeña en la cantidad absoluta o la cantidad relativa de analito es
\[\Delta n_A = \frac {\Delta S_A} {k_A} \quad \text{ or } \quad \Delta C_A = \frac {\Delta S_A} {k_A} \nonumber\]
Supongamos, por ejemplo, que nuestra señal analítica es una medición de la masa utilizando una balanza cuyo menor incremento detectable es ±0.0001 g. Si la sensibilidad de nuestro método es 0.200, entonces nuestro método puede detectar posiblemente una diferencia en masa de tan poca como
\[\Delta n_A = \frac {\pm 0.0001 \text{ g}} {0.200} = \pm 0.0005 \text{ g} \nonumber\]
Para dos métodos con el mismo\(\Delta S_A\), el método con mayor sensibilidad, es decir, el método con la k A más grande, es mejor capaz de discriminar entre cantidades menores de analito.
Especificidad y Selectividad
Un método analítico es específico si su señal depende únicamente del analito [Persson, B-A; Vessman, J. Trends Anal. Chem. 1998, 17, 117—119; Persson, B-A; Vessman, J. Tendencias Anal. Chem. 2001, 20, 526—532]. Aunque la especificidad es lo ideal, pocos métodos analíticos están libres de interferencias. Cuando un interferente contribuye a la señal, ampliamos la Ecuación 3.3.1 y la Ecuación 3.3.2 para incluir su contribución a la señal de la muestra, S samp
\[S_{samp} = S_A + S_I = k_A n_A + k_I n_I \label{3.1}\]
\[S_{samp} = S_A + S_I = k_A C_A + k_I C_I \label{3.2}\]
donde S I es la contribución del interferente a la señal, k I es la sensibilidad del interferente, y n I y C I son los moles (o gramos) y el concentración de interferente en la muestra, respectivamente.
La selectividad es una medida de la ausencia de interferencias de un método [Valcárcel, M.; Gomez-Hens, A.; Rubio, S. Trends Anal. Chem. 2001, 20, 386—393]. La selectividad de un método para un interferente en relación con el analito se define por un coeficiente de selectividad, K A, I
\[K_{A,I} = \frac {k_I} {k_A} \label{3.3}\]
que puede ser positivo o negativo dependiendo de los signos de k I y k A. El coeficiente de selectividad es mayor que +1 o menor que —1 cuando el método es más selectivo para el interferente que para el analito.
Aunque k A y k I suelen ser positivos, pueden ser negativos. Por ejemplo, algunos métodos analíticos funcionan midiendo la concentración de una especie que queda después de que reacciona con el analito. A medida que aumenta la concentración del analito, la concentración de la especie que produce la señal disminuye y la señal se vuelve más pequeña. Si a la señal en ausencia de analito se le asigna un valor de cero, entonces las señales posteriores son negativas.
Determinar el valor del coeficiente de selectividad es fácil si ya conocemos los valores para k A y k I. Como muestra el Ejemplo 3.4.1 , también podemos determinar K A, I midiendo S samp en presencia y en ausencia del interferente.
Un método para el análisis de Ca 2 + en agua sufre de una interferencia en presencia de Zn 2 +. Cuando la concentración de Ca 2 + es 100 veces mayor que la de Zn 2 +, un análisis para Ca 2 + tiene un error relativo de +0.5%. ¿Cuál es el coeficiente de selectividad para este método?
Solución
Dado que solo se reportan concentraciones relativas, podemos asignar arbitrariamente concentraciones absolutas. Para facilitar los cálculos, dejaremos que C Ca = 100 (unidades arbitrarias) y C Zn = 1. Un error relativo de +0.5% significa que la señal en presencia de Zn 2 + es 0.5% mayor que la señal en ausencia de Zn 2 +. Nuevamente, podemos asignar valores para facilitar el cálculo. Si la señal para Cu 2 + en ausencia de Zn 2 + es de 100 (unidades arbitrarias), entonces la señal en presencia de Zn 2 + es 100.5.
El valor de k Ca se determina usando la Ecuación 3.3.2
\[k_\text{Ca} = \frac {S_\text{Ca}} {C_\text{Ca}} = \frac {100} {100} = 1 \nonumber\]
En presencia de Zn 2 + la señal viene dada por la Ecuación 3.4.2; así
\[S_{samp} = 100.5 = k_\text{Ca} C_\text{Ca} + k_\text{Zn} C_\text{Zn} = (1 \times 100) + k_\text{Zn} \times 1 \nonumber\]
Resolver para k Zn da su valor como 0.5. El coeficiente de selectividad es
\[K_\text{Ca,Zn} = \frac {k_\text{Zn}} {k_\text{Ca}} = \frac {0.5} {1} = 0.5 \nonumber\]
Si no está seguro de por qué, en el ejemplo anterior, la señal en presencia de zinc es 100.5, tenga en cuenta que el porcentaje de error relativo para este problema viene dado por
\[\frac {\text{obtained result} - 100} {100} \times 100 = +0.5 \% \nonumber\]
Resolver da un resultado obtenido de 100.5.
Wang y sus colegas describen un método de fluorescencia para el análisis de Ag + en agua. Al analizar una solución que contiene\(1.0 \times 10^{-9}\) M Ag + y\(1.1 \times 10^{-7}\) M Ni 2 +, la intensidad de fluorescencia (la señal) fue +4.9% mayor que la obtenida para una muestra de\(1.0 \times 10^{-9}\) M Ag +. ¿Qué es K Ag, Ni para este método analítico? La cita completa para los datos en este ejercicio es Wang, L.; Liang, A. N.; Chen, H.; Liu, Y.; Qian, B.; Fu, J. Anal. Chim. Acta 2008, 616, 170-176.
- Contestar
-
Debido a que la señal para Ag + en presencia de Ni 2 + se reporta como un error relativo, asignaremos un valor de 100 como la señal para\(1 \times 10^{-9}\) M Ag +. Con un error relativo de +4.9%, la señal para la solución de\(1 \times 10^{-9}\) M Ag + y\(1.1 \times 10^{-7}\) M Ni 2 + es 104.9. La sensibilidad para Ag + se determina usando la solución que no contiene Ni 2 +; así
\[k_\text{Ag} = \frac {S_\text{Ag}} {C_\text{Ag}} = \frac {100} {1 \times 10^{-9} \text{ M}} = 1.0 \times 10^{11} \text{ M}^{-1} \nonumber\]
Sustituyendo en la Ecuación\ ref {3.2} valores para k Ag, S samp y las concentraciones de Ag + y Ni 2 +
\[104.9 = (1.0 \times 10^{11} \text{ M}^{-1}) \times (1 \times 10^{-9} \text{ M}) + k_\text{Ni} \times (1.1 \times 10^{-7} \text{ M}) \nonumber\]
y resolviendo da k Ni como\(4.5 \times 10^7\) M —1. El coeficiente de selectividad es
\[K_\text{Ag,Ni} = \frac {k_\text{Ni}} {k_\text{Ag}} = \frac {4.5 \times 10^7 \text{ M}^{-1}} {1.0 \times 10^{11} \text{ M}^{-1}} = 4.5 \times 10^{-4} \nonumber\]
Un coeficiente de selectividad nos proporciona una manera útil de evaluar el efecto potencial de un interferente en un análisis. Resolviendo la ecuación\ ref {3.3} para k I
\[k_I = K_{A,I} \times k_A \label{3.4}\]
y sustituyendo en Ecuación\ ref {3.1} y Ecuación\ ref {3.2}, y simplificando da
\[S_{samp} = k_A \{ n_A + K_{A,I} \times n_I \} \label{3.5}\]
\[S_{samp} = k_A \{ C_A + K_{A,I} \times C_I \} \label{3.6}\]
Un interferente no planteará ningún problema siempre y cuando el término\(K_{A,I} \times n_I\) en la Ecuación\ ref {3.5} sea significativamente menor que n A, o si\(K_{A,I} \times C_I\) en la Ecuación\ ref {3.6} es significativamente menor que C A.
Barnett y sus colegas desarrollaron un método para determinar la concentración de codeína (estructura que se muestra a continuación) en plantas de amapola [Barnett, N. W.; Bowser, T. A.; Geraldi, R. D.; Smith, B. Anal. Chim. Acta 1996, 318, 309— 317]. Como parte de su estudio evaluaron el efecto de varios interferentes. Por ejemplo, los autores encontraron que las soluciones equimolares de codeína y la 6-metoxicodeína interferente dieron señales, respectivamente de 40 y 6 (unidades arbitrarias).
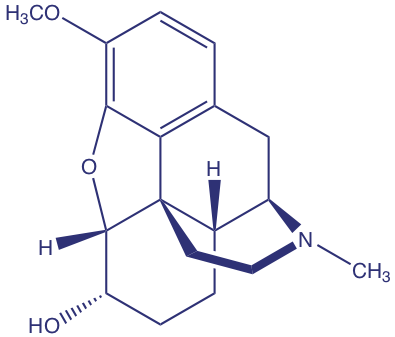
(a) Cuál es el coeficiente de selectividad para el interferente, 6-metoxicodeína, relativo al del analito, codeína.
(b) Si necesitamos conocer la concentración de codeína con una precisión de ± 0.50%, ¿cuál es la concentración relativa máxima de 6-metoxi-codeína que podemos tolerar?
Solución
(a) Las señales debidas al analito, S A, y al interferente, S I, son
\[S_A = k_A C_A \quad \quad S_I = k_I C_I \nonumber\]
Resolver estas ecuaciones para k A y para k I, y sustituyendo en la ecuación\ ref {3.4} da
\[K_{A,I} = \frac {S_I / C_I} {S_A / C_I} \nonumber\]
Debido a que las concentraciones de analito e interferente son equimolares (C A = C I), el coeficiente de selectividad es
\[K_{A,I} = \frac {S_I} {S_A} = \frac {6} {40} = 0.15 \nonumber\]
b) Para lograr una precisión superior a ± 0.50% el término\(K_{A,I} \times C_I\) en la Ecuación\ ref {3.6} debe ser inferior al 0.50% de C A; así
\[K_{A,I} \times C_I \le 0.0050 \times C_A \nonumber\]
Resolviendo esta desigualdad para la relación C I/C A y sustituyendo en el valor de K A, I de la parte (a) da
\[\frac {C_I} {C_A} \le \frac {0.0050} {K_{A,I}} = \frac {0.0050} {0.15} = 0.033 \nonumber\]
Por lo tanto, la concentración de 6-metoxicodeína debe ser inferior al 3.3% de la concentración de codeína.
Cuando la señal de un método es el resultado de una reacción química —por ejemplo, cuando la señal es la masa de un precipitado— hay muchas posibilidades de que el método no sea muy selectivo y que sea susceptible a una interferencia.
Mercurio (II) también es un interferente en el método de fluorescencia para Ag + desarrollado por Wang y colegas (ver Ejercicio de Práctica 3.4.1). El coeficiente de selectividad, K Ag, Hg tiene un valor de\(-1.0 \times 10^{-3}\).
a) ¿Cuál es la significación del signo negativo del coeficiente de selectividad?
(b) Supongamos que planea utilizar este método para analizar soluciones con concentraciones de Ag + no menores a 1.0 nM. ¿Cuál es la concentración máxima de Hg 2 + que puedes tolerar si tu porcentaje de errores relativos debe ser menor a ± 1.0%?
- Contestar
-
(a) Un valor negativo para K Ag, Hg significa que la presencia de Hg 2 + disminuye la señal de Ag +.
(b) En este caso debemos considerar un error de — 1%, ya que el efecto de Hg 2 + es disminuir la señal de Ag +. Para lograr este error, el término\(K_{A,I} \times C_I\) en la Ecuación\ ref {3.6} debe ser menor que — 1% de C A; así
\[K_\text{Ag,Hg} \times C_\text{Hg} = -0.01 \times C_\text{Ag} \nonumber\]
Sustituyendo en valores conocidos por K Ag, Hg y C Ag, encontramos que la concentración máxima de Hg 2 + es\(1.0 \times 10^{-8}\) M.
Los problemas de selectividad también son más probables cuando el analito está presente a una concentración muy baja [Rodgers, L. B. J. Chem. Educ. 1986, 63, 3—6].
Mire hacia atrás en la Figura 1.1.1, que muestra el método analítico de Fresenio para la determinación de níquel en minerales. La razón por la que hay tantos pasos en este procedimiento es que las reacciones de precipitación generalmente no son muy selectivas. El método de la Figura 1.1.2 incluye menos etapas porque la dimetilglioxima es un reactivo más selectivo. Aun así, si un mineral contiene paladio, se necesitan pasos adicionales para evitar que el paladio interfiera.
Robustez y robustez
Para que un método sea útil debe proporcionar resultados confiables. Desafortunadamente, los métodos están sujetos a una variedad de interferencias químicas y físicas que aportan incertidumbre al análisis. Si un método está relativamente libre de interferencias químicas, podemos usarlo para analizar un analito en una amplia variedad de matrices de muestra. Dichos métodos se consideran robustos.
Las variaciones aleatorias en condiciones experimentales introducen incertidumbre. Si la sensibilidad de un método, k, depende demasiado de las condiciones experimentales, como la temperatura, la acidez o el tiempo de reacción, entonces un ligero cambio en cualquiera de estas condiciones puede dar un resultado significativamente diferente. Un método rugoso es relativamente insensible a los cambios en las condiciones experimentales.
Escala de Operación
Otra forma de reducir la elección de métodos es considerar tres limitaciones potenciales: la cantidad de muestra disponible para el análisis, la concentración esperada de analito en las muestras y la cantidad mínima de analito que producirá una señal medible. Colectivamente, estas limitaciones definen la escala de operaciones del método analítico.
Podemos mostrar visualmente la escala de operaciones (Figura 3.4.2 ) trazando el tamaño de la muestra en el eje x y la concentración del analito en el eje y. Para mayor comodidad, dividimos las muestras en <0.1 mg) sizes, and we divide analytes into major (> componentes macro (>0.1 g), meso (10 mg—100 mg), micro (0.1 mg—10 mg) y ultramicro (1% w/w), menor (0.01% w/w— 1% w/w), traza (10-7% w/w— 0.01% w/w) y ultratrace (<10 —7% w/w). En conjunto, la concentración del analito y el tamaño de la muestra proporcionan una descripción característica para un análisis. Por ejemplo, en un análisis de microtrazas la muestra pesa entre 0.1 mg y 10 mg y contiene una concentración de analito entre 10 —7% w/w y 10 —2% w/w.
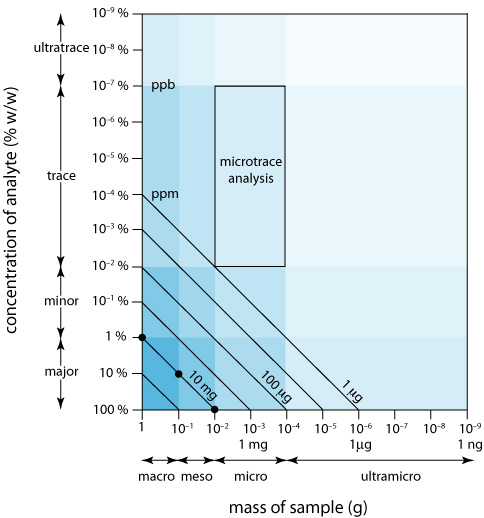
Las líneas diagonales que conectan los ejes muestran combinaciones de tamaño de muestra y concentración de analito que contienen la misma masa absoluta de analito. Como se muestra en la Figura 3.4.2 , por ejemplo, una muestra de 1 g que es 1% p/p de analito tiene la misma cantidad de analito (10 mg) que una muestra de 100 mg que es 10% p/p de analito, o una muestra de 10 mg que es 100% p/p de analito.
Podemos usar Figure 3.4.2 para establecer límites para los métodos analíticos. Si la señal mínima detectable de un método es equivalente a 10 mg de analito, entonces es la más adecuada para un analito mayor en una muestra macro o meso. Extender el método a un analito con una concentración de 0.1% w/w requiere una muestra de 10 g, lo que rara vez es práctico debido a las complicaciones de llevar una cantidad tan grande de material a través del análisis. Por otro lado, una pequeña muestra que contiene una cantidad traza de analito impone restricciones significativas a un análisis. Por ejemplo, una muestra de 1 mg que es 10 —4% w/w en analito contiene solo 1 ng de analito. Si aislamos el analito en 1 mL de solución, entonces necesitamos un método analítico que de manera confiable pueda detectarlo a una concentración de 1 ng/mL.
No debería sorprenderte saber que una técnica de análisis total suele requerir una macro o una muestra meso que contenga un analito mayor. Una técnica de concentración es particularmente útil para un analito menor, traza o ultratraza en una macro, meso o micromuestra.
Equipo, Tiempo y Costo
Finalmente, podemos comparar los métodos analíticos con respecto a sus necesidades de equipo, el tiempo necesario para completar un análisis y el costo por muestra. Los métodos que dependen de la instrumentación requieren un uso intensivo de equipos y pueden requerir una capacitación significativa del operador. Por ejemplo, el método espectroscópico de absorción atómica del horno de grafito para determinar el plomo en el agua requiere una importante inversión de capital en el instrumento y un operador experimentado para obtener resultados confiables. Otros métodos, como la titrimetría, requieren equipos menos costosos y menos capacitación.
El tiempo para completar un análisis para una muestra a menudo es bastante similar de método a método. Esto es algo engañoso, sin embargo, porque gran parte de este tiempo se dedica a preparar muestras, preparar reactivos y reunir equipos. Una vez que las muestras, los reactivos y el equipo están en su lugar, la velocidad de muestreo puede diferir sustancialmente. Por ejemplo, solo se necesitan unos minutos para analizar una sola muestra para plomo usando espectroscopía de absorción atómica de horno de grafito, pero varias horas para analizar la misma muestra usando gravimetría. Esto es un factor significativo en la selección de un método para un laboratorio que maneja un alto volumen de muestras.
El costo de un análisis depende de muchos factores, entre ellos el costo de los equipos y reactivos, el costo de contratar analistas y la cantidad de muestras que se pueden procesar por hora. En general, los métodos que dependen de instrumentos cuestan más por muestra que otros métodos.
Haciendo la elección final
Desafortunadamente, los criterios de diseño discutidos en esta sección no son mutuamente independientes [Valcárcel, M.; Ríos, A. Anal. Chem. 1993, 65, 781A—787A]. Trabajar con muestras más pequeñas o mejorar la selectividad a menudo viene a expensas de la precisión. Minimizar costos y tiempo de análisis puede disminuir la precisión. Seleccionar un método requiere equilibrar cuidadosamente los diversos criterios de diseño. Por lo general, el criterio de diseño más importante es la precisión, y el mejor método es el que da el resultado más preciso. Cuando la necesidad de un resultado es urgente, como suele ser el caso en los laboratorios clínicos, el tiempo de análisis puede convertirse en el factor crítico.
En algunos casos son las propiedades de la muestra las que determinan el mejor método. Una muestra con una matriz compleja, por ejemplo, puede requerir un método con excelente selectividad para evitar interferencias. Las muestras en las que el analito está presente a una concentración traza o ultratraza generalmente requieren un método de concentración. Si la cantidad de muestra es limitada, entonces el método no debe requerir una gran cantidad de muestra.
Determinar la concentración de plomo en el agua potable requiere un método que pueda detectar plomo en el nivel de concentración de partes por mil millones. La selectividad es importante porque otros iones metálicos están presentes en concentraciones significativamente mayores. Un método que utiliza espectroscopia de absorción atómica de horno de grafito es una opción común para determinar el plomo en el agua potable porque cumple con estas especificaciones. El mismo método también es útil para determinar plomo en sangre donde su capacidad para detectar bajas concentraciones de plomo usando unos microlitros de muestra es una consideración importante.


