3.5: Desarrollo del Procedimiento
- Page ID
- 75749
Después de seleccionar un método, el siguiente paso es desarrollar un procedimiento que logre nuestras metas para el análisis. En el desarrollo de un procedimiento se presta atención a la compensación de interferencias, a la selección y calibración de equipos, a la adquisición de una muestra representativa y a la validación del método.
Compensación de las interferencias
La precisión de un método depende de su selectividad para el analito. Incluso el mejor método, sin embargo, puede no estar libre de interferentes que contribuyan a la señal medida. Los potenciales interferentes pueden estar presentes en la propia muestra o en los reactivos utilizados durante el análisis.
Cuando la muestra está libre de interferentes, la señal total, S total, es una suma de la señal debida al analito, S A, y la señal debida a interferentes en los reactivos, S reag,
\[S_{total} = S_A + S_{reag} = k_A n_A + S_{reag} \label{3.1}\]
\[S_{total} = S_A + S_{reag} = k_A C_A + S_{reag} \label{3.2}\]
Sin una determinación independiente de S reag no podemos resolver la Ecuación\ ref {3.1} o\ ref {3.2} para los moles o concentración de analito.
Para determinar la contribución de S reag en Ecuaciones\ ref {3.1} y\ ref {3.2} medimos la señal para un método en blanco, una solución que no contiene la muestra. Consideremos, por ejemplo, un procedimiento en el que disolvemos una muestra de 0.1 g en una porción de disolvente, agregamos varios reactivos y diluimos a 100 mL con disolvente adicional. Para preparar el método blanco omitimos la muestra y diluimos los reactivos a 100 mL usando el disolvente. Debido a que el analito está ausente, S total para el método blanco es igual a S reag. Conocer el valor de S reag hace que sea fácil corregir S total para la contribución del reactivo a la señal total; así
\[(S_{total} - S_{reag}) = S_A = k_A n_A \nonumber\]
\[(S_{total} - S_{reag}) = S_A = k_A C_A \nonumber\]
Por sí mismo, un método en blanco no puede compensar un interferente que forma parte de la matriz de la muestra. Si por casualidad conocemos la identidad y concentración del interferente, entonces podemos agregarlo al método blanco; sin embargo, esta no es una circunstancia común y debemos, en cambio, encontrar un método para separar el analito e interferente antes de continuar con el análisis.
Un blanco de método también se conoce como blanco de reactivo. Cuando la muestra es líquida, o está en solución, utilizamos un volumen equivalente de un disolvente inerte como sustituto de la muestra.
Calibración
Una definición simple de un método analítico cuantitativo es que es un mecanismo para convertir una medición, la señal, en la cantidad de analito en una muestra. Suponiendo que podemos corregir para interferentes, un análisis cuantitativo no es más que resolver la Ecuación 3.3.1 o la Ecuación 3.3.2 para n A o para C A.
Para resolver estas ecuaciones necesitamos el valor de k A. Para un método de análisis total usualmente conocemos el valor de k A porque se define por la estequiometría de las reacciones químicas responsables de la señal. Para un método de concentración, sin embargo, el valor de k A suele ser una función compleja de las condiciones experimentales. Una calibración es el proceso de determinar experimentalmente el valor de k A midiendo la señal para una o más muestras estándar, cada una de las cuales contiene una concentración conocida de analito.
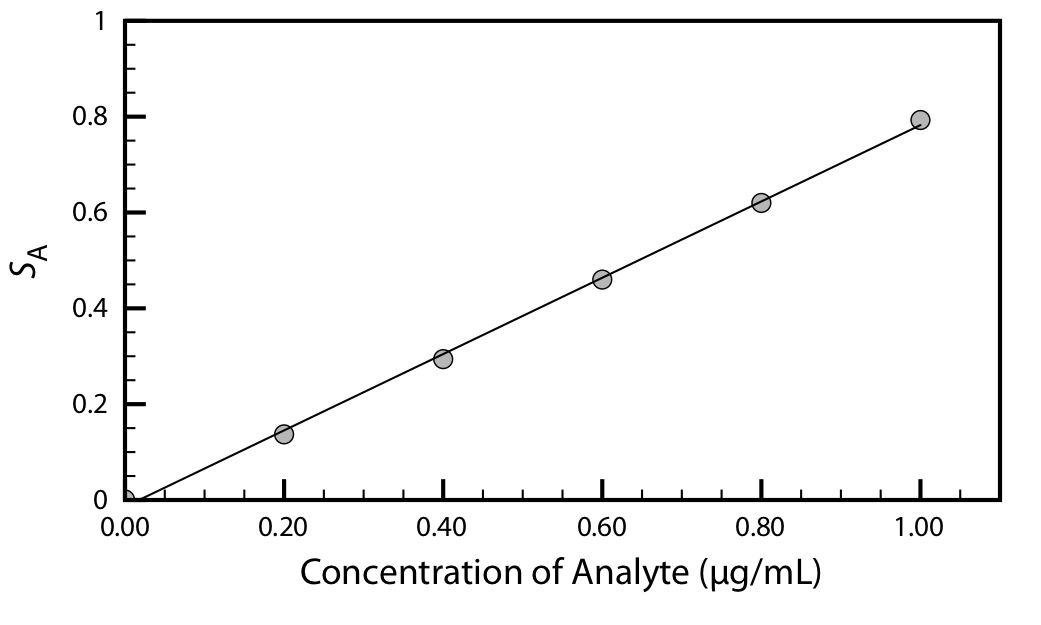
Con un solo estándar podemos calcular el valor de k A usando la Ecuación 3.3.1 o la Ecuación 3.3.2. Cuando se usan varios estándares con diferentes concentraciones de analito, el resultado se ve mejor visualmente trazando S A versus la concentración de analito en los estándares. Dicha gráfica se conoce como curva de calibración, un ejemplo de la cual se muestra en la Figura 3.5.1 .
Muestreo
Seleccionar un método apropiado y ejecutarlo correctamente nos ayuda a garantizar que nuestro análisis sea preciso. Sin embargo, si analizamos la muestra equivocada, entonces la precisión de nuestro trabajo es de poca importancia.
Una estrategia de muestreo adecuada asegura que nuestras muestras sean representativas del material del que se toman. El muestreo sesgado o no representativo y las muestras contaminantes durante o después de su recolección son dos ejemplos de errores de muestreo que pueden conducir a un error significativo en la precisión. Es importante darse cuenta de que los errores de muestreo son independientes de los errores en el método analítico. Como resultado, no podemos corregir un error de muestreo en el laboratorio, por ejemplo, evaluando un blanco de reactivo.
El capítulo 7 proporciona una discusión más detallada del muestreo, incluyendo estrategias para obtener muestras representativas.
Validación
Si queremos tener confianza en nuestro procedimiento debemos demostrar que puede proporcionar resultados aceptables, un proceso que llamamos validación. Quizás la parte más importante de validar un procedimiento es establecer que su precisión y exactitud son adecuadas para el problema que estamos tratando de resolver. También nos aseguramos de que el procedimiento escrito tenga suficiente detalle para que diferentes analistas o laboratorios obtengan resultados comparables. Idealmente, la validación utiliza una muestra estándar cuya composición coincide estrechamente con las muestras que analizaremos. En ausencia de estándares apropiados, podemos evaluar la precisión comparando los resultados con los obtenidos usando un método de precisión conocida.
Encontrará más detalles sobre la validación de métodos analíticos en el Capítulo 14.


