5.1: Señales analíticas
- Page ID
- 75803
Para estandarizar un método analítico utilizamos estándares que contienen cantidades conocidas de analito. La precisión de una estandarización, por lo tanto, depende de la calidad de los reactivos y de la cristalería que utilizamos para preparar estos estándares. Por ejemplo, en una valoración ácido-base, la estequiometría de la reacción ácido-base define la relación entre los moles de analito y los moles de valorante. A su vez, los moles de titulante son el producto de la concentración del valorante y el volumen de titulante utilizado para alcanzar el punto de equivalencia. La precisión de un análisis titrimétrico, por lo tanto, nunca es mejor que la precisión con la que conocemos la concentración del valorante.
Consulte el Capítulo 9 para una discusión exhaustiva de los métodos de análisis titrimétricos.
Estándares primarios y secundarios
Existen dos categorías de estándares analíticos: estándares primarios y estándares secundarios. Un estándar primario es un reactivo que podemos usar para dispensar una cantidad conocida de analito con precisión. Por ejemplo, una muestra de 0.1250-g de K 2 Cr 2 O 7 contiene\(4.249 \times 10^{-4}\) moles de K 2 Cr 2 O 7. Si colocamos esta muestra en un matraz aforado de 250 ml y diluimos a volumen, la concentración de K 2 Cr 2 O 7 en la solución resultante es\(1.700 \times 10^{-3} \text{ M}\). Un estándar primario debe tener una estequiometría conocida, una pureza (o ensayo) conocida, y debe ser estable durante el almacenamiento a largo plazo. Debido a que es difícil establecer con precisión el grado de hidratación, incluso después del secado, un reactivo hidratado generalmente no es un estándar primario.
Los reactivos que no cumplen con estos criterios son estándares secundarios. La concentración de un estándar secundario se determina en relación con un estándar primario. Se encuentran disponibles listas de estándares primarios aceptables (ver, por ejemplo, Smith, B. W.; Parsons, M. L. J. Chem. Educ. 1973, 50, 679—681; o Moody, J. R.; Green- burg, P. R.; Pratt, K. W.; Rains, T. C. Anal. Chem. 1988, 60, 1203A—1218A). En el apéndice 8 se ofrecen ejemplos de algunas normas primarias comunes.
El NaOH es un ejemplo de un estándar secundario. El NaOH disponible comercialmente contiene impurezas de NaCl, Na 2 CO 3 y Na 2 SO 4, y absorbe fácilmente H 2 O de la atmósfera. Para determinar la concentración de NaOH en una solución, la valoramos frente a un ácido débil estándar primario, como hidrógeno ftalato de potasio, KHC 8 H 4 O 4.
Otros Reactivos
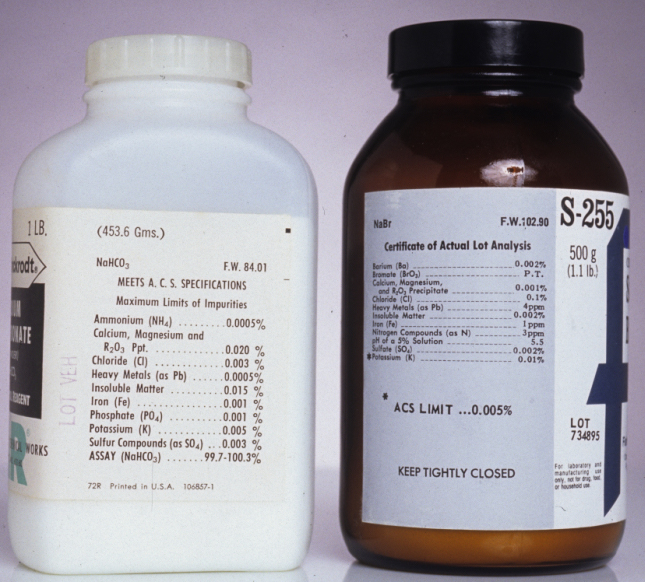
La preparación de un estándar a menudo requiere reactivos adicionales que no son estándares primarios o estándares secundarios, como un disolvente adecuado o reactivos necesarios para ajustar la matriz del estándar. Estos disolventes y reactivos son fuentes potenciales de analito adicional, que de no contabilizarse producen un error determinado en la estandarización. Si están disponibles, se utilizan productos químicos de grado reactivo que se ajustan a los estándares establecidos por la American Chemical Society [Committee on Analytical Reagent, Reagent Chemicals, 8a ed., American Chemical Society: Washington, D. C., 1993]. La etiqueta en la botella de un producto químico de grado reactivo (Figura 5.1.1 ) enumera los límites para impurezas específicas o proporciona un ensayo para las impurezas. Podemos mejorar la calidad de un producto químico de grado reactivo purificándolo o realizando un ensayo más preciso. Como se discutirá más adelante en el capítulo, podemos corregir las contribuciones al total de S a partir de reactivos utilizados en un análisis mediante la inclusión de una determinación de blanco apropiada en el procedimiento analítico.
Preparación de una solución estándar
A menudo es necesario preparar una serie de estándares, cada uno con una concentración diferente de analito. Podemos preparar estos estándares de dos maneras. Si el rango de concentraciones está limitado a uno o dos órdenes de magnitud, entonces cada solución se prepara mejor transfiriendo una masa o volumen conocido del estándar puro a un matraz volumétrico y diluyendo al volumen.
Cuando se trabaja con un rango mayor de concentraciones, particularmente un rango que se extiende por más de tres órdenes de magnitud, los estándares se preparan mejor mediante una dilución en serie a partir de una sola solución madre. En una dilución en serie preparamos el estándar más concentrado y luego diluimos una porción de esa solución para preparar el siguiente estándar más concentrado. A continuación, diluimos una porción del segundo estándar para preparar un tercer estándar, continuando con este proceso hasta que hayamos preparado todos nuestros estándares. Las diluciones en serie deben prepararse con especial cuidado porque un error en la preparación de un estándar se transmite a todos los estándares sucesivos.


