6.4: Constantes de equilibrio para reacciones químicas
- Page ID
- 75767
Varios tipos de reacciones químicas son importantes en la química analítica, ya sea en la preparación de una muestra para su análisis o durante el análisis. Las más significativas son las reacciones de precipitación, las reacciones ácido-base, las reacciones de complejación y las reacciones de oxidación-reducción. En esta sección revisamos estas reacciones y sus expresiones constantes de equilibrio.
Otro nombre común para una reacción de oxidación-reducción es una reacción redox, donde “rojo” es la abreviatura de reducción y “buey” es la abreviatura de oxidación.
Reacciones de precipitación
En una reacción de precipitación, dos o más especies solubles se combinan para formar un precipitado insoluble. La reacción de precipitación más común es una reacción de metátesis en la que dos compuestos iónicos solubles intercambian partes. Por ejemplo, si añadimos una solución de nitrato de plomo, Pb (NO 3) 2, a una solución de cloruro de potasio, se forma KCl, un precipitado de cloruro de plomo, PbCl 2. Usualmente escribimos una reacción de precipitación como una ecuación iónica neta, que muestra solo el precipitado y aquellos iones que forman el precipitado; así, la reacción de precipitación para PbCl 2 es
\[\mathrm{Pb}^{2+}(a q)+2 \mathrm{Cl}^{-}(a q) \rightleftharpoons \mathrm{PbCl}_{2}(s) \nonumber\]
Cuando escribimos la constante de equilibrio para una reacción de precipitación, nos enfocamos en la solubilidad del precipitado; así, para PbCl 2, la reacción de solubilidad es
\[\mathrm{PbCl}_{2}(s)\rightleftharpoons \mathrm{Pb}^{2+}(a q)+2 \mathrm{Cl}^{-}(a q) \nonumber\]
y su constante de equilibrio, o producto de solubilidad, K sp, es
\[K_{\mathrm{sp}}=\left[\mathrm{Pb}^{2+}\right]\left[\mathrm{Cl}^{-}\right]^{2} \label{6.1}\]
A pesar de que no aparece en la expresión K sp, es importante recordar que la Ecuación\ ref {6.1} es válida solo si PbCl 2 (s) está presente y en equilibrio con Pb 2 + y Cl —. Encontrará valores para productos de solubilidad seleccionados en el Apéndice 10.
Reacciones ácido-base
Una definición útil de ácidos y bases es la introducida independientemente en 1923 por Johannes Brønsted y Thomas Lowry. En la definición de Brønsted‐Lowry, un ácido es un donante de protones y una base es un aceptor de protones. Observe la conexión entre estas definiciones: definir una base como aceptor de protones implica que hay un ácido disponible para donar el protón. Por ejemplo, en reacción\ ref {6.2} ácido acético, CH 3 COOH, dona un protón al amoníaco, NH 3, que sirve como base.
Cuando un ácido y una base reaccionan, los productos son un nuevo ácido y una nueva base. Por ejemplo, el ion acetato, CH 3 COO —, en reacción\ ref {6.2} es una base que puede aceptar un protón del ion amonio ácido\(\text{NH}_4^+\), formando ácido acético y amoníaco. Llamamos al ion acetato la base conjugada del ácido acético, y llamamos al ion amonio el ácido conjugado del amoníaco.
Ácidos Fuertes y Débiles
La reacción de un ácido con su disolvente (típicamente agua) es una reacción de disociación ácida. Dividimos los ácidos en dos categorías, fuertes y débiles, en función de su capacidad para donar un protón al solvente. Un ácido fuerte, como el HCl, transfiere casi por completo su protón al disolvente, que actúa como base.
\[\mathrm{HCl}(a q)+\mathrm{H}_{2} \mathrm{O}(l) \rightarrow \mathrm{H}_{3} \mathrm{O}^{+}(a q)+\mathrm{Cl}^{-}(a q) \nonumber\]
Usamos una sola flecha (\(\rightarrow\)) en lugar de la flecha de equilibrio (\(\rightleftharpoons\)) porque tratamos el HCl como si se disociara completamente en una solución acuosa. En el agua, los ácidos fuertes comunes son el ácido clorhídrico (HCl), el ácido yodhídrico (HI), el ácido bromhídrico (HBr), el ácido nítrico (HNO 3), el ácido perclórico (HClO 4) y el primer protón del ácido sulfúrico (H 2 SO 4).
La fuerza de un ácido es una función del ácido y del disolvente. Por ejemplo, el HCl no actúa como un ácido fuerte en el metanol. En este caso usamos la flecha de equilibrio al escribir la reacción ácido-base.
\[\mathrm{HCl}+\mathrm{CH}_{3} \mathrm{OH}\rightleftharpoons \mathrm{CH}_{3} \mathrm{OH}_{2}^{+}+\mathrm{Cl}^{-} \nonumber\]
Un ácido débil, del cual el ácido acético acuoso es un ejemplo, no dona completamente su protón ácido al disolvente. En cambio, la mayor parte del ácido permanece sin disociar con solo una pequeña fracción presente como base conjugada.
\[\mathrm{CH}_{3} \mathrm{COOH}(a q)+\mathrm{H}_{2} \mathrm{O}(l)\rightleftharpoons \mathrm{H}_{3} \mathrm{O}^{+}(a q)+\mathrm{CH}_{3} \mathrm{COO}^{-}(a q) \nonumber\]
La constante de equilibrio para esta reacción es una constante de disociación ácida, K a, que escribimos como
\[K_{a}=\frac{\left[\mathrm{CH}_{3} \mathrm{COO}^{-}\right]\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]}{\left[\mathrm{CH}_{3} \mathrm{COOH}\right]}=1.75 \times 10^{-5} \nonumber\]
La magnitud de K proporciona información sobre la fuerza relativa de un ácido débil, con una K a más pequeña correspondiente a un ácido más débil. El ion amonio\(\text{NH}_4^+\), por ejemplo, tiene un K a de\(5.702 \times 10^{-10}\) y es un ácido más débil que el ácido acético.
Anteriormente notamos que omitimos sólidos puros y líquidos puros de expresiones constantes de equilibrio. Debido a que el disolvente, H 2 O, no es puro, quizás te preguntes por qué no lo hemos incluido en la expresión de K a del ácido acético. Recordemos que dividimos cada término en una expresión constante de equilibrio por su valor de estado estándar. Debido a que la concentración de H 2 O es tan grande, es de aproximadamente 55.5 mol/L, su concentración como líquido puro y como disolvente son prácticamente idénticas. La relación
\[\frac{\left[\mathrm{H}_{2} \mathrm{O}\right]}{\left[\mathrm{H}_{2} \mathrm{O}\right]^{\circ}} \nonumber\]
es esencialmente 1.00.
Un ácido débil monoprótico, como el ácido acético, tiene solo un único protón ácido y una sola constante de disociación ácida. Otros ácidos, como el ácido fosfórico, tienen múltiples protones ácidos, cada uno caracterizado por una constante de disociación ácida. A tales ácidos los llamamos polipróticos. El ácido fosfórico, por ejemplo, tiene tres reacciones de disociación ácida y tres constantes de disociación ácida.
\[\mathrm{H}_{3} \mathrm{PO}_{4}(a q)+\mathrm{H}_{2} \mathrm{O}(l) \rightleftharpoons \mathrm{H}_{3} \mathrm{O}^{+}(a q)+\mathrm{H}_{2} \mathrm{PO}_{4}^{-}(a q) \nonumber\]
\[K_{\mathrm{al}}=\frac{\left[\mathrm{H}_{2} \mathrm{PO}_{4}^{-}\right]\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]}{\left[\mathrm{H}_{3} \mathrm{PO}_{4}\right]}=7.11 \times 10^{-3} \nonumber\]
\[\mathrm{H}_{2} \mathrm{PO}_{4}^-(a q)+\mathrm{H}_{2} \mathrm{O}(l)\rightleftharpoons \mathrm{H}_{3} \mathrm{O}^{+}(a q)+\mathrm{HPO}_{4}^{2-}(a q) \nonumber\]
\[K_{a 2}=\frac{\left[\mathrm{HPO}_{4}^{2-}\right]\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]}{\left[\mathrm{H}_{2} \mathrm{PO}_{4}^-\right]}=6.32 \times 10^{-8} \nonumber\]
\[\mathrm{HPO}_{4}^{2-}(a q)+\mathrm{H}_{2} \mathrm{O}({l})\rightleftharpoons \mathrm{H}_{3} \mathrm{O}^{+}(a q)+\mathrm{PO}_{4}^{3-}(a q) \nonumber\]
\[K_{\mathrm{a} 3}=\frac{\left[\mathrm{PO}_{4}^{3-}\right]\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]}{\left[\mathrm{HPO}_{4}^{2-}\right]}=4.5 \times 10^{-13} \nonumber\]
La disminución de las constantes de disociación ácida de K a1 a K a3 nos dice que cada protón sucesivo es más difícil de eliminar. En consecuencia, H 3 PO 4 es un ácido más fuerte que\(\text{H}_2\text{PO}_4^-\), y\(\text{H}_2\text{PO}_4^-\) es un ácido más fuerte que\(\text{HPO}_4^{2-}\).
Bases Fuertes y Débiles
El ejemplo más común de una base fuerte es un hidróxido de metal alcalino, como el hidróxido de sodio, NaOH, que se disocia completamente para producir iones hidróxido.
\[\mathrm{NaOH}(s) \rightarrow \mathrm{Na}^{+}(a q)+\mathrm{OH}^{-}(a q) \nonumber\]
Una base débil, como el ion acetato, CH 3 COO —, solo acepta parcialmente un protón del disolvente, y se caracteriza por una constante de disociación de bases, K b. Por ejemplo, la reacción de disociación de bases y la constante de disociación de bases para el ion acetato son
\[\mathrm{CH}_{3} \mathrm{COO}^{-}(a q)+\mathrm{H}_{2} \mathrm{O}(l)\rightleftharpoons \mathrm{OH}^{-}(a q)+\mathrm{CH}_{3} \mathrm{COOH}(a q) \nonumber\]
\[K_{\mathrm{b}}=\frac{\left[\mathrm{CH}_{3} \mathrm{COOH}\right]\left[\mathrm{OH}^{-}\right]}{\left[\mathrm{CH}_{3} \mathrm{COO}^{-}\right]}=5.71 \times 10^{-10} \nonumber\]
Una base débil poliprótica, como un ácido poliprótico, tiene más de una reacción de disociación de bases y más de una constante de disociación de bases.
Especies anfipróticas
Algunas especies pueden comportarse como un ácido débil o como una base débil. Por ejemplo, las dos reacciones siguientes muestran la reactividad química del ion bicarbonato,\(\text{HCO}_3^-\), en agua.
Una especie que es tanto donante de protones como aceptor de protones se llama anfiprótica. El hecho de que una especie anfiprótica se comporte como ácido o como base depende de las constantes de equilibrio para las reacciones competidoras. Para el bicarbonato, la constante de disociación ácida para la reacción\ ref {6.3}
\[K_{a 2}=\frac{\left[\mathrm{CO}_{3}^{2-}\right]\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]}{\left[\mathrm{HCO}_{3}^{-}\right]}=4.69 \times 10^{-11} \nonumber\]
es menor que la constante de disociación de bases para la reacción\ ref {6.4}.
\[K_{\mathrm{b} 2}=\frac{\left[\mathrm{H}_{2} \mathrm{CO}_{3}\right]\left[\mathrm{OH}^{-}\right]}{\left[\mathrm{HCO}_{3}^{-}\right]}=2.25 \times 10^{-8} \nonumber\]
Debido a que el bicarbonato es una base más fuerte que un ácido, esperamos que una solución acuosa de\(\text{HCO}_3^-\) sea básica.
Disociación del agua
El agua es un solvente anfiprótico porque puede servir como ácido o como base. Una característica interesante de un disolvente anfiprótico es que es capaz de reaccionar consigo mismo en una reacción ácido-base.
Identificamos la constante de equilibrio para esta reacción como constante de disociación del agua, K w,
a una temperatura de 24 o C. El valor de K w varía sustancialmente con la temperatura. Por ejemplo, a 20 o C K w es\(6.809 \times 10^{-15}\), mientras que a 30 o C K w es\(1.469 \times 10^{-14}\). A 25 o C, K w es\(1.008 \times 10^{-14}\), que es lo suficientemente cercano a\(1.00 \times 10^{-14}\) eso podemos usar este último valor con un error insignificante.
Una consecuencia importante de la Ecuación\ ref {6.6} es que la concentración de H 3 O + y la concentración de OH — están relacionadas. Si conocemos [H 3 O +] para una solución, entonces podemos calcular [OH —] usando la Ecuación\ ref {6.6}.
¿Cuál es el [OH —] si el [H 3 O +] es\(6.12 \times 10^{-5}\) M?
Solución
\[\left[\mathrm{OH}^{-}\right]=\frac{K_{w}}{\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]}=\frac{1.00 \times 10^{-14}}{6.12 \times 10^{-5}}=1.63 \times 10^{-10} \nonumber\]
La Escala de pH
La ecuación\ ref {6.6} nos permite desarrollar una escala de pH (\(\text{pH} = - \log [\text{H}_3\text{O}^+]\)) que indica la acidez de una solución. Cuando las concentraciones de H 3 O + y OH — son iguales una solución no es ni ácida ni básica; es decir, la solución es neutra. Dejando
\[\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]=\left[\mathrm{OH}^{-}\right] \nonumber\]
sustituyendo en Ecuación\ ref {6.6}
\[K_{w}=\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]^{2}=1.00 \times 10^{-14} \nonumber\]
y resolviendo para [H 3 O +] da
\[\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]=\sqrt{1.00 \times 10^{-14}}=1.00 \times 10^{-7} \nonumber\]
Una solución neutra de agua a 25 o C tiene una concentración de iones hidronio de\(1.00 \times 10^{-7}\) M y un pH de 7.00. En una solución ácida la concentración de H 3 O + es mayor que la del OH —, lo que significa que
\[\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]>1.00 \times 10^{-7} \mathrm{M} \nonumber\]
El pH de una solución ácida, por lo tanto, es inferior a 7.00. Una solución básica, por otro lado, tiene un pH mayor a 7.00. La Figura 6.4.1 muestra la escala de pH y los valores de pH para algunas soluciones representativas.
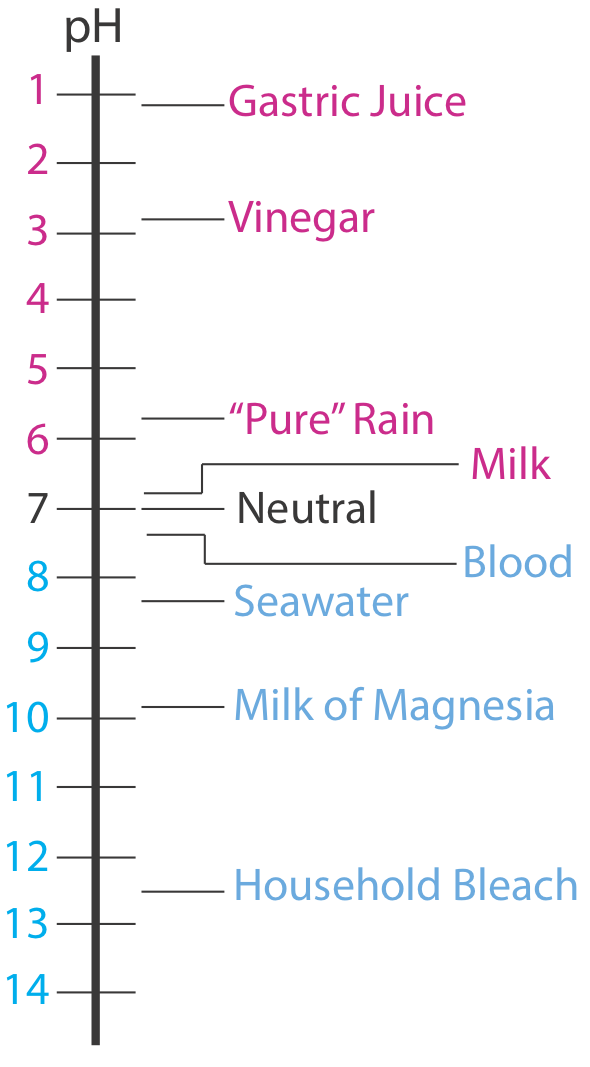
Tabulación de valores para K a y K b
Una observación útil sobre ácidos débiles y bases débiles es que la fuerza de una base débil es inversamente proporcional a la fuerza de su ácido débil conjugado. Consideremos, por ejemplo, las reacciones de disociación del ácido acético y el acetato.
La suma de estas dos reacciones da la reacción
\[2 \mathrm{H}_{2} \mathrm{O}(l)\rightleftharpoons \mathrm{H}_{3} \mathrm{O}^{+}(a q)+\mathrm{OH}^{-}(a q) \nonumber\]
para lo cual la constante de equilibrio es K w. Debido a que sumar dos reacciones equivale a multiplicar sus respectivas constantes de equilibrio, podemos expresar K w como el producto de K a para CH3COOH y K b para CH3COO —.
\[K_{\mathrm{w}}=K_{\mathrm{a}, \mathrm{CH}_{3} \mathrm{COOH}} \times K_{\mathrm{b}, \mathrm{CH}_{3} \mathrm{COO}^{-}} \nonumber\]
Para cualquier ácido débil, HA, y su base débil conjugada, A —, podemos generalizar esto a la siguiente ecuación
\[K_{\mathrm{w}}=K_{\mathrm{a}, \mathrm{HA}} \times K_{\mathrm{b}, \mathrm{A}^{-}} \label{6.9}\]
donde HA y A son un par de ácido-base conjugado. La relación entre K a y K b para un par conjugado ácido-base simplifica nuestra tabulación de las constantes de disociación ácida y base. El apéndice 11 incluye constantes de disociación ácida para una variedad de ácidos débiles. Para encontrar el valor de K b para una base débil, use la Ecuación\ ref {6.9} y el valor K a para su correspondiente ácido débil.
Un error común al usar la ecuación\ ref {6.9} es olvidar que se aplica solo a un par ácido — base conjugado.
Usando el Apéndice 11, calcule los valores para las siguientes constantes de equilibrio.
- K b para piridina, C 5 H 5 N
- K b para dihidrogenofosfato,\(\text{H}_2\text{PO}_4^-\)
Solución
\[\text { (a) } K_{\mathrm{b}, \mathrm{C}_5 \mathrm{H}_{5} \mathrm{N}}=\frac{K_{\mathrm{w}}}{K_{\mathrm{a}, \mathrm{C}_{\mathrm{5}} \mathrm{H}_{5} \mathrm{NH}^{+}}}=\frac{1.00 \times 10^{-14}}{5.90 \times 10^{-6}}=1.69 \times 10^{-9} \nonumber\]
\[\text { (b) } K_{\mathrm{b}, \mathrm{H}_2 \mathrm{PO}_{4}^- }=\frac{K_{\mathrm{w}}}{K_{\mathrm{a}, \mathrm{H}_{\mathrm{3}} \mathrm{PO}_{4} }}=\frac{1.00 \times 10^{-14}}{7.11 \times 10^{-3}}=1.41 \times 10^{-12} \nonumber\]
Al encontrar el valor K b para una base débil poliprótica, tenga cuidado de elegir el valor K a correcto. Recuerde que la Ecuación\ ref {6.9} se aplica solo a un par conjugado ácido-base. El ácido conjugado de\(\text{H}_2\text{PO}_4^-\) es H 3 PO 4, no\(\text{HPO}_4^{2-}\).
Usando el Apéndice 11, calcule los valores de K b para el oxalato de hidrógeno\(\text{HC}_2\text{O}_4^-\), y para el oxalato,\(\text{C}_2\text{O}_4^{2-}\).
- Contestar
-
El K b para el oxalato de hidrógeno es
\[K_{\mathrm{b}, \mathrm{HC}_{2} \mathrm{O}_{4}^-}=\frac{K_{\mathrm{w}}}{K_{\mathrm{a}, \mathrm{H}_{2} \mathrm{C}_{2} \mathrm{O}_{4}}}=\frac{1.00 \times 10^{-14}}{5.60 \times 10^{-2}}=1.79 \times 10^{-13} \nonumber\]
y el K b para oxalato es
\[K_{\mathrm{b}, \mathrm{C}_{2} \mathrm{O}_{4}^{2-}}=\frac{K_{\mathrm{w}}}{K_{\mathrm{a}, \mathrm{HC}_{2} \mathrm{O}_{\mathrm{4}}^-}}=\frac{1.00 \times 10^{-14}}{5.42 \times 10^{-5}}=1.85 \times 10^{-10} \nonumber\]
Como esperamos, el valor de K b para\(\text{C}_2\text{O}_4^{2-}\) es mayor que el de\(\text{HC}_2\text{O}_4^-\).
Reacciones de complejación
Una definición más general de ácidos y bases fue propuesta en 1923 por G. N. Lewis. La definición de Brønsted‐Lowry de ácidos y bases se centra en la capacidad de donación de protones de un ácido y la capacidad de aceptación de protones de una base. La teoría de Lewis, por otro lado, utiliza la ruptura y la formación de enlaces covalentes para describir ácidos y bases. En este tratamiento, un ácido es un aceptor de pares de electrones y una base en un donador de pares de electrones. Aunque podemos aplicar la teoría de Lewis al tratamiento de reacciones ácido-base, es más útil para tratar reacciones de complejación entre iones metálicos y ligandos.
La siguiente reacción entre el ion metálico Cd 2 + y el ligando NH 3 es típica de una reacción de complejación.
El producto de esta reacción es un complejo metal-ligando. Al escribir esta reacción mostramos el amoníaco como:NH 3, utilizando un par de puntos para enfatizar el par de electrones que dona a Cd 2 +. En reacciones posteriores omitiremos esta notación.
Constantes de formación de metal-ligando
Caracterizamos la formación de un complejo metal-ligando por una constante de formación, K f. Por ejemplo, la reacción de complejación entre Cd 2 + y NH 3, reacción\ ref {6.10}, tiene la siguiente constante de equilibrio.
\[K_{f}=\frac{\left[\mathrm{Cd}\left(\mathrm{NH}_{3}\right)_{4}^{2+}\right]}{\left[\mathrm{Cd}^{2+}\right]\left[\mathrm{NH}_{3}\right]^{4}}=5.5 \times 10^{7} \label{6.11}\]
El reverso de la reacción\ ref {6.10} es una reacción de disociación, que caracterizamos por una constante de disociación, K d, que es el recíproco de K f.
Muchas reacciones de complejación ocurren de manera escalonada. Por ejemplo, la reacción entre Cd 2 + y NH 3 implica cuatro reacciones sucesivas.
Para evitar ambigüedades, dividimos las constantes de formación en dos categorías. Una constante de formación escalonada, que designamos como Ki para la etapa i, describe la adición sucesiva de un ligando al complejo metal-ligando de la etapa anterior. Así, las constantes de equilibrio para las reacciones\ ref {6.12} —\ ref {6.15} son, respectivamente, K 1, K 2, K 3 y K 4. Una constante de formación global o acumulativa, que designamos como\(\beta_i\), describe la adición de i ligandos al ión metálico libre. La constante de equilibrio en la Ecuación\ ref {6.11} se identifica correctamente como\(\beta_4\), donde
\[\beta_{4}=K_{1} \times K_{2} \times K_{3} \times K_{4} \nonumber\]
En general
\[\beta_{n}=K_{1} \times K_{2} \times \cdots \times K_{n}=\prod_{i=1}^{n} K_{i} \nonumber\]
Las constantes de formación escalonadas y globales para los complejos metal-ligando seleccionados se encuentran en el Apéndice 12.
Complexación y solubilidad de metal-ligando
Una constante de formación describe la adición de uno o más ligandos a un ion metálico libre. Para encontrar la constante de equilibrio para una reacción de complejación que incluya un sólido, combinamos las expresiones K sp y Kf apropiadas. Por ejemplo, la solubilidad de AgCl aumenta en presencia de iones cloruro en exceso como resultado de la siguiente reacción de complejación.
Podemos escribir esta reacción como la suma de otras tres reacciones de equilibrio con constantes de equilibrio conocidas: la solubilidad de AgCl, la cual se describe por su reacción K sp
\[\mathrm{AgCl}(s) \rightleftharpoons \mathrm{Ag}^{+}(a q)+\mathrm{Cl}^{-}(a q) \nonumber\]
y la formación paso a paso de\(\text{AgCl}_2^-\), que se describe por las reacciones de K 1 y K 2.
\[\mathrm{Ag}^{+}(a q)+\mathrm{Cl}^{-}(a q) \rightleftharpoons \operatorname{Ag} \mathrm{Cl}(a q) \nonumber\]
\[\operatorname{AgCl}(a q)+\mathrm{Cl}^{-}(a q) \rightleftharpoons \operatorname{AgCl}_{2}^{-}(a q) \nonumber\]
La constante de equilibrio para la reacción\ ref {6.16}, por lo tanto, es\(K_\text{sp} \times K_1 \times K_2\).
Determinar el valor de la constante de equilibrio para la reacción
\[\mathrm{PbCl}_{2}(s)\rightleftharpoons \mathrm{PbCl}_{2}(a q) \nonumber\]
Solución
Podemos escribir esta reacción como la suma de otras tres reacciones. La primera de estas reacciones es la solubilidad de PbCl 2 (s), la cual se describe por su reacción K sp.
\[\mathrm{PbCl}_{2}(s)\rightleftharpoons \mathrm{Pb}^{2+}(a q)+2 \mathrm{Cl}^{-}(a q) \nonumber\]
Las dos reacciones restantes son la formación escalonada de PbCl 2 (ac), las cuales son descritas por K 1 y K 2.
\[\mathrm{Pb}^{2+}(a q)+\mathrm{Cl}^{-}(a q)\rightleftharpoons \mathrm{PbCl}^{+}(a q) \nonumber\]
\[\mathrm{PbCl}^{+}(a q)+\mathrm{Cl}^{-}(a q)\rightleftharpoons \mathrm{PbCl}_{2}(a q) \nonumber\]
Usando valores para K sp, K 1 y K 2 del Apéndice 10 y Apéndice 12, encontramos que la constante de equilibrio es
\[K=K_{\mathrm{sp}} \times K_{1} \times K_{2}=\left(1.7 \times 10^{-5}\right) \times 38.9 \times 1.62=1.1 \times 10^{-3} \nonumber\]
¿Cuál es la constante de equilibrio para la siguiente reacción? Encontrará las constantes de equilibrio adecuadas en el Apéndice 10 y el Apéndice 12.
\[\operatorname{Ag} \mathrm{Br}(s)+2 \mathrm{S}_{2} \mathrm{O}_{3}^{2-}(a q)\rightleftharpoons\operatorname{Ag}\left(\mathrm{S}_{2} \mathrm{O}_{3}\right)_2^{3-}(a q)+\mathrm{Br}^{-}(a q) \nonumber\]
- Contestar
-
Podemos escribir la reacción como una suma de otras tres reacciones. La primera reacción es la solubilidad de AgBr (s), que caracterizamos por su K sp.
\[\operatorname{AgBr}(s)\rightleftharpoons\operatorname{Ag}^{+}(a q)+\mathrm{Br}^{-}(a q) \nonumber\]
Las dos reacciones restantes son la formación escalonada de\(\text{Ag(S}_2\text{O}_3)_2^{3-}\), la cual caracterizamos por K 1 y K 2.
\[\mathrm{Ag}^{+}(a q)+\mathrm{S}_{2} \mathrm{O}_{3}^{2-}(a q)\rightleftharpoons\operatorname{Ag}\left(\mathrm{S}_{2} \mathrm{O}_{3}\right)^{-}(a q) \nonumber\]
\[\operatorname{Ag}\left(\mathrm{S}_{2} \mathrm{O}_{3}\right)^{-}(a q)+\mathrm{S}_{2} \mathrm{O}_{3}^{2-}(a q)\rightleftharpoons\operatorname{Ag}\left(\mathrm{S}_{2} \mathrm{O}_{3}\right)_{2}^{3-}(a q) \nonumber\]
Usando valores para K sp, K 1 y K 2 del Apéndice 10 y Apéndice 12, encontramos que la constante de equilibrio para nuestra reacción es
\[K=K_{sp} \times K_{1} \times K_{2}=\left(5.0 \times 10^{-13}\right)\left(6.6 \times 10^{8}\right)\left(7.1 \times 10^{4}\right)=23 \nonumber\]
Reacciones de Oxidación-Reducción (Redox)
Una reacción de oxidación-reducción ocurre cuando los electrones se mueven de un reactivo a otro reactivo. Como resultado de esta transferencia de electrones, los reactivos experimentan un cambio en el estado de oxidación. Aquellos reactivos que aumentan su estado de oxidación sufren oxidación, y el reactivo que disminuye su estado de oxidación sufre reducción. Por ejemplo, en la siguiente reacción redox entre Fe 3 + y ácido oxálico, H 2 C 2 O 4, el hierro se reduce debido a que su estado de oxidación cambia de +3 a +2.
El ácido oxálico, por otro lado, se oxida debido a que el estado de oxidación para el carbono aumenta de +3 en H 2 C 2 O 4 a +4 en CO 2.
Podemos dividir una reacción redox, como la reacción\ ref {6.17}, en medias reacciones separadas que muestran los procesos de oxidación y reducción.
\[\mathrm{H}_{2} \mathrm{C}_{2} \mathrm{O}_{4}(a q)+2 \mathrm{H}_{2} \mathrm{O}(l)\rightleftharpoons 2 \mathrm{CO}_{2}(g)+2 \mathrm{H}_{3} \mathrm{O}^{+}(a q)+2 e^{-} \nonumber\]
\[\mathrm{Fe}^{3+}(a q)+e^{-} \rightleftharpoons \mathrm{Fe}^{2+}(a q) \nonumber\]
Es importante recordar, sin embargo, que una reacción de oxidación y una reacción de reducción siempre ocurren como pareja. Formalizamos esta relación identificando como agente reductor el reactivo que se oxida, ya que proporciona los electrones para la media reacción de reducción. Por el contrario, el reactivo que se reduce es un agente oxidante. En la reacción\ ref {6.17}, Fe 3 + es el agente oxidante y H 2 C 2 O 4 es el agente reductor.
Los productos de una reacción redox también tienen propiedades redox. Por ejemplo, el Fe 2 + en reacción\ ref {6.17} se oxida a Fe 3 + cuando el CO 2 se reduce a H 2 C 2 O 4. Tomando prestada alguna terminología de la química ácido-base, Fe 2 + es el agente reductor conjugado del agente oxidante Fe 3 +, y CO 2 es el agente oxidante conjugado del agente reductor H 2 C 2 O 4.
Termodinámica de las Reacciones Redox
A diferencia de las reacciones de precipitación, reacciones ácido-base y reacciones de complejación, rara vez expresamos la posición de equilibrio de una reacción redox con una constante de equilibrio. Debido a que una reacción redox implica una transferencia de electrones de un agente reductor a un agente oxidante, es conveniente considerar la termodinámica de la reacción en términos del electrón.
Para una reacción en la que un mol de un reactivo sufre oxidación o reducción, la transferencia neta de carga, Q, en culombios es
\[Q=n F \nonumber\]
donde n es los moles de electrones por mol de reactivo, y F es la constante de Faraday (96485 C/mol). La energía libre, ∆G, para mover esta carga, Q, sobre un cambio de potencial, E, es
\[\triangle G=E Q \nonumber \]
El cambio en la energía libre (en kJ/mol) para una reacción redox, por lo tanto, es
\[\Delta G=-n F E \label{6.18}\]
donde ∆G tiene unidades de kJ/mol. El signo menos en la Ecuación\ ref {6.18} es el resultado de una convención diferente para asignar la dirección favorable de una reacción. En la termodinámica, se favorece una reacción cuando ∆G es negativa, pero se favorece una reacción de oxidación-reducción cuando E es positiva. Sustituyendo la ecuación\ ref {6.18} en la ecuación 6.2.3
\[-n F E=-n F E^{\circ}+R T \ln Q_r \nonumber\]
y dividiendo por — nF, conduce a la conocida ecuación de Nernst
\[E=E^{\circ}-\frac{R T}{n F} \ln Q_r \nonumber\]
donde E o es el potencial bajo condiciones de estado estándar. Sustituyendo los valores apropiados por R y F, suponiendo una temperatura de 25 o C (298 K), y cambiando de ln a log da el potencial en voltios como
\[E=E^{\mathrm{o}}-\frac{0.05916}{n} \log Q_r \label{6.19}\]
Potenciales estándar
El potencial estándar de una reacción redox, E o, proporciona una forma alternativa de expresar su constante de equilibrio y, por lo tanto, su posición de equilibrio. Debido a que una reacción en equilibrio tiene un □ G de cero, el potencial, E, también es cero en equilibrio. Sustituir estos valores en la Ecuación\ ref {6.19} y reordenarlos proporciona una relación entre E o y K
\[E^{\circ}=\frac{0.05916}{n} \log K \label{6.20}\]
Un potencial estándar es el potencial cuando todas las especies están en sus estados estándar. Puede recordar que definimos las condiciones de estado estándar de la siguiente manera: todos los gases tienen presiones parciales unitarias, todos los solutos tienen concentraciones unitarias y todos los sólidos y líquidos son puros.
Generalmente no tabulamos potenciales estándar para reacciones redox. En su lugar, calculamos E o usando los potenciales estándar para la media reacción de oxidación y la media reacción de reducción correspondientes. Por convención, se proporcionan potenciales estándar para las medias reacciones de reducción. El potencial estándar para una reacción redox, E o, es
\[E^{\circ}=E_{red}^{\circ}-E_{ox}^{\circ} \nonumber\]
donde\(E_{red}^{\circ}\) y\(E_{ox}^{\circ}\) son los potenciales de reducción estándar para la media reacción de reducción y la media reacción de oxidación.
Debido a que no podemos medir el potencial de una sola media reacción, asignamos arbitrariamente un potencial de reducción estándar de cero a una media reacción de referencia
\[2 \mathrm{H}_{3} \mathrm{O}^{+}(a q)+2 e^{-}\rightleftharpoons 2 \mathrm{H}_{2} \mathrm{O}(l)+\mathrm{H}_{2}(g) \nonumber\]
y reportar todos los demás potenciales de reducción relativos a esta referencia. El Apéndice 13 contiene una lista de potenciales de reducción estándar seleccionados. Cuanto más positivo sea el potencial de reducción estándar, más favorable será la reacción de reducción en condiciones de estado estándar. Por ejemplo, en condiciones de estado estándar la reducción de Cu 2 + a Cu (E o = +0.3419 V) es más favorable que la reducción de Zn 2 + a Zn (E o = —0.7618 V).
Calcular (a) el potencial estándar, (b) la constante de equilibrio, y (c) el potencial cuando [Ag +] = 0.020 M y [Cd 2 +] = 0.050 M, para la siguiente reacción a 25 o C.
\[\mathrm{Cd}(s)+2 \mathrm{Ag}^{+}(a q)\rightleftharpoons2 \mathrm{Ag}(s)+\mathrm{Cd}^{2+}(a q) \nonumber\]
Solución
(a) En esta reacción se oxida el Cd y se reduce el Ag +. El potencial celular estándar, por lo tanto, es
\[E^{\circ} = E^{\circ}_{\text{Ag}^+/ \text{Ag}} - E^{\circ}_{\text{Cd}^{2+}/ \text{Cd}} = 0.7996 - (-0.4030) = 1.2026 \ \text{V} \nonumber\]
(b) Para calcular la constante de equilibrio sustituimos los valores apropiados en la Ecuación\ ref {6.20}.
\[E^{\circ}=1.2026 \ \mathrm{V}=\frac{0.05916 \ \mathrm{V}}{2} \log K \nonumber\]
Resolver para K da la constante de equilibrio como
\[\begin{array}{l}{\log K=40.6558} \\ {K=4.527 \times 10^{40}}\end{array} \nonumber\]
(c) Para calcular el potencial cuando [Ag +] es 0.020 M y [Cd 2 +] es 0.050M, utilizamos la relación apropiada para el cociente de reacción, Q r, en la Ecuación\ ref {6.19}.
\[\begin{array}{c}{E=E^{\circ}-\frac{0.05916 \ \mathrm{V}}{n} \log \frac{\left[\mathrm{Cd}^{2+}\right]}{\left[\mathrm{Ag}^{+}\right]^{2}}} \\ {E=1.2026 \ \mathrm{V}-\frac{0.05916 \ \mathrm{V}}{2} \log \frac{0.050}{(0.020)^{2}}=1.14 \ \mathrm{V}}\end{array} \nonumber\]
Para la siguiente reacción a 25 o C
\[5 \mathrm{Fe}^{2+}(a q)+\mathrm{MnO}_{4}^{-}(a q)+8 \mathrm{H}^{+}(a q) \rightleftharpoons 5 \mathrm{Fe}^{3+}(a q)+\mathrm{Mn}^{2+}(a q)+4 \mathrm{H}_{2} \mathrm{O}(l) \nonumber\]
calcular (a) el potencial estándar, (b) la constante de equilibrio, y (c) el potencial bajo estas condiciones: [Fe 2 +] = 0.50 M, [Fe 3 +] = 0.10 M, [\(\text{MnO}_4^{-}\)] = 0.025 M, [Mn 2 +] = 0.015 M, y un pH de 7.00. Consulte el Apéndice 13 para conocer los potenciales de reducción de estado estándar.
- Contestar
-
Las dos medias reacciones son la oxidación de Fe 2 + y la reducción de\(\text{MnO}_4^-\).
\[\mathrm{Fe}^{2+}(a q) \rightleftharpoons \mathrm{Fe}^{3+}(a q)+e^{-} \nonumber\]
\[\mathrm{MnO}_{4}^{-}(a q)+8 \mathrm{H}^{+}(a q)+5 e^{-} \rightleftharpoons \mathrm{Mn}^{2+}(a q)+4 \mathrm{H}_{2} \mathrm{O}(l) \nonumber\]
Del Apéndice 13, los potenciales de reducción de estado estándar para estas medias reacciones son
\[E_{\text{Fe}^{3+}/\text{Fe}^{2+}}^{\circ} = 0.771 \ \text{V and } E_{\text{MnO}_4^-/\text{Mn}^{2+}}^{\circ} = 1.51 \ \text{V} \nonumber\]
(a) El potencial de estado estándar para la reacción es
\[E^{\circ} = E_{\text{MnO}_4^-/\text{Mn}^{2+}}^{\circ} - E_{\text{Fe}^{3+}/\text{Fe}^{2+}}^{\circ} = 1.51 \ \text{V} - 0.771 \ \text{V } = 0.74 \ \text{V} \nonumber\]
(b) Para calcular la constante de equilibrio sustituimos los valores apropiados en la Ecuación\ ref {6.20}.
\[E^{\circ}=0.74 \ \mathrm{V}=\frac{0.05916}{5} \log K \nonumber\]
Resolver para K da su valor como\(3.5 \times 10^{62}\).
(c) Para calcular el potencial bajo estas condiciones de estado no estándar, hacemos las sustituciones apropiadas en la ecuación de Nernst.
\[E=E^{\circ}-\frac{R T}{n F} \ln \frac{\left[\mathrm{Mn}^{2+}\right]\left[\mathrm{Fe}^{3+}\right]^{5}}{\left[\mathrm{MnO}_{4}^{-}\right]\left[\mathrm{Fe}^{2+}\right]^{5}\left[\mathrm{H}^{+}\right]^{8}} \nonumber\]
\[E=0.74-\frac{0.05916}{5} \log \frac{(0.015)(0.10)^{5}}{(0.025)(0.50)^{5}\left(1 \times 10^{-7}\right)^{8}}=0.12 \ \mathrm{V} \nonumber\]
Al escribir reacciones de precipitación, ácido-base y complejación metal-ligando, representamos la acidez como H 3 O +. Las reacciones redox más comúnmente se escriben usando H + en lugar de H 3 O +. Para la reacción en el Ejercicio 6.4.3 , podríamos sustituir H + por H 3 O + y aumentar el coeficiente estequiométrico para H 2 O de 4 a 12.


