6.6: Diagramas de escalera
- Page ID
- 75753
Cuando desarrollamos o evaluamos un método analítico, a menudo necesitamos entender cómo la química que tiene lugar afecta nuestros resultados. Supongamos que deseamos aislar Ag + precipitándolo como AgCl. Si también necesitamos controlar el pH, entonces debemos usar un reactivo que no afecte adversamente la solubilidad de AgCl. Es un error usar NH 3 para ajustar el pH, por ejemplo, porque aumenta la solubilidad de AgCl (ver reacción 6.5.4). Una de las principales fuentes de errores determinados en muchos métodos analíticos es no tener en cuenta las posibles interferencias químicas.
En esta sección presentamos el diagrama de escalera como una sencilla herramienta gráfica para visualizar la química de equilibrio. Utilizaremos diagramas de escalera para determinar qué reacciones ocurren cuando combinamos varios reactivos, para estimar la composición aproximada de un sistema en equilibrio y para evaluar cómo un cambio en las condiciones de la solución podría afectar un método analítico.
Aunque no específicamente sobre el tema de los diagramas de escalera tal como se desarrolla en esta sección, los siguientes trabajos proporcionan información de fondo apropiada: a) Runo, J. R.; Peters, D. G. J. Chem. Educ. 1993, 70, 708—713; b) Vale, J.; Fernández‐Pereira, C.; Alcalde, M. J. Chem. Educ. 1993, 70, 790—795; c) Fernández‐Pereira, C.; Vale, J. Chem. Educador 1996, 6, 1—18; d) Fernández‐ Pereira, C.; Vale, J.; Alcalde, M. Chem. Educador 2003, 8, 15—21; e) Fernández‐Pereira, C.; Alcalde, M.; Villegas, R.; Vale, J. J. Chem. Educ. 2007, 84, 520—525. Los diagramas de escalera son una gran herramienta para ayudarte a pensar intuitivamente sobre la química analítica. Haremos un uso frecuente de ellos en los capítulos a seguir.
Diagramas de escalera para equilibrios ácido-base
Usemos ácido acético, CH 3 COOH, para ilustrar el proceso que usaremos para dibujar e interpretar un diagrama de escalera ácido-base. Antes de dibujar el diagrama, sin embargo, consideremos la reacción de equilibrio con más detalle. La reacción de disociación ácida del ácido acético y la expresión constante de equilibrio son
\[\mathrm{CH}_{3} \mathrm{COOH}(a q)+\mathrm{H}_{2} \mathrm{O}(l)\rightleftharpoons \mathrm{H}_{3} \mathrm{O}^{+}(a q)+\mathrm{CH}_{3} \mathrm{COO}^{-}(a q) \nonumber\]
\[K_{\mathrm{a}}=\frac{\left[\mathrm{CH}_{3} \mathrm{COO}^{-}\right]\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]}{\left[\mathrm{CH}_{3} \mathrm{COOH}\right]}=1.75 \times 10^{-5} \nonumber\]
Primero, tomemos el logaritmo de cada término en esta ecuación y multipliquemos por —1
\[-\log K_{a}=4.76=-\log \left[\mathrm{H}_{3} \mathrm{O}^{+}\right]-\log \frac{\left[\mathrm{CH}_{3} \mathrm{COO}^{-}\right]}{\left[\mathrm{CH}_{3} \mathrm{COOH}\right]} \nonumber\]
Ahora, reemplacemos —log [H 3 O +] con pH y reorganicemos la ecuación para obtener el resultado que se muestra aquí.
La ecuación\ ref {6.1} nos dice mucho sobre la relación entre el pH y las cantidades relativas de ácido acético y acetato en equilibrio. Si las concentraciones de CH 3 COOH y CH 3 COO — son iguales, entonces la Ecuación\ ref {6.1} se reduce a
\[\mathrm{pH}=4.76+\log (1)=4.76+0=4.76 \nonumber\]
Si la concentración de CH 3 COO — es mayor que la de CH 3 COOH, entonces el término logarítmico en la Ecuación\ ref {6.1} es positivo y el pH es mayor que 4.76. Este es un resultado razonable porque esperamos que la concentración de la base conjugada, CH 3 COO —, aumente a medida que aumenta el pH. Razonamiento similar te convencerá de que el pH es inferior a 4.76 cuando la concentración de CH 3 COOH supera a la de CH 3 COO —.
Ahora estamos listos para construir el diagrama de escalera de ácido acético (Figura 6.6.1 ). Primero, dibujamos una flecha vertical que representa el pH de la solución, con niveles de pH más pequeños (más ácidos) en la parte inferior y niveles de pH más grandes (más básicos) en la parte superior. Segundo, trazamos una línea horizontal a un pH igual al valor p K a de ácido acético. Esta línea, o escalón en la escalera, divide el eje del pH en regiones donde CH 3 COOH o CH 3 COO — es la especie predominante. Esto completa el diagrama de escalera.
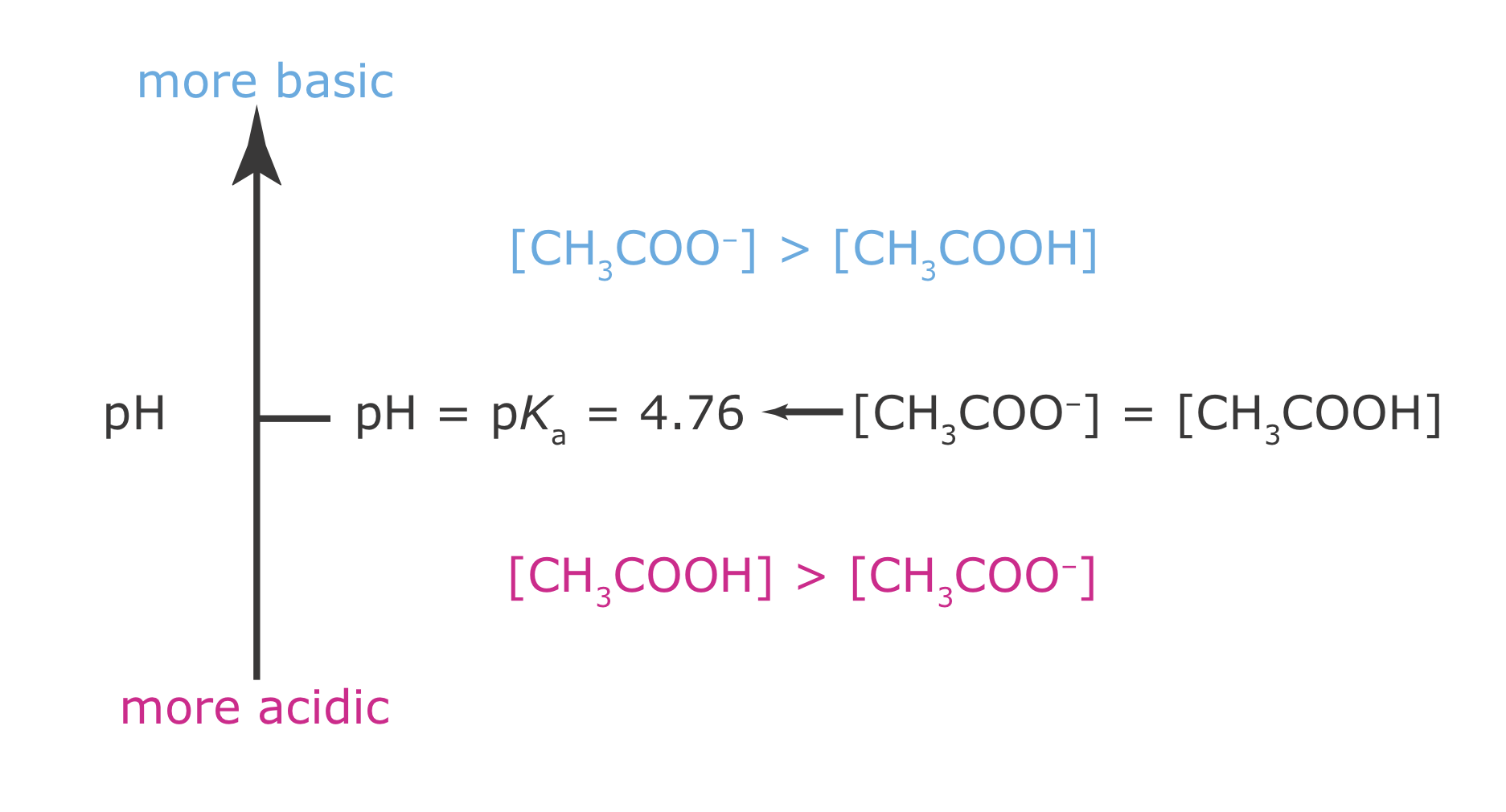
Usando el diagrama de escalera, es fácil identificar la forma predominante de ácido acético a cualquier pH. A un pH de 3.5, por ejemplo, el ácido acético existe principalmente como CH 3 COOH. Si agregamos suficiente base a la solución de tal manera que el pH aumente a 6.5, la forma predominante de ácido acético es CH 3 COO —.
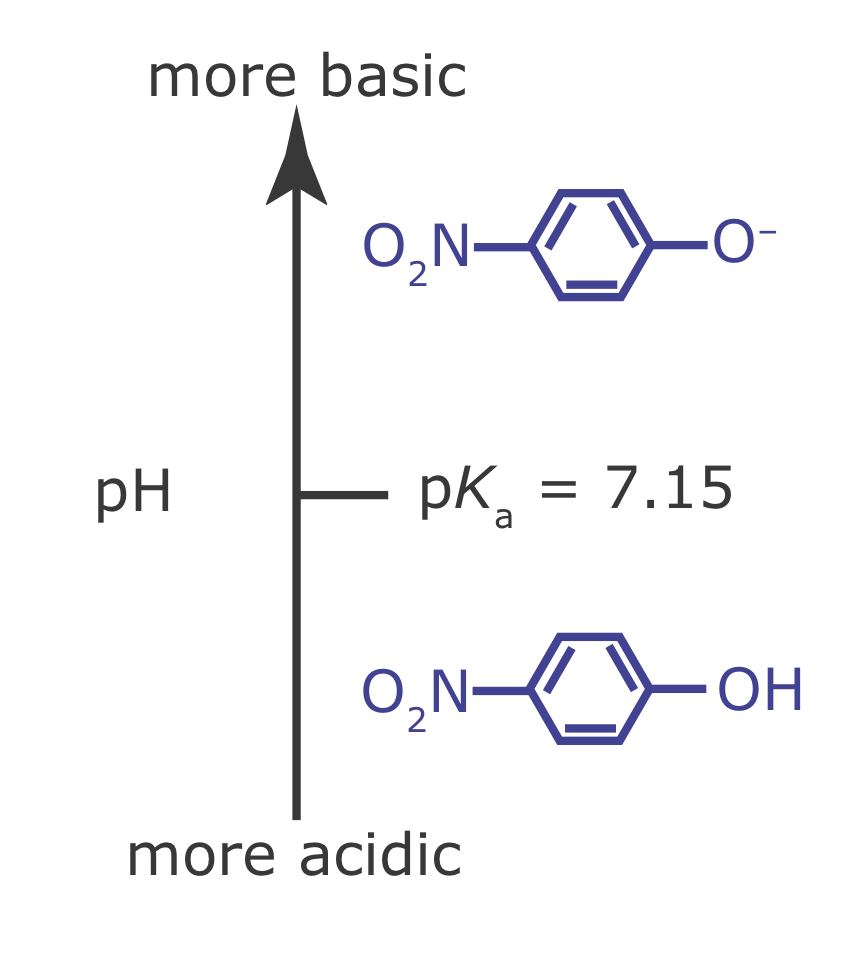
Dibuje un diagrama de escalera para la base débil p ‐nitrofenolato e identifique su forma predominante a un pH de 6.00.
Solución
Para dibujar un diagrama de escalera para una base débil, simplemente dibujamos el diagrama de escalera para su ácido débil conjugado. Del Apéndice 11, la p K a para p ‐nitrofenol es 7.15. El diagrama de escalera resultante se muestra en la Figura 6.6.2 . A un pH de 6.00, el p-nitrofenolato está presente principalmente en su forma ácida débil.
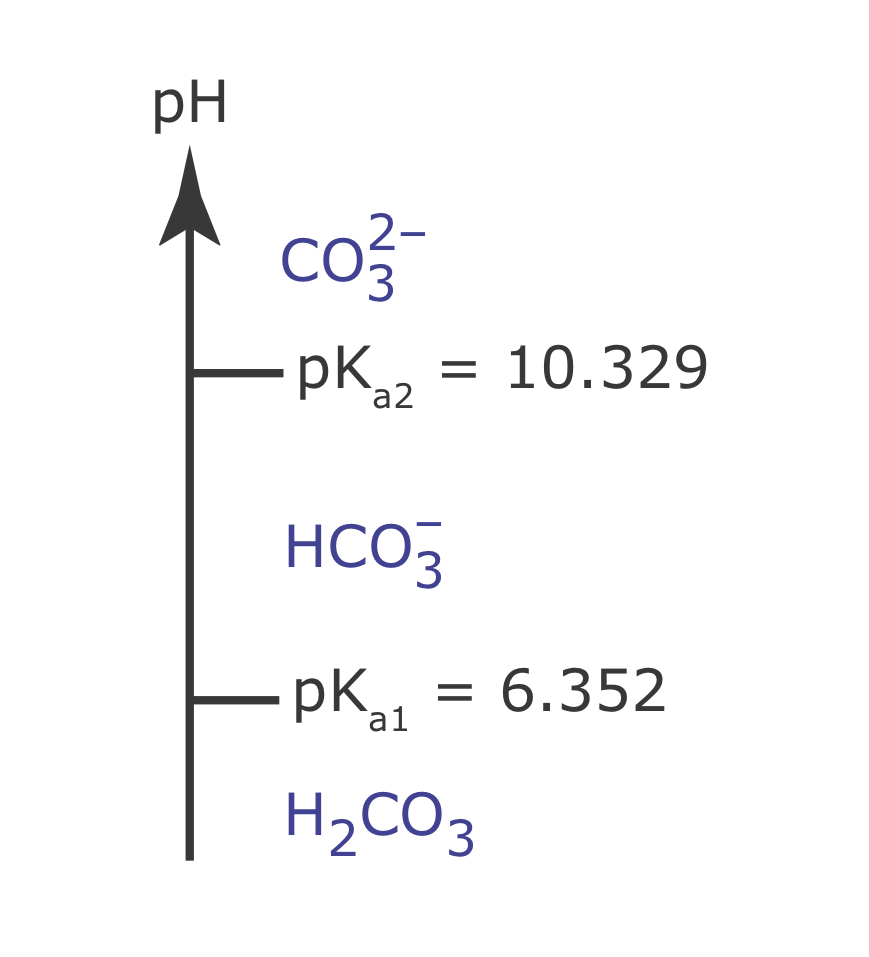
Dibuja un diagrama de escalera para ácido carbónico, H 2 CO 3. Debido a que H 2 CO 3 es un ácido débil diprótico, su diagrama de escalera tendrá dos escalones. ¿Cuál es la forma predominante del ácido carbónico cuando el pH es 7.00? Las constantes de equilibrio relevantes están en el Apéndice 11.
- Contestar
-
Del Apéndice 11, los valores de p K a para H 2 CO 3 son 6.352 y 10.329. A continuación se muestra el diagrama de escalera para H 2 CO 3. La forma predominante a un pH de 7.00 es\(\text{HCO}_3^-\).
Un diagrama de escalera es particularmente útil para evaluar la reactividad entre un ácido débil y una base débil. La Figura 6.6.3 , por ejemplo, muestra un diagrama de escalera simple para ácido acético/acetato y para p ‐nitrofenol/ p-nitrofenolato. Un ácido y una base no pueden coexistir si sus respectivas áreas de predominio no se superponen. Si mezclamos soluciones de ácido acético y p-nitrofenolato de sodio, la reacción
ocurre porque las áreas de predominio para ácido acético y p-nitrofenolato no se superponen. La composición final de la solución depende de qué especie es el reactivo limitante. El siguiente ejemplo muestra cómo podemos usar el diagrama de escalera en la Figura 6.6.3 para evaluar el resultado de mezclar soluciones de ácido acético y p-nitrofenolato.
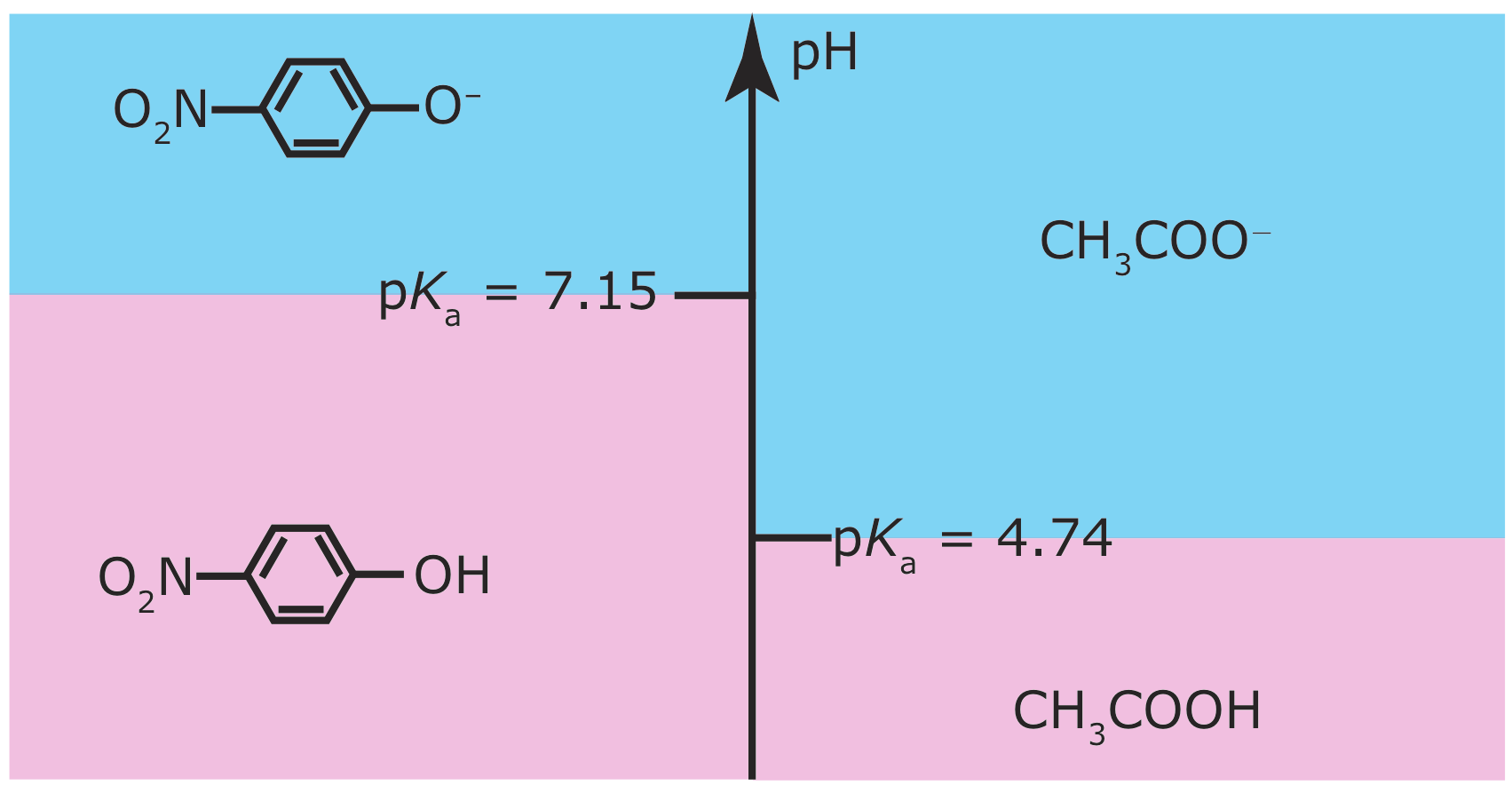
Predecir el pH aproximado y la composición final después de mezclar 0.090 moles de ácido acético y 0.040 moles de p-nitrofenolato.
Solución
El diagrama de escalera en la Figura 6.6.3 indica que la reacción entre ácido acético y p-nitrofenolato es favorable. Debido a que el ácido acético está en exceso, asumimos que la reacción del p-nitrofenolato al p-nitrofenol es completa. En equilibrio esencialmente no queda p-nitrofenolato y hay 0.040 mol de p-nitrofenol. La conversión de p-nitrofenolato en p-nitrofenol consume 0.040 moles de ácido acético; así
\[\begin{array}{c}{\text { moles } \mathrm{CH}_{3} \mathrm{COOH}=0.090-0.040=0.050 \ \mathrm{mol}} \\ {\text { moles } \mathrm{CH}_{3} \mathrm{COO}^{-}=0.040 \ \mathrm{mol}}\end{array} \nonumber\]
De acuerdo con el diagrama de escalera, el pH es de 4.74 cuando hay cantidades iguales de CH 3 COOH y CH 3 COO —. Debido a que tenemos un poco más de CH 3 COOH que CH 3 COO —, el pH es ligeramente inferior a 4.74.
Usando la Figura 6.6.3 , predecir el pH aproximado y la composición de la solución formada mezclando juntos 0.090 moles de p-nitrofenolato y 0.040 moles de ácido acético.
- Contestar
-
El diagrama de escalera en la Figura 6.6.3 indica que la reacción entre ácido acético y p-nitrofenolato es favorable. Debido a que el p-nitrofenolato está en exceso, asumimos que la reacción del ácido acético al acetato es completa. En equilibrio esencialmente no queda ácido acético y hay 0.040 moles de acetato. La conversión de ácido acético en acetato consume 0.040 moles de p-nitrofenolato; así
\[\text { moles } p \text {-nitrophenolate }=0.090-0.040=0.050 \text { mol } \nonumber\]
\[\text { moles } p\text{-nitrophenol }=0.040 \ \mathrm{mol} \nonumber\]
De acuerdo con el diagrama de escalera para este sistema, el pH es de 7.15 cuando hay concentraciones iguales de p-nitrofenol y p-nitrofenolato. Debido a que tenemos un poco más de p-nitrofenolato que p ‐nitrofenol, el pH es ligeramente superior a 7.15.
Si las áreas de predominio para un ácido y una base se superponen, entonces no esperamos que se produzca gran parte de una reacción. Por ejemplo, si mezclamos soluciones de CH 3 COO — y p-nitrofenol, no esperamos un cambio significativo en los moles de ninguno de los reactivos. Además, el pH de la mezcla debe estar entre 4.76 y 7.15, con el pH exacto dependiendo de las cantidades relativas de CH 3 COO — y p-nitrofenol.
También podemos usar un diagrama de escalera ácido-base para evaluar el efecto del pH en otros equilibrios. Por ejemplo, la solubilidad del CaF 2
\[\mathrm{CaF}_{2}(s) \rightleftharpoons \mathrm{Ca}^{2+}(a q)+2 \mathrm{F}^{-}(a q) \nonumber\]
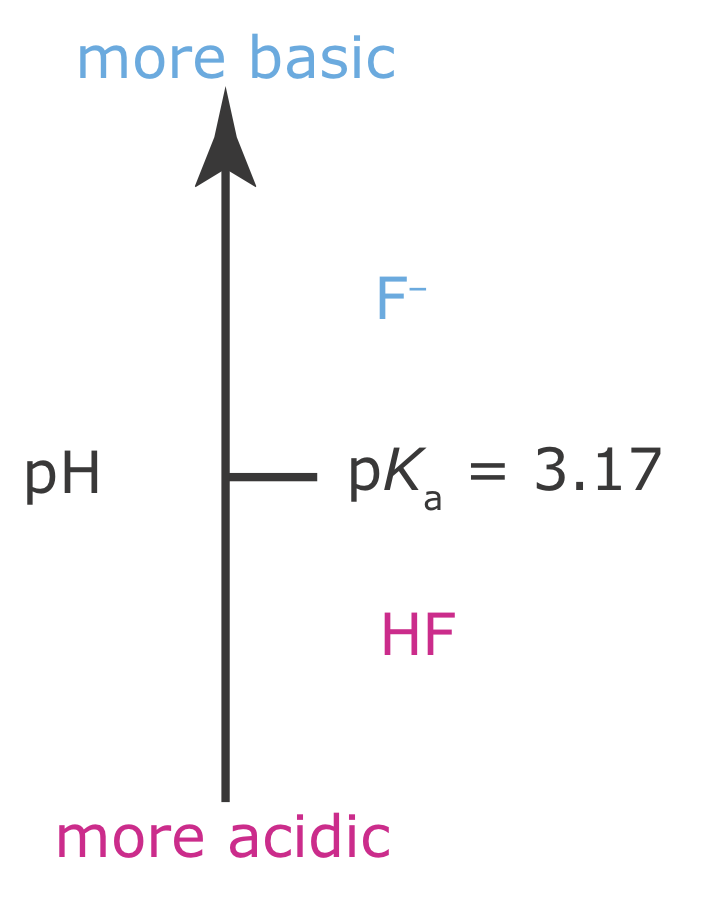
se ve afectado por el pH porque F — es una base débil. Por el principio de Le Chatelier, sabemos que la conversión de F — a HF aumentará la solubilidad del CaF 2. Para minimizar la solubilidad del CaF 2 necesitamos mantener el pH de la solución para que F — sea la especie predominante. El diagrama de escalera para HF (Figura 6.6.4 ) nos muestra que mantener un pH superior a 3.17 minimizará las pérdidas de solubilidad.
Diagramas de escalera para equilibrios de complejación
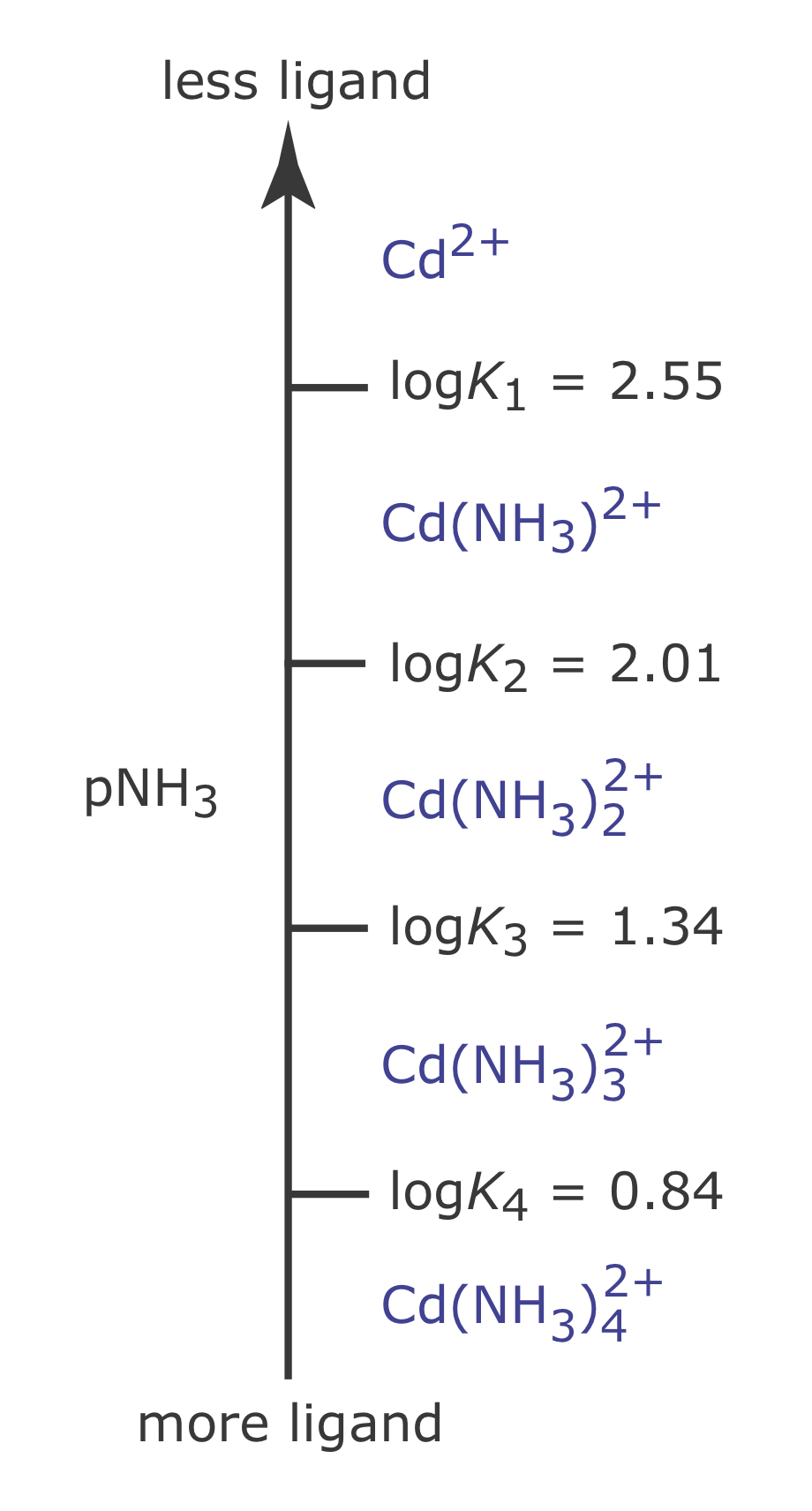
Podemos aplicar los mismos principios para construir e interpretar un diagrama de escalera ácido-base a equilibrios que involucran complejos metal-ligando. Para una reacción de complejación definimos la escala del diagrama de escalera usando la concentración de pL no complejado, o ligando libre. Usando la formación de\(\text{Cd(NH}_3)^{2+}\) como ejemplo
\[\mathrm{Cd}^{2+}(a q)+\mathrm{NH}_{3}(a q) \rightleftharpoons \mathrm{Cd}\left(\mathrm{NH}_{3}\right)^{2+}(a q) \nonumber\]
podemos mostrar que el log K1 es la línea divisoria entre las áreas de predominio para Cd 2 + y para\(\text{Cd(NH}_3)^{2+}\).
\[K_{1}=3.55 \times 10^{2}=\frac{\left[\mathrm{Cd}\left(\mathrm{NH}_{3}\right)^{2+}\right]}{\left[\mathrm{Cd}^{2+}\right]\left[\mathrm{NH}_{3}\right]} \nonumber\]
\[\log K_{1}=\log \left(3.55 \times 10^{2}\right)=\log \frac{\left[\mathrm{Cd}\left(\mathrm{NH}_{3}\right)^{2+}\right]}{\left[\mathrm{Cd}^{2+}\right]}-\log \left[\mathrm{NH}_{3}\right] \nonumber\]
\[\log K_{1}=2.55=\log \frac{\left[\mathrm{Cd}\left(\mathrm{NH}_{3}\right)^{2+}\right]}{\left[\mathrm{Cd}^{2+}\right]}+\mathrm{p} \mathrm{NH}_{3} \nonumber\]
\[\mathrm{p} \mathrm{NH}_{3}=\log K_{1}+\log \frac{\left[\mathrm{Cd}^{2+}\right]}{\left[\mathrm{Cd}\left(\mathrm{NH}_{3}\right)^{2+}\right]}=2.55+\log \frac{\left[\mathrm{Cd}^{2+}\right]}{\left[\mathrm{Cd}\left(\mathrm{NH}_{3}\right)^{2+}\right]} \nonumber\]
Así, Cd 2 + es la especie predominante cuando PnH 3 es mayor a 2.55 (una concentración de NH 3 menor que\(2.82 \times 10^{-3}\) M) y para un valor de PnH 3 menor a 2.55,\(\text{Cd(NH}_3)^{2+}\) es la especie predominante. La Figura 6.6.5 muestra un diagrama completo de escalera metal-ligando para Cd 2 + y NH 3 que incluye complejos Cd-NH 3 adicionales.
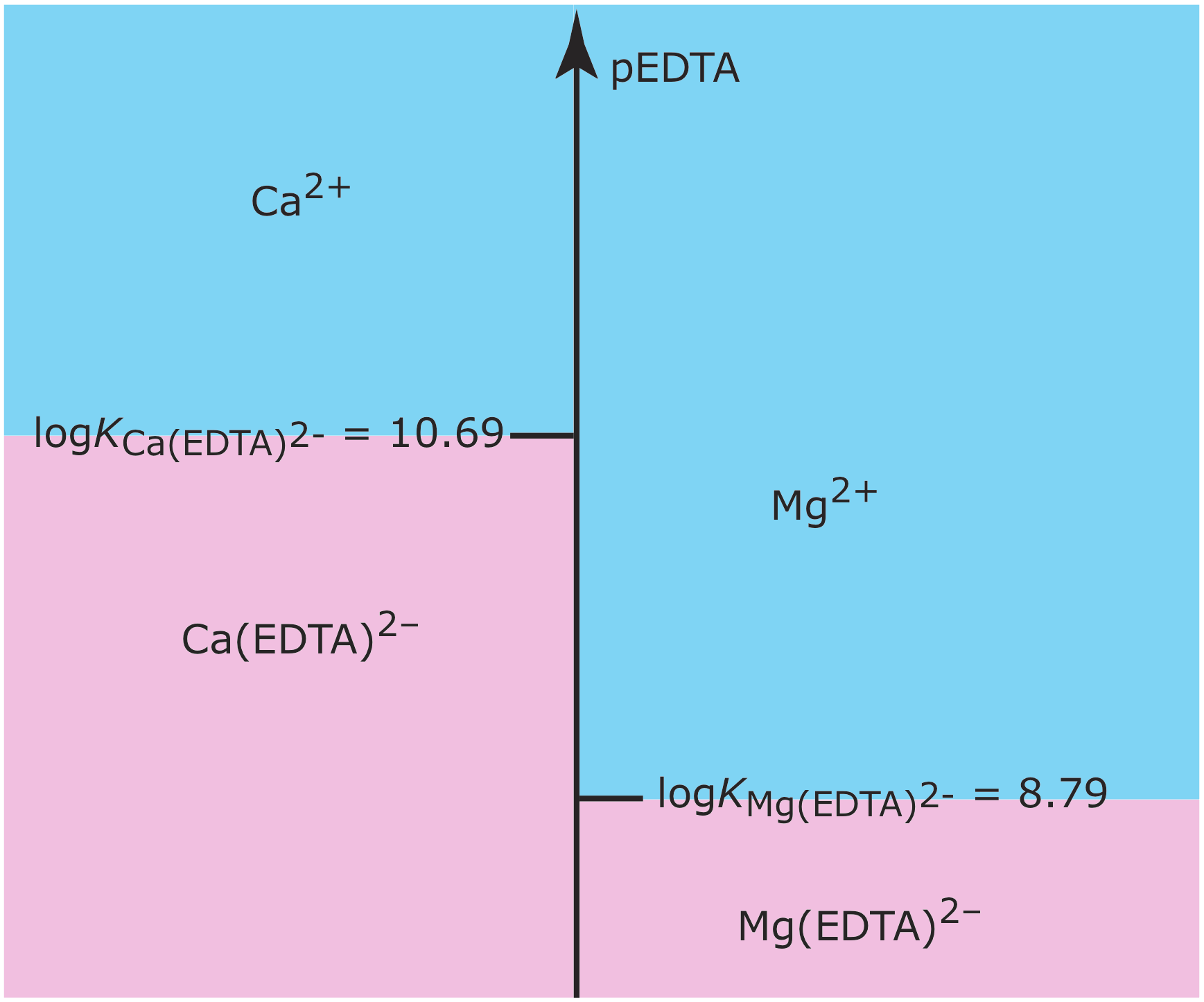
Dibuje un diagrama de escalera simple para los complejos Ca (EDTA) 2— y Mg (EDTA) 2-metal—ligando. Utilice su diagrama de escalera para predecir el resultado de agregar 0.080 moles de Ca 2 + a 0.060 moles de Mg (EDTA) 2—. EDTA es una abreviatura para el ligando ácido etilendiaminotetraacético.
Solución
La Figura 6.6.6 muestra el diagrama de escalera para este sistema de complejos metal-ligando. Debido a que las regiones de predominancia para Ca 2 + y Mg (EDTA) 2‐ no se superponen, la reacción
\[\mathrm{Ca}^{2+}(a q)+\mathrm{Mg}(\mathrm{EDTA})^{2-}(a q) \rightleftharpoons \mathrm{Ca}(\mathrm{EDTA})^{2-}(a q)+\mathrm{Mg}^{2+}(a q) \nonumber\]
procede esencialmente a su finalización. Debido a que Ca 2 + es el exceso de reactivo, la composición de la solución final es aproximadamente
\[\text { moles } \mathrm{Ca}^{2+}=0.080-0.060=0.020 \ \mathrm{mol} \nonumber\]
\[\text { moles } \mathrm{Ca}(\mathrm{EDTA})^{2-}=0.060 \ \mathrm{mol} \nonumber\]
\[\text { moles } \mathrm{Mg}^{2+}=0.060 \ \mathrm{mol} \nonumber\]
\[\text { moles } \mathrm{Mg}(\mathrm{EDTA})^{2-}=0 \ \mathrm{mol} \nonumber\]
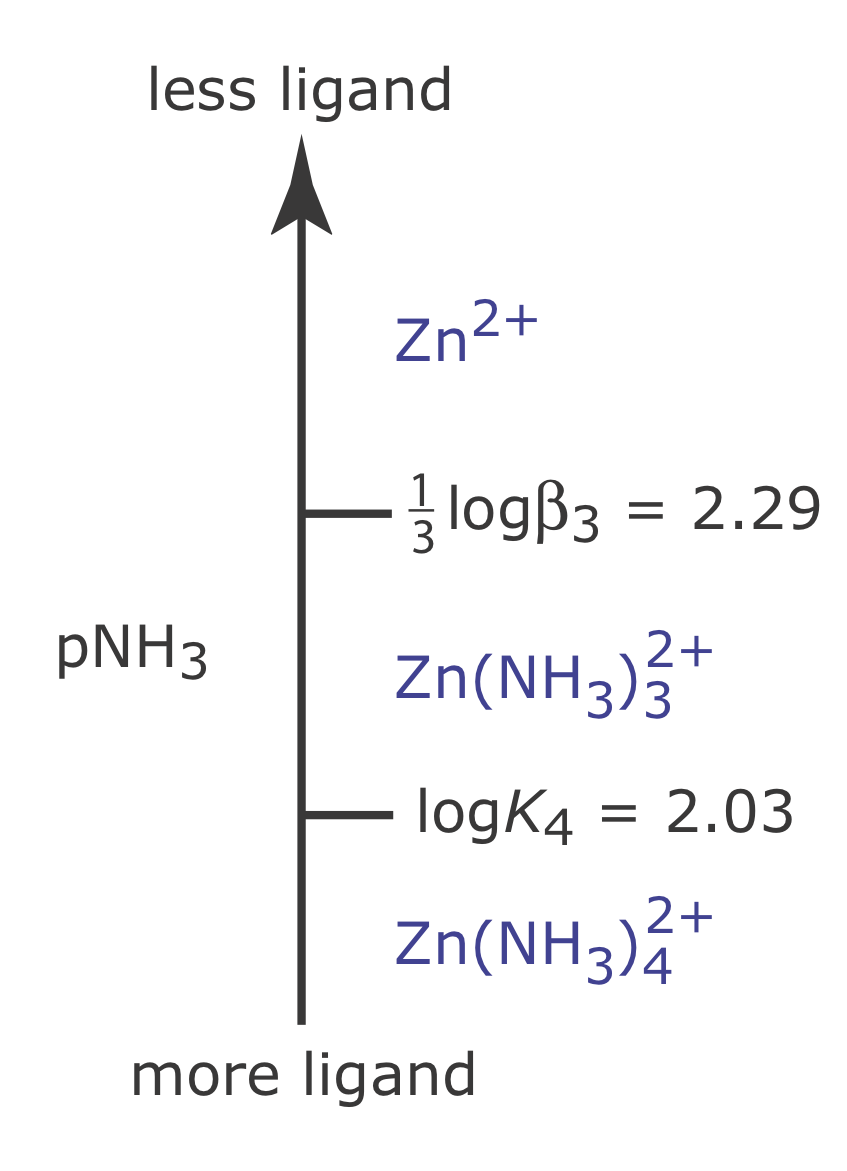
El diagrama de escalera metal-ligando en la Figura 6.6.5 utiliza constantes de formación escalonadas. También podemos construir un diagrama de escalera usando constantes de formación acumulativas. Por ejemplo, las tres primeras constantes de formación paso a paso para la reacción de Zn 2 + con NH 3
\[\mathrm{Zn}^{2+}(a q)+\mathrm{NH}_{3}(a q) \rightleftharpoons \mathrm{Zn}\left(\mathrm{NH}_{3}\right)^{2+}(a q) \quad K_{1}=1.6 \times 10^{2} \nonumber\]
\[\mathrm{Zn}\left(\mathrm{NH}_{3}\right)^{2+}(a q)+\mathrm{NH}_{3}(a q)\rightleftharpoons\mathrm{Zn}\left(\mathrm{NH}_{3}\right)_{2}^{2+}(a q) \quad K_{2}=1.95 \times 10^{2} \nonumber\]
\[\mathrm{Zn}\left(\mathrm{NH}_{3}\right)_{2}^{2+}(a q)+\mathrm{NH}_{3}(a q)=\mathrm{Zn}\left(\mathrm{NH}_{3}\right)_{3}^{2+}(a q) \quad K_{3}=2.3 \times 10^{2} \nonumber\]
sugiere que la formación de\(\text{Zn(NH}_3)_3^{2+}\) es más favorable que la formación de\(\text{Zn(NH}_3)^{2+}\) o\(\text{Zn(NH}_3)_2^{2+}\). Por esta razón, el equilibrio se representa mejor por la reacción de formación acumulativa que se muestra aquí.
\[\mathrm{Zn}^{2+}(a q)+3 \mathrm{NH}_{3}(a q)\rightleftharpoons \mathrm{Zn}\left(\mathrm{NH}_{3}\right)_{3}^{2+}(a q) \quad \beta_{3}=7.2 \times 10^{6} \nonumber\]
Debido a que K 3 es mayor que K 2, que es mayor que K1, la formación del complejo metal‐ligando\(\text{Zn(NH}_3)_3^{2+}\) es más favorable que la formación de los otros complejos de ligando metálico. Por esta razón, a valores menores de pNH 3 la concentración de\(\text{Zn(NH}_3)_3^{2+}\) es mayor que las concentraciones de\(\text{Zn(NH}_3)^{2+}\) o\(\text{Zn(NH}_3)_2^{2+}\). El valor de\(\beta_3\) es
\[\beta_{3}=K_{1} \times K_{2} \times K_{3} \nonumber\]
Para ver cómo incorporamos esta constante de formación acumulativa en un diagrama de escalera, comenzamos con la expresión de la constante de equilibrio de la reacción.
\[\beta_{3}=\frac{\left[\mathrm{Zn}\left(\mathrm{NH}_{3}\right)_{3}^{2+}\right]}{\left[\mathrm{Zn}^{2+}\right]\left[\mathrm{NH}_{3}\right]^{3}} \nonumber\]
Tomando el tronco de cada lado
\[\log \beta_{3}=\log \frac{\left[\mathrm{Zn}\left(\mathrm{NH}_{3}\right)_{3}^{2+}\right]}{\left[\mathrm{Zn}^{2+}\right]}-3 \log \left[\mathrm{NH}_{3}\right] \nonumber\]
y reorganizar da
\[\mathrm{pNH}_{3}=\frac{1}{3} \log \beta_{3}+\frac{1}{3} \log \frac{\left[\mathrm{Zn}^{2+}\right]}{\left[\mathrm{Zn}\left(\mathrm{NH}_{3}\right)_{3}^{2+}\right]} \nonumber\]
Cuando las concentraciones de Zn y\(\text{Zn(NH}_3)_3^{2+}\) son iguales, entonces
\[\mathrm{p} \mathrm{NH}_{3}=\frac{1}{3} \log \beta_{3}=2.29 \nonumber\]
En general, para el complejo metal-ligando ML n, el paso para una constante de formación acumulativa es
\[\mathrm{pL}=\frac{1}{n} \log \beta_{n} \nonumber\]
La figura 6.6.7 muestra el diagrama completo de escalera para el sistema Zn 2 + —NH 3.
Diagramas de escalera para equilibrios de oxidación/reducción
También podemos construir diagramas de escalera para ayudarnos a evaluar los equilibrios redox. La figura 6.6.8 muestra un diagrama de escalera típico para dos medias reacciones en las que la escala es el potencial, E.
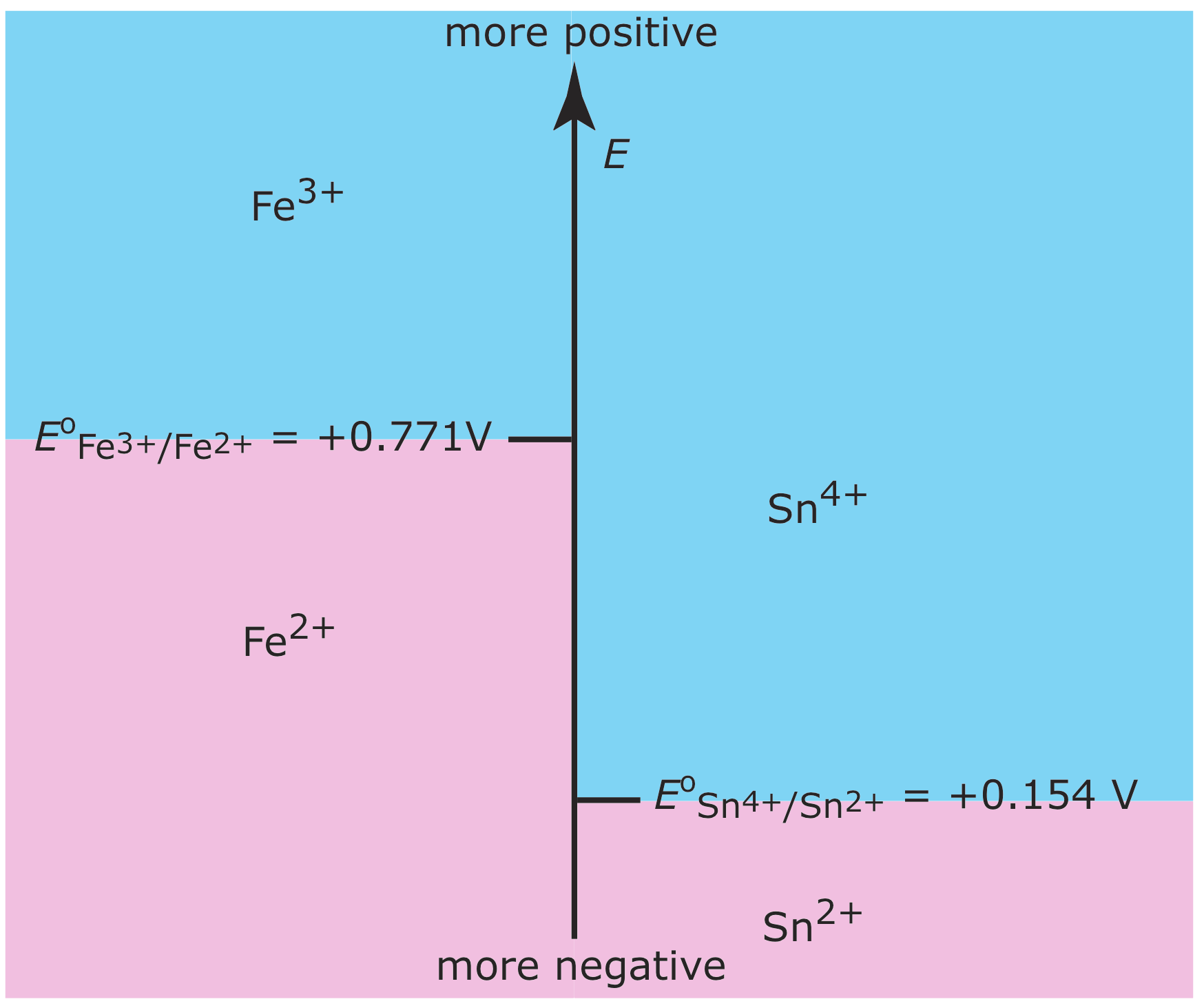
La ecuación de Nernst define las áreas de predominio. Usando la media reacción Fe 3 + /Fe 2 + como ejemplo, escribimos
\[E=E^{\circ}-\frac{R T}{n F} \ln \frac{\left[\mathrm{Fe}^{2+}\right]}{\left[\mathrm{Fe}^{3+}\right]}=0.771-0.05916 \log \frac{\left[\mathrm{Fe}^{2+}\right]}{\left[\mathrm{Fe}^{3+}\right]} \nonumber\]
A un potencial más positivo que el potencial estatal estándar, la especie predominante es Fe 3 +, mientras que Fe 2 + predomina a potenciales más negativos que E o. Cuando se acopla con el paso para la media reacción de Sn 4 + /Sn 2+ vemos que Sn 2 + es un agente reductor útil para Fe 3 +. Si Sn 2 + está en exceso, el potencial de la solución resultante es cercano a +0.154 V.
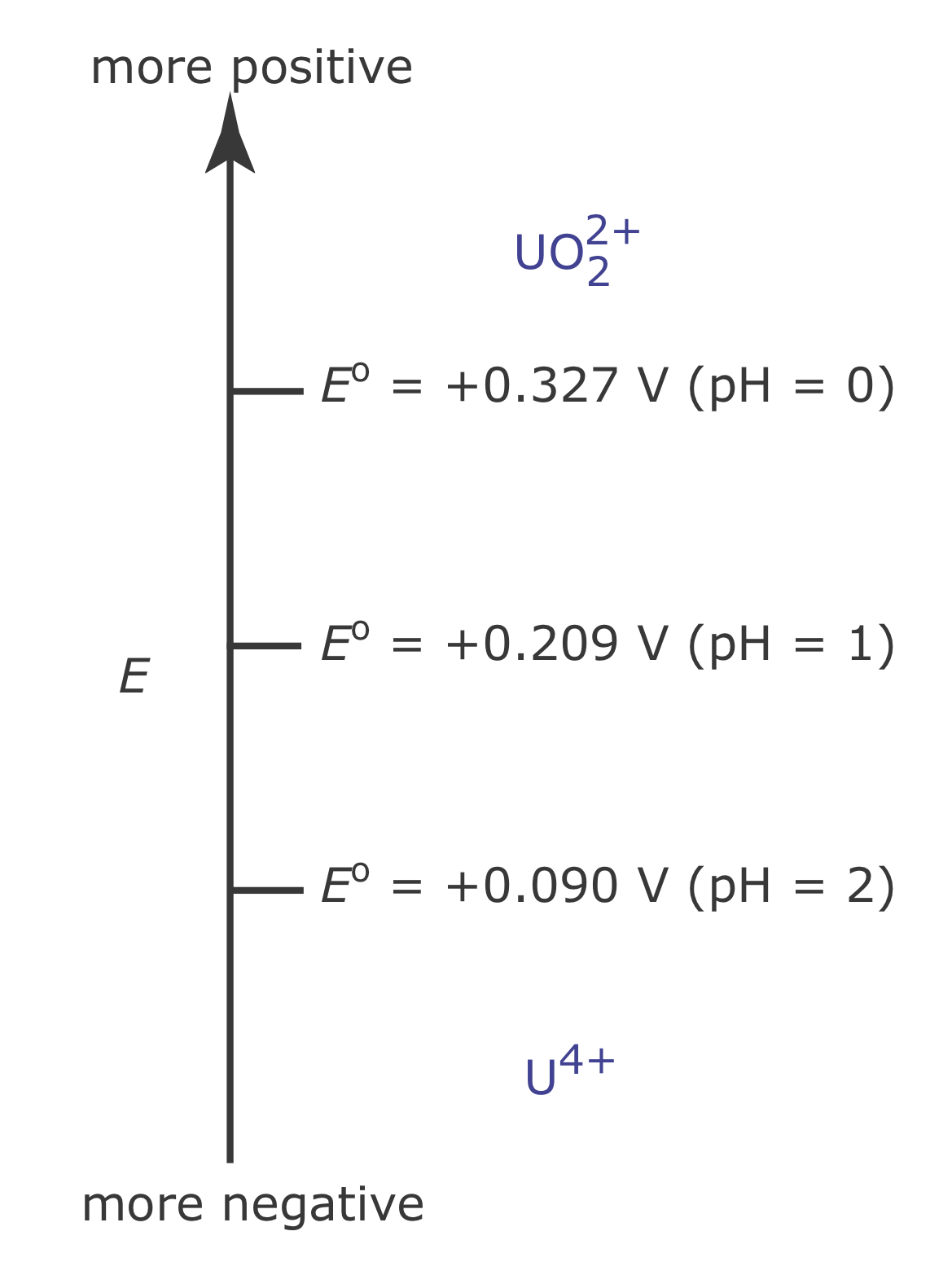
Debido a que los pasos en un diagrama de escala redox son potenciales de estado estándar, surge una complicación si los solutos distintos del agente oxidante y el agente reductor están presentes en concentraciones de estado no estándar. Por ejemplo, el potencial de la media reacción
\[\mathrm{UO}_{2}^{2+}(a q)+4 \mathrm{H}_{3} \mathrm{O}^{+}(a q)+2 e^{-} \rightleftharpoons \mathrm{U}^{4+}(a q)+6 \mathrm{H}_{2} \mathrm{O}(l) \nonumber\]
depende del pH de la solución. Para definir áreas de predominio en este caso comenzamos con la ecuación de Nernst
\[E=+0.327-\frac{0.05916}{2} \log \frac{\left[\mathrm{U}^{4+}\right]}{\left[\mathrm{UO}_{2}^{2+}\right]\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]^{4}} \nonumber\]
y factorizar la concentración de H 3 O +.
\[E=+0.327+\frac{0.05916}{2} \log \left[\mathrm{H}_{3} \mathrm{O}^{+}\right]^{4}-\frac{0.05916}{2} \log \frac{\left[\mathrm{U}^{4+}\right]}{\left[\mathrm{UO}_{2}^{2+}\right]}\nonumber\]
A partir de esta ecuación vemos que el área de predominio para\(\text{UO}_2^{2+}\) y U 4+ se define por un paso a un potencial donde [U 4+] = [\(\text{UO}_2^{2+}\)].
\[E=+0.327+\frac{0.05916}{2} \log \left[\mathrm{H}_{3} \mathrm{O}^{+}\right]^{4}=+0.327-0.1183 \mathrm{pH} \nonumber\]
La Figura 6.6.9 muestra cómo el pH afecta el paso para la media-reacción\(\text{UO}_2^{2+}\) /U 4+.