7.9: Problemas
- Page ID
- 76002
1. Debido al riesgo de intoxicación por plomo, la exposición de los niños a la pintura a base de plomo es una preocupación importante para la salud pública. El primer paso en el análisis cuantitativo de plomo en astillas de pintura seca es disolver la muestra. Corl evaluó varias técnicas de disolución [Corl, W. E. Spectroscopy 1991, 6 (8), 40—43]. Se recolectaron muestras de pintura y luego se pulverizaron usando un mortero y mano de mortero Pyrex. Se tomaron porciones replicadas de la pintura en polvo para su análisis. La siguiente tabla muestra los resultados para una muestra de pintura y para un material de referencia estándar. Tanto las muestras como los estándares se digirieron con HNO 3 en una placa caliente.
|
Replicar |
% p/p de Pb en la muestra |
% p/p Pb en Estándar |
|---|---|---|
|
1 |
5.09 |
11.48 |
|
2 |
6.29 |
11.62 |
|
3 |
6.64 |
11.47 |
|
4 |
4.63 |
11.86 |
a) Determinar la varianza general, la varianza debida al método y la varianza por muestreo. b) ¿Qué porcentaje de la varianza general se debe al muestreo? c) ¿Cómo podría disminuir la varianza por muestreo?
2. Para analizar un envío de 100 barriles de un solvente orgánico, planea recolectar una sola muestra de cada uno de los 10 barriles seleccionados al azar. ¿De qué barriles se deben recolectar muestras si el primer barril viene dado por la duodécima entrada en la tabla de números aleatorios del Apéndice 14, con barriles posteriores dados por cada tercer ingreso? Supongamos que las entradas en la tabla de números aleatorios están ordenadas por filas.
3. La concentración de O 2 disuelto en un lago muestra un ciclo diario a partir del efecto de la fotosíntesis, y un ciclo anual debido a cambios estacionales en la temperatura. Sugerir un plan de muestreo sistemático apropiado para monitorear el cambio diario en O 2 disuelto. Sugerir un plan de muestreo sistemático adecuado para monitorear el cambio anual en O 2 disuelto.
4. Los datos de la siguiente tabla se recolectaron durante un estudio preliminar del pH de una corriente de aguas residuales industriales.
| tiempo (hr) | pH | tiempo (hr) | pH |
|---|---|---|---|
|
0.5 |
4.4 | 9.0 | 5.7 |
|
1.0 |
4.8 | 9.5 | 5.5 |
| 1.5 | 5.2 | 10.0 | 6.5 |
| 2.0 | 5.2 | 10.5 | 6.0 |
| 2.5 | 5.6 | 11.0 | 5.8 |
| 3.0 | 5.4 | 11.5 | 6.0 |
| 3.5 | 5.4 | 12.0 | 5.6 |
| 4.0 | 4.4 | 12.5 | 5.6 |
| 4.5 | 4.8 | 13.0 | 5.4 |
| 5.0 | 4.8 | 13.5 | 4.9 |
| 5.5 | 4.2 | 14.0 | 5.2 |
| 6.0 | 4.2 | 14.5 | 4.4 |
| 6.5 | 3.8 | 15.0 | 4.0 |
| 7.0 | 4.0 | 15.5 | 4.5 |
| 7.5 | 4.0 0 | 16.0 | 4.0 |
| 8.0 | 3.9 | 16.5 | 5.0 |
| 8.5 | 4.7 | 17.0 | 5.0 |
Preparar una figura que muestre cómo cambia el pH en función del tiempo y sugiere una frecuencia de muestreo adecuada para un programa de monitoreo a largo plazo.
5. Se le ha pedido monitorear las fluctuaciones diarias del ozono atmosférico en la zona centro de una ciudad para determinar si existe relación entre los patrones de tráfico diarios y los niveles de ozono. a) ¿Cuál de los siguientes planes de muestreo utilizará y por qué: aleatorio, sistemático, crítico, sistemático—crítico o estratificado? b) ¿Planea recolectar y analizar una serie de muestras de captura, o formará una sola muestra compuesta? (c) ¿Cambiarán sus respuestas a estas preguntas si su objetivo es determinar si el nivel promedio diario de ozono supera un valor umbral? En caso afirmativo, ¿cuál es su nueva estrategia de muestreo?
6. La distinción entre una población homogénea y una heterogénea es importante cuando desarrollamos un plan de muestreo. a) Definir homogéneo y heterogéneo. b) Si se recolecta y analiza una sola muestra, ¿se puede determinar si la población es homogénea o heterogénea?
7. Comenzando con la ecuación 7.2.2, derivar la ecuación 7.2.3. Supongamos que las partículas son esféricas con un radio de r y una densidad de d.
8. La constante de muestreo para el radioisótopo 24 Na en hígado humano homogeneizado es aproximadamente 35 g [Kratochvil, B.; Taylor, J. K. Anal. Chem. 1981, 53, 924A—938A]. a) ¿Cuál es la desviación estándar relativa esperada para el muestreo si analizamos muestras de 1.0-g? b) ¿Cuántas muestras de 1.0-g debemos analizar para obtener un error de muestreo máximo de ± 5% al nivel de confianza del 95%?
9. Engels e Ingamells reportaron los siguientes resultados para el% w/w K 2 O en una mezcla de anfibolita y ortoclasa [Engels, J. C.; Ingamells, C. O. Geochim. Cosmochim. Acta 1970, 34, 1007—1017].
|
0.247 |
0.300 |
0.236 |
|
0.247 |
0.275 |
0.212 |
|
0.258 |
0.311 |
0.304 |
|
0.258 |
0.330 |
0.187 |
Cada una de las 12 muestras tuvo una masa nominal de 0.1 g. Utilizando estos datos se calcula el valor aproximado para K s, y luego, utilizando este valor para K s, determinar la masa nominal de muestra necesaria para lograr una desviación estándar relativa porcentual de 2%.
10. Se reportaron los siguientes datos para la determinación de KH 2 PO 4 en una mezcla de KH 2 PO 4 y NaCl [Guy, R. D.; Ramaley, L.; Wentzell, P. D. J. Chem. Educ. 1998, 75, 1028—1033].
| masa nominal (g) | masa real (g) | % w/w KH 2 PO 4 |
|---|---|---|
| 0.10 | 0.1039 | 0.085 |
| 0.1015 | 1.078 | |
| 0.1012 | 0.413 | |
| 0.1010 | 1.248 | |
| 0.1060 | 0.654 | |
| 0.0997 | 0.507 | |
| 0.25 |
0.2515 |
0.847 |
|
0.2465 |
0.598 |
|
|
0.2770 |
0.431 |
|
|
0.2460 |
0.842 |
|
|
0.2485 |
0.964 |
|
|
0.2590 |
1.178 |
|
| 0.50 |
0.5084 |
1.009 |
|
0.4954 |
0.947 |
|
|
0.5286 |
0.618 |
|
|
0.5232 |
0.744 |
|
|
0.4965 |
0.572 |
|
|
0.4995 |
0.709 |
|
| 1.00 |
1.027 |
0.696 |
|
0.987 |
0.843 | |
|
0.991 |
0.535 | |
|
0.998 |
0.750 | |
|
0.997 |
0.711 | |
| 1.001 | 0.639 | |
| 2.50 | 2.496 | 0.766 |
| 2.504 | 0.769 | |
| 2.496 | 0.682 | |
| 2.496 | 0.609 | |
| 2.557 | 0.589 | |
| 2.509 | 0.617 |
(a) Preparar una gráfica de% w/w KH 2 PO 4 vs. la masa real de la muestra. ¿Esta gráfica es consistente con su comprensión de los factores que afectan la varianza del muestreo? (b) Para cada masa nominal, calcular el porcentaje de desviación estándar relativa, R exp, con base en los datos. El valor de K s para este análisis se estima en 350. Utilice este valor de K s para determinar el porcentaje teórico de desviación estándar relativa, R theo, debido al muestreo. Teniendo en cuenta estos cálculos, ¿cuál es su conclusión sobre la importancia de los errores de muestreo indeterminados para este análisis? (c) Por cada masa nominal, convertir R theo a una desviación estándar absoluta. Traza puntos en tu gráfica que correspondan a ±1 desviaciones estándar absolutas sobre el promedio general% w/w KH 2 PO 4 para todas las muestras. Dibuja curvas suaves a través de estos dos conjuntos de puntos. ¿La muestra aparece homogénea en la escala a la que se muestrea?
11.En este problema recogerás y analizarás datos para simular el proceso de muestreo. Obtén un paquete de M&M's (u otros dulces similares). Recoge una muestra de cinco caramelos y cuenta el número que son rojos (o cualquier otro color de tu elección). Informe el resultado de su análisis como% rojo. Devolver los caramelos a la bolsa, mezclar bien y repetir el análisis para un total de 20 determinaciones. Calcula la media y la desviación estándar para tus datos. Retire todos los caramelos de la bolsa y determine el verdadero% rojo para la población. El muestreo en este ejercicio debe seguir estadísticas binomiales. Calcule el valor medio esperado y la desviación estándar esperada, y compare con sus resultados experimentales.
12. Determinar el error (\(\alpha = 0.05\)) para las siguientes situaciones. En cada caso supongamos que la varianza para una sola determinación es 0.0025 y que la varianza para recolectar una sola muestra es 0.050. a) Se colectan nueve muestras, cada una analizada una vez. b) Se recolecta una muestra y se analiza nueve veces. c) Se colectan cinco muestras, cada una analizada dos veces.
13. ¿Cuál de los esquemas de muestreo en el problema 12 es mejor si se desea limitar el error general a menos de ±0.30 y el costo para recolectar una sola muestra es de $1 y el costo para analizar una sola muestra es de $10? ¿Cuál es el mejor esquema de muestreo si el costo para recolectar una sola muestra es de $7 y el costo para analizar una sola muestra es de $3?
14. Maw, Witry y Emond evaluaron un método de digestión por microondas para Hg contra el método estándar de digestión en recipiente abierto [Maw, R.; Witry, L.; Emond, T. Spectroscopy 1994, 9, 39—41]. El método estándar requiere una digestión de 2 horas y es intensivo para el operador. La digestión por microondas se completa en aproximadamente 0.5 hr y requiere poco monitoreo por parte del operador. Se recolectaron muestras de polvo de bolsa de equipos de control de contaminación del aire de un incinerador de desechos peligrosos y se digirieron por triplicado antes de determinar la concentración de Hg en ppm. Los resultados se resumen en las dos tablas siguientes.
| ppm Hg después de la digestión con microondas | |||
|---|---|---|---|
| muestra | replicar 1 | replicar 2 | replicar 3 |
| 1 | 7.12 | 7.66 | 7.17 |
| 2 | 16.1 | 15.7 | 15.6 |
| 3 | 4.89 | 4.62 | 4.28 |
| 4 | 9.64 | 9.03 | 8.44 |
| a | 6.76 | 7.22 | 7.50 |
| 6 | 6.19 | 6.61 | 7.61 |
| 7 | 9.44 | 9.56 | 10.7 |
| 8 | 30.8 | 29.0 | 26.3 |
| ppm Hg después de la digestión estándar | |||
|---|---|---|---|
| muestra | replicar 1 | replicar 2 | replicar 3 |
| 1 | 5.60 | 5.54 | 5.40 |
| 2 | 13.1 | 13.8 | 13.0 |
| 3 | 5.39 | 5.12 | 5.36 |
| 4 | 6.50 | 6.52 | 7.20 |
| a | 6.20 | 6.03 | 5.77 |
| 6 | 6.25 | 5.65 | 5.61 |
| 7 | 15.0 | 13.9 | 14.0 |
| 8 | 20.4 | 16.1 | 20.0 |
¿El método de digestión por microondas produce resultados aceptables cuando se compara con el método de digestión estándar?
15. Simpson, Apte y Batley investigaron métodos para conservar muestras de agua recolectadas de ambientes anóxicos (O 2 -pobres) que tienen altas concentraciones de sulfuro disuelto [Simpson, S. L.: Apte, S. C.; Batley, G. E. Anal. Chem. 1998, 70, 4202—4205]. Encontraron que la conservación de muestras de agua con HNO 3 (un método común para conservar muestras aeróbicas) dio errores determinados negativos significativos al analizar para Cu 2 +. Preservar muestras agregando primero H 2 O 2 y luego agregando HNO 3 eliminó el error determinado. Explicar sus observaciones.
16. En un análisis particular el coeficiente de selectividad, K A, I, es de 0.816. Cuando una muestra estándar con una relación analito-interferente de 5:1 se lleva a través del análisis, el error al determinar el analito es +6.3%. (a) Determinar la recuperación aparente para el analito si R I =0. (b) Determinar la aparente recuperación del interferente si R A = 0.
17. La cantidad de Co en un mineral se determina mediante un procedimiento para el cual Fe en un interferente. Para evaluar la precisión del procedimiento, se analiza una muestra estándar de mineral que se sabe que tiene una relación Co/Fe de 10.2. Cuando se toman muestras puras de Co y Fe mediante el procedimiento se obtienen las siguientes relaciones de calibración
\[S_{\mathrm{Co}}=0.786 \times m_{\mathrm{Co}} \text { and } S_{\mathrm{Fe}}=0.699 \times m_{\mathrm{Fe}} \nonumber\]
donde S es la señal y m es la masa de Co o Fe. Cuando se toman 278.3 mg de Co a través de la etapa de separación, se recuperan 275.9 mg. Solo se recuperan 3.6 mg de Fe cuando se lleva una muestra de 184.9 mg de Fe a través de la etapa de separación. Calcular (a) las recuperaciones para Co y Fe; (b) el factor de separación; (c) la relación de selectividad; (d) el error si no se intenta separar el Co y el Fe; (e) el error si se lleva a cabo la etapa de separación; y (f) la recuperación máxima posible para Fe si la recuperación para Co es 1.00 y la máxima permitida el error es de 0.05%.
18. La cantidad de calcio en una muestra de orina se determina por un método para el cual el magnesio es un interferente. El coeficiente de selectividad, K Ca, Mg, para el método es 0.843. Cuando se lleva por el procedimiento una muestra con una relación Mg/Ca de 0.50,\(-3.7 \%\) se obtiene un error de. El error es +5.5% cuando se utiliza una muestra con una relación Mg/Ca de 2.0. a) Determinar las recuperaciones de Ca y Mg. b) ¿Cuál es el error esperado para una muestra de orina en la que la relación Mg/Ca es 10.0?
19. Usando las constantes de formación en el Apéndice 12, muestran que F — es un agente enmascarante efectivo para prevenir una reacción entre Al 3 + y EDTA. Supongamos que las únicas formas significativas de fluoruro y EDTA son F — e Y 4—.
20. El cianuro se usa frecuentemente como agente enmascarante para iones metálicos. Su efectividad como agente enmascarante es mejor en soluciones más básicas. Explique el motivo de esta dependencia del pH.
21. Explicar cómo podemos separar una muestra acuosa que contiene Cu 2 +, Sn 4+, Pb 2 + y Zn 2 + en sus partes componentes ajustando el pH de la solución.
22. Un soluto, S, tiene una relación de distribución entre agua y éter de 7.5. Calcular la eficiencia de extracción si extraemos una muestra acuosa de S de 50.0 mL usando 50.0 mL de éter como (a) una sola porción de 50.0 mL; (b) dos porciones, cada una de 25.0 mL; (c) cuatro porciones, cada una de 12.5 mL; y (d) cinco porciones, cada una de 10.0 mL. Supongamos que el soluto no está involucrado en ningún equilibrio secundario.
23. Qué volumen de éter se necesita para extraer 99.9% del soluto en problema 23 cuando se utiliza (a) 1 extracción; (b) 2 extracciones; (c) cuatro extrac- ciones; y (d) cinco extracciones.
24. ¿Cuál es la relación de distribución mínima si el 99% del soluto en una muestra de 50.0-mL se extrae usando una sola porción de 50.0-mL de un solvente orgánico? Repita para el caso donde se utilicen dos porciones de 25.0-mL del solvente orgánico.
25. Un ácido débil, HA, con un K a de\(1.0 \times 10^{-5}\) tiene un coeficiente de reparto, K D, de\(1.2 \times 10^3\) entre agua y un disolvente orgánico. ¿Qué restricción en el pH de la muestra es necesaria para asegurar que 99.9% del ácido débil en una muestra de 50.0-mL se extrae usando una sola porción de 50.0-mL del solvente orgánico?
26. Para el problema 25, ¿cuántas extracciones se necesitan si el pH de la muestra no se puede disminuir por debajo de 7.0?
27. Una base débil, B, con una K b de\(1.0 \times 10^{-3}\) tiene un coeficiente de reparto, K D, de\(5.0 \times 10^2\) entre agua y un disolvente orgánico. ¿Qué restricción en el pH de la muestra es necesaria para asegurar que el 99.9% de la base débil en una muestra de 50.0-mL se extrae cuando se utilizan dos porciones de 25.0-mL del solvente orgánico?
28. Una muestra contiene un analito ácido débil, HA, y un interferente ácido débil, HB. Las constantes de disociación ácida y los coeficientes de partición para los ácidos débiles son K a, HA =\(1.0 \times 10^{-3}\), K a, HB =\(1.0 \times 10^{-7}\), K D, HA = K D, HB =\(5.0 \times 10^2\). (a) Calcular la eficiencia de extracción para HA y HB cuando se extrae una muestra de 50.0-mL, tamponada a un pH de 7.0, utilizando 50.0 mL del solvente orgánico. b) ¿Qué fase se enriquece en el analito? c) ¿Cuáles son las recuperaciones para el analito y el interferente en esta fase? d) ¿Cuál es el factor de separación? e) Se realiza un análisis cuantitativo sobre la fase enriquecida en analito. ¿Cuál es el error relativo esperado si el coeficiente de selectividad, K HA, HB, es 0.500 y la relación inicial de HB/HA es 10.0?
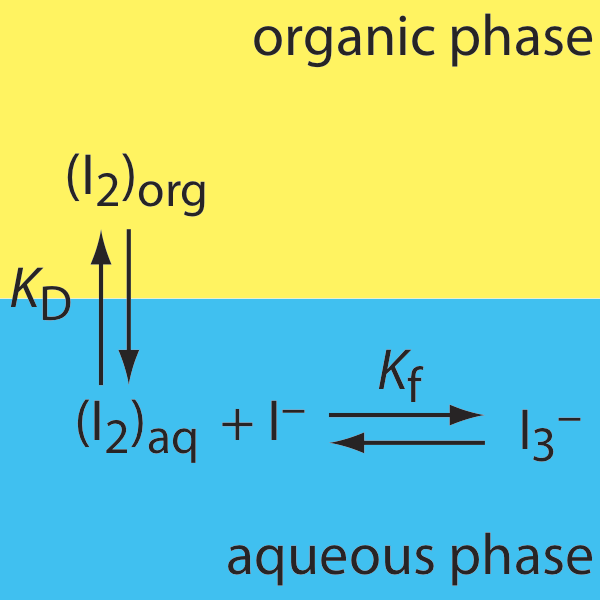
29. A continuación se muestran los equilibrios relevantes para la extracción de I 2 de una solución acuosa de KI a una fase orgánica. (a) ¿La eficiencia de extracción para I 2 es mejor a concentraciones mayores o menores de I —? (b) Derivar una expresión para la relación de distribución para esta extracción.
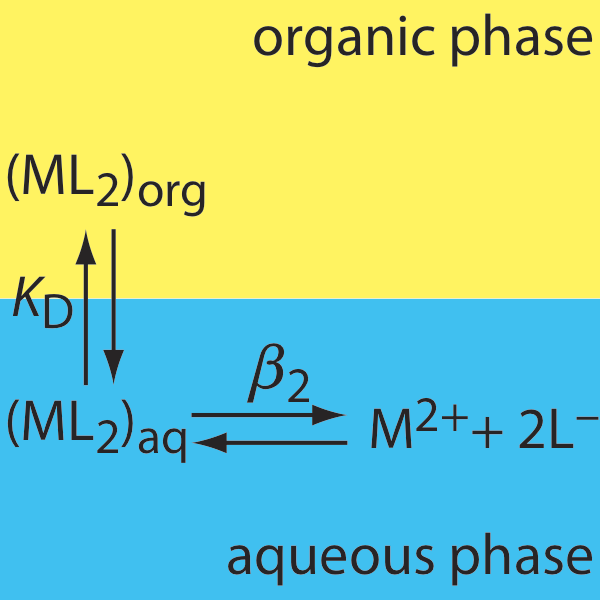
30. A continuación se muestran los equilibrios relevantes para la extracción del complejo metal-ligando ML 2 de una solución acuosa a una fase orgánica. (a) Derivar una expresión para la relación de distribución para esta extracción. (b) Calcular la eficiencia de extracción cuando una muestra acuosa de 50.0-mL que es 0.15 mM en M 2+ y 0.12 M en L — se extrae usando 25.0 mL de la fase orgánica. Supongamos que K D es 10.3 y eso\(\beta_2\) es 560.
31. Derivar la ecuación 7.7.12 para el esquema de extracción descrito en la figura 7.7.5.
32. Se dispone de la siguiente información para la extracción de Cu 2 + por CCl 4 y ditizona: K D, c =\(7 \times 10^4\);\(\beta_2 = 5 \times 10^{22}\); K a, HL =\(3 \times 10^{-5}\); K D, HL =\(1.1 \times 10^4\); y n = 2. ¿Cuál es la eficiencia de extracción si se extrae una muestra de 100.0-mL de una solución acuosa que es\(1.0 \times 10^{-7}\) M Cu 2 + y 1 M en HCl usando 10.0 mL de CCl 4 que contiene\(4.0 \times 10^{-4}\) M ditizona (HL)?
33. Cupferron es un ligando cuya fuerte afinidad por los iones metálicos lo hace útil como agente quelante en extracciones líquido-líquido. La siguiente tabla proporciona relaciones de distribución dependientes del pH para la extracción de Hg 2 +, Pb 2+ y Zn 2 + de una solución acuosa a un disolvente orgánico.
| pH | Hg 2 + | Pb 2+ | Zn 2 + |
|---|---|---|---|
| 1 | 3.3 | 0.0 | 0.0 |
| 2 | 10.0 | 0.43 | 0.0 |
| 3 | 32.3 | 999 | 0.0 |
| 4 | 32.3 | 9999 | 0.0 |
| 5 | 19.0 | 9999 | 0.18 |
| 6 | 4.0 | 9999 | 0.33 |
| 7 | 1.0 | 9999 | 0.82 |
| 8 | 0.54 | 9999 | 1.50 |
| 9 | 0.15 | 9999 | 2.57 |
| 10 | 0.05 | 9999 | 2.57 |
(a) Supongamos que tiene una muestra de 50.0-mL de una solución acuosa que contiene Hg 2 +, Pb 2+ y Zn 2+. Describe cómo puedes separar estos iones metálicos. (b) En las condiciones para su extracción de Hg 2 +, ¿qué porcentaje del Hg 2 + permanece en la fase acuosa después de tres extracciones de 50.0-mL con el disolvente orgánico? (c) En las condiciones para su extracción de Pb 2 +, ¿cuál es el volumen mínimo de disolvente orgánico necesario para extraer 99.5% del Pb 2 + en una sola extracción? (d) En las condiciones para su extracción de Zn 2 +, ¿cuántas extracciones son necesarias para eliminar 99.5% del Zn 2 + si cada extracción utiliza 25.0 mL de disolvente orgánico?


