17.11: Semi-reacciones y medias células
- Page ID
- 74370
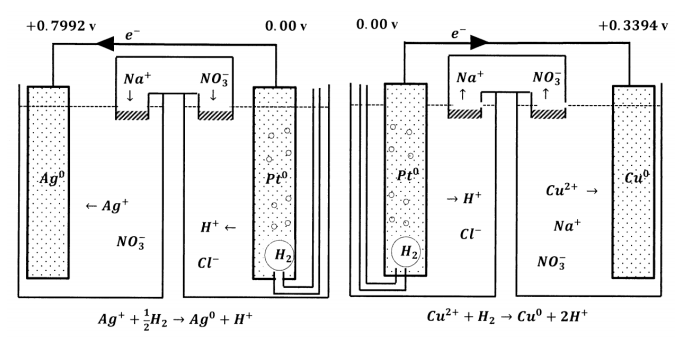
Consideremos algunas celdas electroquímicas estándar que podríamos construir usando el S.H.E. Dos posibilidades son las celdas electroquímicas en las que el segundo electrodo es el electrodo estándar de plata-plata o el electrodo estándar de iones cúpricos de cobre. Los diagramas de la Figura 7 resumen las medias reacciones y los potenciales eléctricos que encontramos cuando construimos estas células.
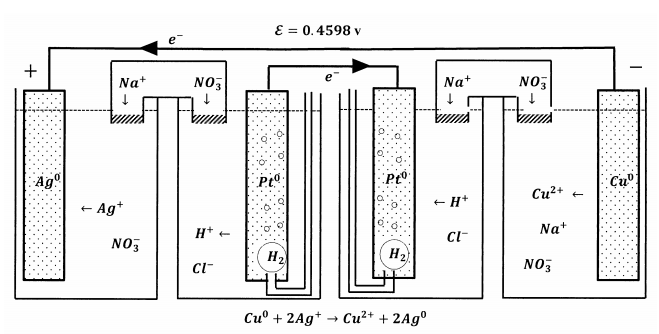
También podemos conectar estas celdas para que los dos S.H.E. estén unidos por un cable, mientras que un segundo cable une los electrodos de plata y cobre. Esta configuración se esboza en la Figura 8. Pase lo que pase en un S.H.E. sucede exactamente al revés en el otro S.H.E. El efecto neto es esencialmente lo mismo que conectar la media celda de iones de plata a la media celda de iones cúpricos de cobre por un solo puente de sal. Si no sabíamos ya qué reacción ocurre, podríamos averiguarla a partir de la información que tenemos sobre cómo se desempeña cada una de estas dos celdas cuando opera contra el S.H.E.