6.2: Las funciones de onda de un rotador rígido se denominan armónicos esféricos
- Page ID
- 80452
Las soluciones a la ecuación de Schrödinger del átomo de hidrógeno son funciones que son productos de una función armónica esférica y una función radial:
\[ \psi _{n, l, m_l } (r, \theta , \phi) = R_{n,l} (r) Y^{m_l}_l (\theta , \phi) \label {6.2.20} \]
Las funciones de onda para el átomo de hidrógeno dependen de las tres variables\(r\),\(\theta\),\(\phi \) y los tres números cuánticos n,\(l\), y\(m_l\). Las variables dan la posición del electrón con respecto al núcleo en coordenadas esféricas. El cuadrado absoluto de la función de onda,, evaluado en\(| \psi (r, \theta , \phi )|^2\),\(r\)\(\theta \), y\(\phi\) da la densidad de probabilidad de encontrar el electrón dentro de un volumen diferencial\(d \tau\), centrado en la posición especificada por\(r\),\(\theta \), y\(\phi\).
Cuál es el valor de la integral (en notación braket)
\[\langle \psi (r, \theta , \phi ) | \psi (r, \theta , \phi ) \rangle \;? \nonumber \]
o expandido en notación integral (en coordenadas cartesianas)
\[ \int \limits_{-\infty}^{+\infty} \int \limits_{-\infty}^{+\infty} \int \limits_{-\infty}^{+\infty} | \psi (x, y , z)|^2 \,dx\,dy\,dz \nonumber \]
o expandido en notación integral (en coordenadas esféricas)
\[ \int \limits_{0}^{+\infty} \int \limits_{0}^{\pi} \int \limits_{0}^{+2\pi} | \psi (r, \theta , \phi)|^2 r^2\sin \theta \,d\theta\, d\phi\,dr \nonumber \]
- Contestar
-
No es necesario conocer la forma funcional de los estados propios de los átomos de hidrógeno en ningún sistema de coordenadas. Si los autoestados (es decir, soluciones al átomo de hidrógeno ecuación de Schrödinger) se normalizan -como normalmente nos gustan- entonces esta integral será 1.
Los números cuánticos tienen nombres:
- \(n\)se llama el número cuántico principal,
- \(l\)se llama el número cuántico de momento angular, y
- \(m_l\)se llama el número cuántico magnético porque (como veremos, depende de la energía en un campo magnético\(m_l\)).
A menudo\(l\) se le llama el número cuántico azimutal porque es una consecuencia\(\theta\) de la ecuación, que involucra el ángulo azimutal\(\Theta \), refiriéndose al ángulo al cenit. Estos números cuánticos tienen valores específicos que están dictados por las restricciones físicas o condiciones de límite impuestas a la ecuación de Schrödinger:\(n\) debe ser un entero mayor que 0,\(l\) puede tener los valores de 0 a\(n‑1\), y\(m_l\) puede tener\(2l + 1\) valores que van desde \(-l\)a\(+l\) en pasos unitarios o enteros. El número total de orbitales con un valor particular de\(n\) es\(n^2\) - es decir, esta es la degeneración del sistema.
Los valores del número cuántico\(l\) suelen estar codificados por una letra: s significa 0, p significa 1, d significa 2, f significa 3; los siguientes códigos continúan alfabéticamente (por ejemplo, g significa\(l = 4\)). Los números cuánticos especifican la cuantificación de cantidades físicas. Las energías discretas de los diferentes estados del átomo de hidrógeno vienen dadas por\(n\), la magnitud del momento angular viene dada por\(l\), y un componente del momento angular (generalmente elegido por los químicos para ser el componente z) viene dado por\(m_l\).
Se encuentra que la\(\Phi\) función tiene el número cuántico\(m\), donde
\[\Phi_m (\phi) = A_m e^{im\phi} \nonumber \]
y\(A_m\) es la constante de normalización y\(m = 0, \pm1, \pm2 ... \pm\infty\). La\(\Theta\) función se resolvió y se conoce como polinomios de Legendre, los cuales tienen números cuánticos\(m\) y\(\ell\). Cuando\(\Theta\) y\(\Phi\) se multiplican juntos, el producto se conoce como armónicos esféricos con etiquetado\(Y_{J}^{m} (\theta, \phi)\).
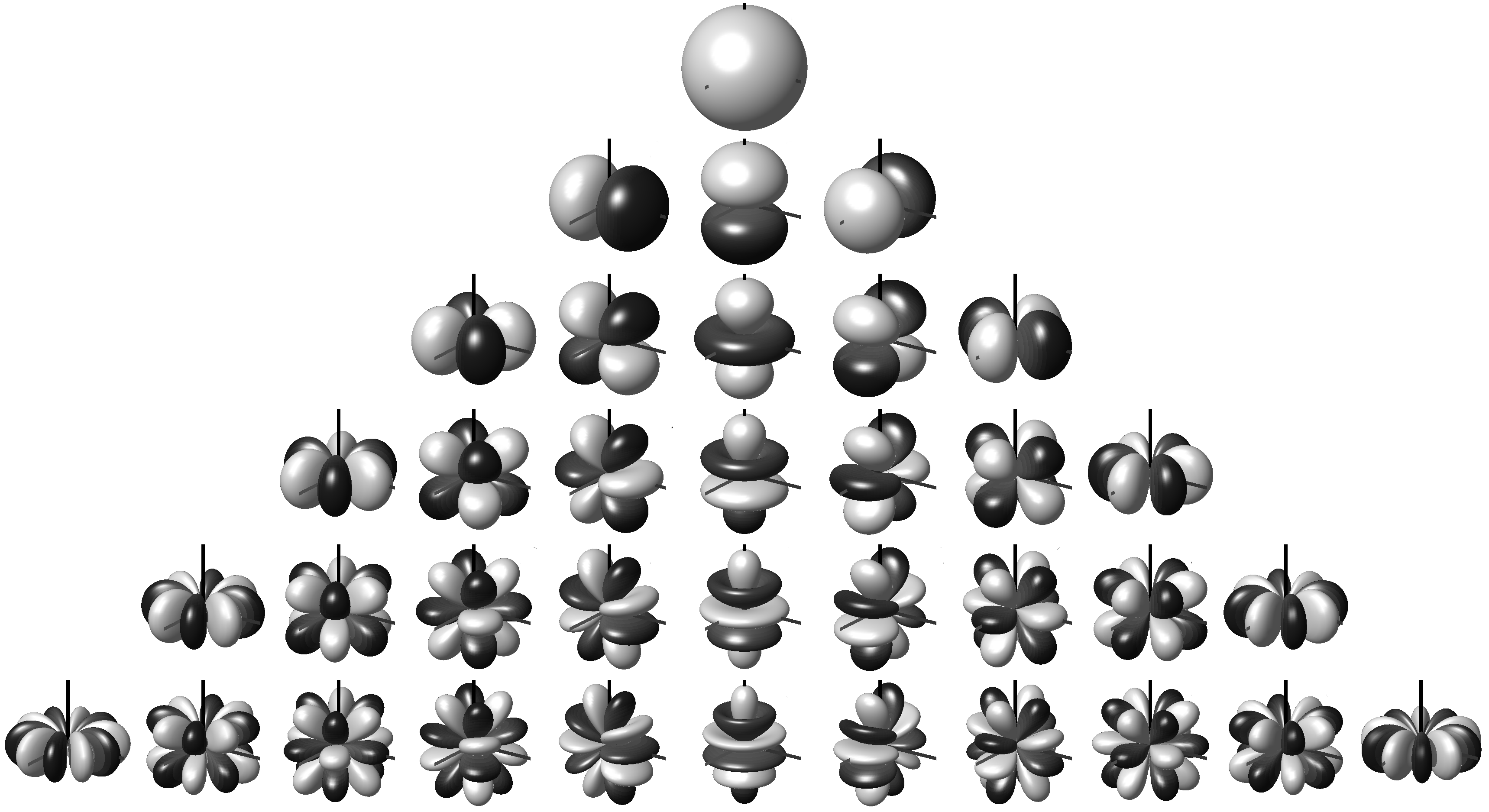
La figura 6.2.1
muestra los armónicos esféricos\(Y_J^M\), que son soluciones de la ecuación angular de Schrödinger. Estos están escritos explícitamente en la Tabla 6.2.1
. Observe que estas funciones son de naturaleza compleja.
|
|
|
|
|
|
|---|---|---|---|---|
| \ (m_J\)” style="vertical-align:middle; ">0 | \ (J\)” style="vertical-align:middle; ">0 | \ (\ Theta ^ {m_J} _J (\ theta)\)” style="vertical-align:middle; ">\(\dfrac {1}{\sqrt {2}}\) | \ (\ Phi (\ varphi)\)” style="vertical-align:middle; ">\(\dfrac {1}{\sqrt {2 \pi}}\) | \ (Y^ {m_J} _J (\ theta,\ varphi)\)” style="vertical-align:middle; ">\(\dfrac {1}{\sqrt {4 \pi}}\) |
| \ (m_J\)” style="vertical-align:middle; ">0 | \ (J\)” style="vertical-align:middle; ">1 | \ (\ Theta ^ {m_J} _J (\ theta)\)” style="vertical-align:middle; ">\(\sqrt {\dfrac {3}{2}}\cos \theta\) | \ (\ Phi (\ varphi)\)” style="vertical-align:middle; ">\(\dfrac {1}{\sqrt {2 \pi}}\) | \ (Y^ {m_J} _J (\ theta,\ varphi)\)” style="vertical-align:middle; ">\(\sqrt {\dfrac {3}{4 \pi}}\cos \theta\) |
| \ (m_J\)” style="vertical-align:middle; ">1 | \ (J\)” style="vertical-align:middle; ">1 | \ (\ Theta ^ {m_J} _J (\ theta)\)” style="vertical-align:middle; ">\(\sqrt {\dfrac {3}{4}}\sin \theta\) | \ (\ Phi (\ varphi)\)” style="vertical-align:middle; ">\(\dfrac {1}{\sqrt {2 \pi}}e^{i \varphi}\) | \ (Y^ {m_J} _J (\ theta,\ varphi)\)” style="vertical-align:middle; ">\(\sqrt {\dfrac {3}{8 \pi}}\sin \theta e^{i \varphi}\) |
| \ (m_J\)” style="vertical-align:middle; ">-1 | \ (J\)” style="vertical-align:middle; ">1 | \ (\ Theta ^ {m_J} _J (\ theta)\)” style="vertical-align:middle; ">\(\sqrt {\dfrac {3}{4}}\sin \theta\) | \ (\ Phi (\ varphi)\)” style="vertical-align:middle; ">\(\dfrac {1}{\sqrt {2 \pi}}e^{-i\varphi}\) | \ (Y^ {m_J} _J (\ theta,\ varphi)\)” style="vertical-align:middle; ">\(\sqrt {\dfrac {3}{8 \pi}}\sin \theta e^{-i \varphi}\) |
| \ (m_J\)” style="vertical-align:middle; ">0 | \ (J\)” style="vertical-align:middle; ">2 | \ (\ Theta ^ {m_J} _J (\ theta)\)” style="vertical-align:middle; ">\(\sqrt {\dfrac {5}{8}}(3\cos ^2 \theta - 1)\) | \ (\ Phi (\ varphi)\)” style="vertical-align:middle; ">\(\dfrac {1}{\sqrt {2 \pi}}\) | \ (Y^ {m_J} _J (\ theta,\ varphi)\)” style="vertical-align:middle; ">\(\sqrt {\dfrac {5}{16\pi}}(3\cos ^2 \theta - 1)\) |
| \ (m_J\)” style="vertical-align:middle; ">1 | \ (J\)” style="vertical-align:middle; ">2 | \ (\ Theta ^ {m_J} _J (\ theta)\)” style="vertical-align:middle; ">\(\sqrt {\dfrac {15}{4}} \sin \theta \cos \theta \) | \ (\ Phi (\ varphi)\)” style="vertical-align:middle; ">\(\dfrac {1}{\sqrt {2 \pi}}e^{i \varphi}\) | \ (Y^ {m_J} _J (\ theta,\ varphi)\)” style="vertical-align:middle; ">\(\sqrt {\dfrac {15}{8\pi}} \sin \theta \cos \theta e^{i\varphi}\) |
| \ (m_J\)” style="vertical-align:middle; ">-1 | \ (J\)” style="vertical-align:middle; ">2 | \ (\ Theta ^ {m_J} _J (\ theta)\)” style="vertical-align:middle; ">\(\sqrt {\dfrac {15}{4}} \sin \theta \cos \theta \) | \ (\ Phi (\ varphi)\)” style="vertical-align:middle; ">\(\dfrac {1}{\sqrt {2 \pi}}e^{-i\varphi}\) | \ (Y^ {m_J} _J (\ theta,\ varphi)\)” style="vertical-align:middle; ">\(\sqrt {\dfrac {15}{8\pi}} \sin \theta \cos \theta e^{-i\varphi}\) |
| \ (m_J\)” style="vertical-align:middle; ">2 | \ (J\)” style="vertical-align:middle; ">2 | \ (\ Theta ^ {m_J} _J (\ theta)\)” style="vertical-align:middle; ">\(\sqrt {\dfrac {15}{16}} \sin ^2 \theta \) | \ (\ Phi (\ varphi)\)” style="vertical-align:middle; ">\(\dfrac {1}{\sqrt {2 \pi}}e^{2i\varphi}\) | \ (Y^ {m_J} _J (\ theta,\ varphi)\)” style="vertical-align:middle; ">\(\sqrt {\dfrac {15}{32\pi}} \sin ^2 \theta e^{2i\varphi} \) |
| \ (m_J\)” style="vertical-align:middle; ">-2 | \ (J\)” style="vertical-align:middle; ">2 | \ (\ Theta ^ {m_J} _J (\ theta)\)” style="vertical-align:middle; ">\(\sqrt {\dfrac {15}{16}} \sin ^2 \theta \) | \ (\ Phi (\ varphi)\)” style="vertical-align:middle; ">\(\dfrac {1}{\sqrt {2 \pi}}e^{-2i\varphi}\) | \ (Y^ {m_J} _J (\ theta,\ varphi)\)” style="vertical-align:middle; ">\(\sqrt {\dfrac {15}{32\pi}} \sin ^2 \theta e^{-2i\varphi} \) |
Considerar varios valores para\(n\), y mostrar que el número de orbitales para cada uno\(n\) es\(n^2\).
Construir una tabla que resuma los valores permitidos para los números cuánticos\(n\),\(l\), y\(m_l\). para los niveles de energía 1 a 7 de hidrógeno.
La notación 3d especifica los números cuánticos para un electrón en el átomo de hidrógeno.
- ¿Cuáles son los valores para\(n\) y\(l\)?
- ¿Cuáles son los valores para la energía y el momento angular?
- ¿Cuáles son los valores posibles para el número cuántico magnético?
- ¿Cuáles son las posibles orientaciones para el vector de momento angular?
- Contestar
-
- \(n=3\)y\(l=2\)
- Energía:\[E_{n}=\frac{E_{1}}{n^{2}}=\frac{-13.6 \mathrm{eV}}{9}=-1.51 \mathrm{eV} \nonumber \] y momento angular\[\sqrt{l(l+1)} \hbar=\sqrt{2 \times 3} \hbar=2.584 \times 10^{-34} J \cdot S \nonumber \]
- Número cuántico magnético:\[m_{l}=-2,-1,0,1,2 \nonumber \]
Orbitales atómicos
Las funciones de onda del átomo de hidrógeno,\(\psi (r, \theta , \phi )\), se llaman orbitales atómicos. Un orbital atómico es una función que describe un electrón en un átomo. La función de onda con\(n = 1\),\(\ell = 0\), y (\(m_{ell}=0\)se llama orbital 1s, y un electrón que se describe por esta función se dice que está “en” el orbital 1s, es decir, tiene un estado orbital 1s. Las restricciones sobre\(n\),\(\ell\), y\(m_\ell\) que se imponen durante la solución del átomo de hidrógeno La ecuación de Schrödinger explican por qué hay un solo orbital 1s, por qué hay tres orbitales 2p, cinco orbitales 3d, etc. Veremos cuando consideremos átomos de múltiples electrones, estas restricciones explican las características de la Tabla Periódica. En otras palabras, la Tabla Periódica es una manifestación del modelo de Schrödinger y las restricciones físicas impuestas para obtener las soluciones a la ecuación de Schrödinger para el átomo de hidrógeno.
Visualizar la variación de una función de onda electrónica con\(r\)\(\theta\), y\(\phi\) es importante porque el cuadrado absoluto de la función de onda representa la distribución de carga (densidad de probabilidad de electrones) en un átomo o molécula. La distribución de carga es fundamental para la química porque está relacionada con la reactividad química. Por ejemplo, una parte deficiente en electrones de una molécula es atraída por una región rica en electrones de otra molécula, y tales interacciones juegan un papel importante en las interacciones químicas que van desde reacciones de sustitución y adición hasta el plegamiento de proteínas y la interacción de sustratos con enzimas.
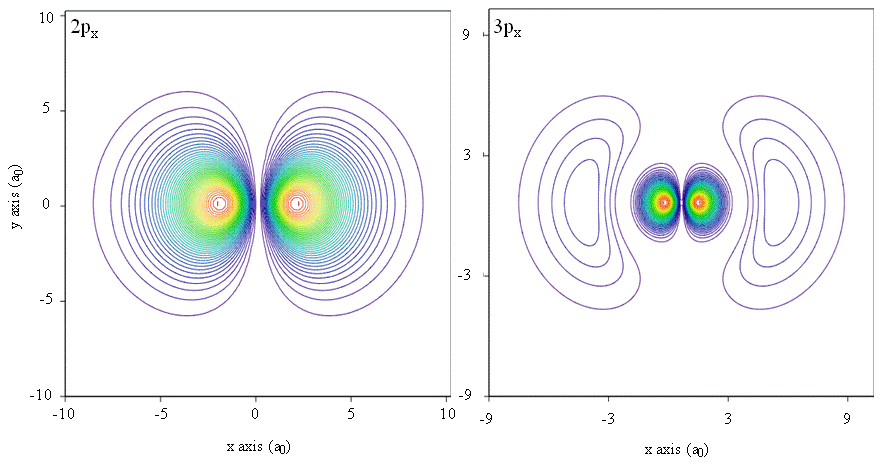
Visualizar las funciones de onda y las distribuciones de carga es un desafío porque requiere examinar el comportamiento de una función de tres variables en el espacio tridimensional. Esta visualización se facilita al considerar las partes radial y angular por separado, pero trazar las partes radial y angular por separado no revela muy bien la forma de un orbital. La forma se puede revelar mejor en una gráfica de densidad de probabilidad. Para hacer tal trama tridimensional, divida el espacio en elementos de pequeño volumen, calcule\(\psi^* \psi \) en el centro de cada elemento de volumen, y luego sombree, puntee o coloree ese elemento de volumen en proporción a la magnitud de\(\psi^* \psi \). No confunda tales parcelas con parcelas polares, que se ven similares. Las densidades de probabilidad también se pueden representar mediante mapas de contorno, como se muestra en la Figura 6.2.2 .
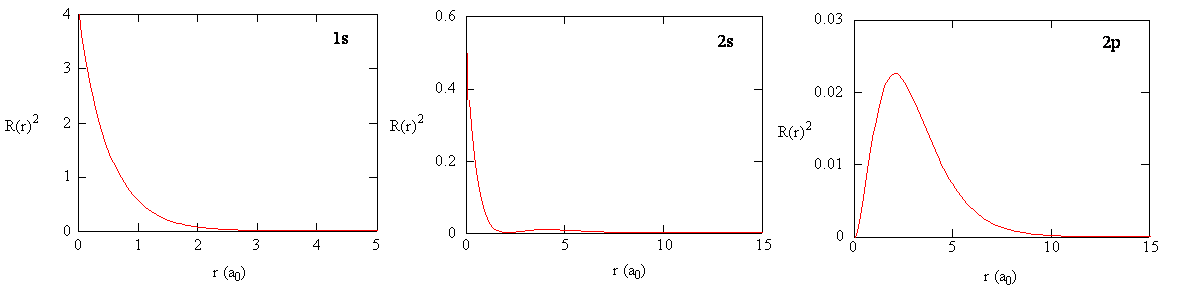
Los métodos para examinar separadamente las porciones radiales de los orbitales atómicos proporcionan información útil sobre la distribución de la densidad de carga dentro de los orbitales. Gráficas de las funciones radiales\(R(r)\),, para los orbitales 1s, 2s y 2p trazados en la Figura 6.2.3 .
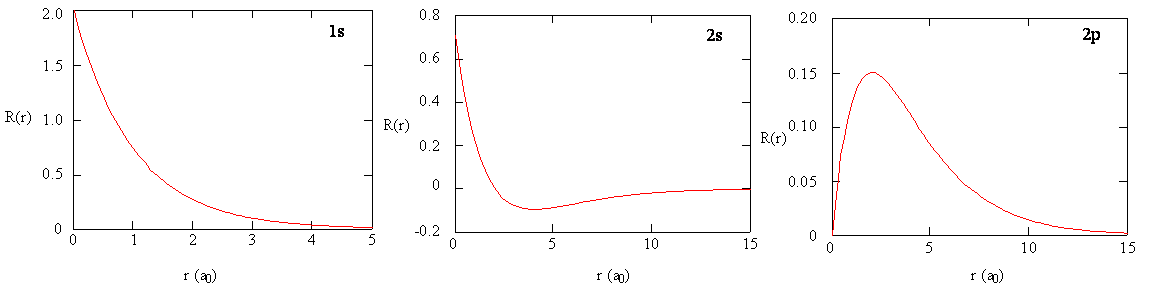
La función 1s en la Figura 6.2.3 comienza con un alto valor positivo en el núcleo y decae exponencialmente a esencialmente cero después de 5 radios de Bohr. El alto valor en el núcleo puede ser sorprendente, pero como veremos más adelante, la probabilidad de encontrar un electrón en el núcleo es muy pequeña.
Siguiente Observe cómo la función radial para el orbital 2s, Figura 6.2.3 , va a cero y se vuelve negativa. Este comportamiento revela la presencia de un nodo radial en la función. Un nodo radial ocurre cuando la función radial es igual a cero que no sea at\(r = 0\) o\(r = ∞\). Los nodos y los comportamientos limitantes de las funciones orbitales atómicas son útiles para identificar qué orbital se está describiendo por qué función de onda. Por ejemplo, todas las funciones s tienen valores de función de onda distintos de cero en\(r = 0\), pero p, d, f y todas las demás funciones van a cero en el origen. Es útil recordar que hay nodos\(n-1-l\) radiales en una función de onda, lo que significa que un orbital 1s no tiene nodos radiales, un 2s tiene un nodo radial, y así sucesivamente.
Examinar las formas matemáticas de las funciones de onda radiales. ¿Qué característica de las funciones hace que algunas de ellas pasen a cero en el origen mientras que las funciones s no van a cero en el origen?
¿Qué característica matemática de cada una de las funciones radiales controla el número de nodos radiales?
- Contestar
-
El polinomio Laguerre controla los nodos radiales con el número de raíces para el polinomio de Laguerre es el número de nodos radiales.
¿A qué valor de\(r\) ocurre el nodo radial 2s?
- Contestar
-
Un nodo existe cuando la porción radial de la función de onda es igual a 0. La porción radial de la función de onda 2s es:
\[R(r) = \left(\frac{1}{2 \sqrt{2}}\right)\left(\frac{Z}{\alpha_{0}}\right)^{\frac{3}{2}}(2-\rho) e^{\frac{-\rho}{2}} \nonumber \]
donde\(\rho=\frac{Z r}{\alpha_{0}}\),\(Z=1\) para el átomo de hidrógeno y\(\alpha_{0}\) es el radio de Bohr.
Por lo tanto:
\[R(r) = \left(\frac{1}{2 \sqrt{2}}\right)\left(\frac{1}{\alpha_{0}}\right)^{\frac{3}{2}}\left(2-\frac{r}{\alpha_{0}}\right) e^{\frac{-2 r}{\alpha_{0}}} \nonumber \]
Para esta función de onda:
- \(\left(\frac{1}{\alpha_{0}}\right)^{\frac{3}{2}}\)es una constante y nunca será igual a 0.
- \(e^{\frac{-2 r}{\alpha_{0}}}\)es exponencial, y además nunca será igual a 0.
Por lo tanto, nuestro nodo es cuándo\(\left(2-\frac{r}{\alpha_{0}}\right)=0\) y\[r=2 \alpha_{0} \nonumber \]
Hacer una tabla que proporcione la energía, el número de nodos radiales, y el número de nodos angulares y el número total de nodos para cada función con\(n = 1\)\(n=2\), y\(n=3\). Identificar la relación entre la energía y el número de nodos. Identificar la relación entre el número de nodos radiales y el número de nodos angulares.
- Contestar
-
Ondefunción Energía Nodos totales Nodos Radiales Nodos Angulares 1s 13.6 eV 0 0 0 2s 3.4 eV 1 1 0 2p 3.4 eV 1 0 1 3s 1.5 eV 2 2 0 3p 1.5 eV 2 1 1 3d 1.5 eV 2 0 2 - La energía del electrón en cada función de onda es\[E = \dfrac{Z^2E_h}{2n^2} \nonumber \]
- El número de nodos totales es (N-1\), el número de nodos radiales es\(N-L-1\) y el número de nodos angulares es\(L\).
La cantidad\(R(r)^* R(r)\) da la densidad de probabilidad radial; es decir, la densidad de probabilidad para que el electrón esté en un punto ubicado a la\(r\) distancia del protón. Las densidades radiales de probabilidad para tres orbitales atómicos se representan en la Figura 6.2.4 .
Probabilidades y funciones de distribución
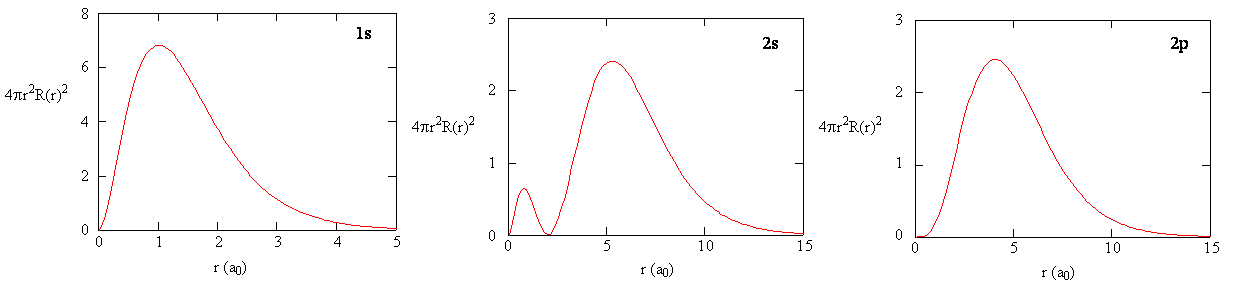
Cuando la densidad de probabilidad radial para cada valor de\(r\) se multiplica por el área de la superficie esférica representada por ese valor particular de r, obtenemos la función de distribución radial. La función de distribución radial da la densidad de probabilidad para que un electrón se encuentre en cualquier parte de la superficie de una esfera ubicada a una distancia r del protón. Dado que el área de una superficie esférica es\(4 \pi r^2\), la función de distribución radial viene dada por
\[\underbrace{4 \pi r^2 R(r) ^* R(r)}_{\text{radial probability density}} \nonumber \]
Las funciones de distribución radial se muestran en la Figura 6.2.5 . A valores pequeños de\(r\), la función de distribución radial es baja debido a que el área de superficie pequeña para radios pequeños modula el valor alto de la función de densidad de probabilidad radial cerca del núcleo. A medida que aumentamos\(r\), la superficie asociada a un valor dado de r aumenta, y el\(r^2\) término hace que la función de distribución radial aumente aunque la densidad de probabilidad radial esté comenzando a disminuir. A grandes valores de\(r\), la decadencia exponencial de la función radial supera el aumento causado por el\(r^2\) término y la función de distribución radial disminuye.
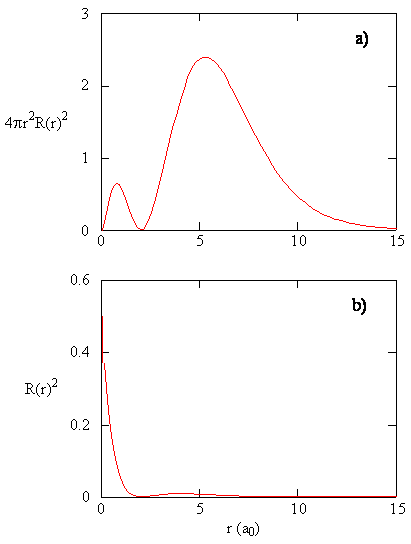
Escriba una comparación de calidad de la función radial y la función de distribución radial para el orbital 2s. Ver Figura 6.2.6 .
- Contestar
-
\(R(r)\)es la función radial del estado propio y\(4\pi r^2 R(r)^* R(r)\) da la función de distribución radial de la distancia del electrón a\(r\) distancia del núcleo (es decir, la probabilidad integrada en todos los ángulos).
La función de probabilidad radial es baja en valores pequeños\(r\) debido a una pequeña superficie cerca del núcleo, por ejemplo a 2s a un pequeño valor de\(r\) la función de probabilidad radial es baja. A valores más altos de\(r\) la superficie aumenta mientras que la densidad de probabilidad radial disminuye, esto hace que la función de distribución radial aumente. En contraste, la densidad de probabilidad radial es alta en una superficie pequeña y cuando\(r\) está cerca del núcleo, es decir, valores bajos de\(r\).
Colaboradores y Atribuciones
Adapted from "Quantum States of Atoms and Molecules" by David M. Hanson, Erica Harvey, Robert Sweeney, Theresa Julia Zielinski

