24.1: Soluciones ideales - Ley de Raoult
- Page ID
- 75246
Cuando dos sustancias cuyas moléculas son muy similares forman una solución líquida, la presión de vapor de la mezcla se relaciona muy simplemente con las presiones de vapor de las sustancias puras. Supongamos, por ejemplo, mezclamos 1 mol de benceno con 1 mol de tolueno como se muestra en la siguiente figura.

La fracción molar de benceno\(X_b\), y la fracción molar de tolueno\(X_t\), son ambas iguales a 0.5. A 79.6°C la presión de vapor medida de esta mezcla es 516 mmHg, ligeramente inferior a 517 mmHg, el promedio de las presiones de vapor del benceno puro (744 mmHg) y del tolueno puro (290 mmHg) a la misma temperatura.
Es fácil explicar este comportamiento si asumimos que debido a que las moléculas de benceno y tolueno son casi iguales, se comportan de la misma manera en solución que en los líquidos puros. Dado que solo hay la mitad de moléculas de benceno en la mezcla que en el benceno puro, la velocidad a la que las moléculas de benceno escapan de la superficie de la solución será la mitad de la velocidad a la que escaparían del líquido puro. En consecuencia, la presión parcial de vapor del benceno por encima de la mezcla será la mitad de la presión de vapor del benceno puro. Por un argumento similar la presión parcial de vapor del tolueno por encima de la solución es también la mitad de la del tolueno puro. En consecuencia, podemos escribir
\[P_b =\frac{1}{2} P_b^*\]
y
\[P_t=\frac{1}{2} P_t^*\]
donde\(P_b\) y\(P_t\) son las presiones parciales de los vapores de benceno y tolueno, respectivamente, y\(P_b^*\) y\(P_y^*\) son las presiones de vapor de los líquidos puros. La presión de vapor total de la solución es
\[P=P_b+P_t=\frac{1}{2}P_b^{*}+\frac{1}{2}P_t^{*}=\frac{P_b^{*}+P_t^{*}}2\]
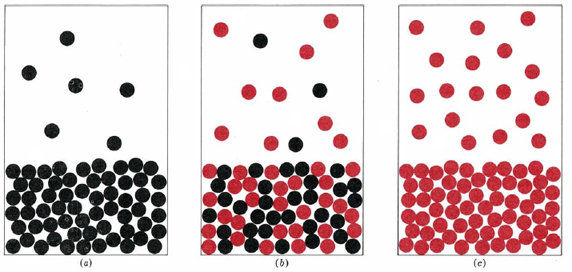
La presión de vapor de la mezcla es igual a la media de las presiones de vapor de los dos líquidos puros.
Podemos generalizar el argumento anterior para aplicarlo a una solución líquida de cualquier composición que involucre dos sustancias cualesquiera\(A\) y\(B\) cuyas moléculas sean muy similares. La presión parcial de vapor\(A\) por encima de la mezcla líquida\(P_A\),, será entonces la presión de vapor de pura\(A\)\(P_A^*\),, multiplicada por la fracción de las moléculas en el líquido que son de tipo\(A\), es decir, la fracción molar de\(A\),\(X_A\). En forma de ecuación
\[P_A=X_AP_A^* \label{3}\]
Similarmente para el componente\(B\)
\[P_B=X_BP_B^* \label{4}\]
Sumando estas dos presiones parciales, obtenemos la presión de vapor total
\[P=P_A + P_B = X_AP_A^* + X_BP_B^* \label{5}\]
Soluciones líquidas que se ajustan a las Eqs. \(\ref{3}\)y\(\ref{5}\) se dice que obedecen la ley de Raoult y que son mezclas ideales o soluciones ideales.
Además de su uso en la predicción de la presión de vapor de una solución, la ley de Raoult puede aplicarse a la solubilidad de un gas en un líquido. Dividiendo ambos lados de la ecuación\(\ref{3}\) por\(P_A^*\) da
\[X_A=\frac{1}{P_A^{*}}\times P_A=k_A\times P_A\label{6}\]
Dado que la presión de vapor de cualquier sustancia tiene un valor específico a una temperatura dada, la Ecuación nos\(\ref{6}\) dice que la fracción molar\(X_A\) de un soluto gaseoso es proporcional a la presión parcial\(P_A\) de ese gas por encima de la solución.
Para una solución ideal la constante de proporcionalidad\(k_A\) es la recíproca de la presión de vapor del soluto puro a la temperatura en cuestión. Ya que la presión de vapor aumenta a medida que aumenta la temperatura\(k_A\),\(1/P_A^*\), es decir, debe disminuir. Por lo tanto, esperamos que la solubilidad de un gas en un líquido aumente a medida que aumente la presión parcial del gas por encima de la solución, pero que disminuya a medida que aumenta la temperatura. La ecuación\(\ref{6}\) se conoce como ley de Henry. También se aplica a los solutos gaseosos que no forman soluciones ideales, pero en tales casos la constante de la ley de Henry\(k_A\) no equivale al recíproco de la presión de vapor.
El siguiente video muestra el efecto de la presión variada sobre la cantidad de CO 2 disuelto en soda. La cantidad de CO 2 disuelto es monitoreada por un indicador de pH. Cuanto más CO 2 disuelto, menor es el pH (cuanto más roja es la solución). Mire el video para conocer cómo se relaciona la solubilidad del CO 2 con la presión, prestando especial atención al color de la solución.
De hecho muy pocas mezclas líquidas obedecen exactamente a la ley de Raoult. Incluso para moléculas tan similares como el benceno y el tolueno, observamos una desviación de 517 mmHg — 516 mmHg, o 1 mmHg a 79.6°C; desviaciones mucho mayores ocurren si las moléculas no son muy similares. Estas desviaciones son de dos tipos. Como se puede ver en la Figura\(\PageIndex{2}\), una gráfica de la presión de vapor contra la fracción molar de un componente produce una línea recta para una solución ideal. Para mezclas no ideales, la presión de vapor real puede ser mayor que el valor ideal (desviación positiva de la ley de Raoult) o menor (desviación negativa). Las desviaciones negativas corresponden a casos donde las atracciones entre moléculas diferentes son mayores que aquellas entre moléculas similares.
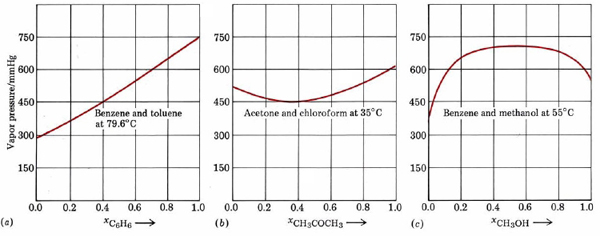
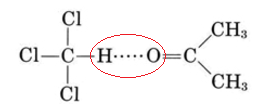
Debido a esta atracción extra intermolecular, las moléculas tienen más dificultades para escapar de la solución y la presión de vapor es menor. Lo contrario es cierto de una mezcla de benceno y metanol. Cuando las moléculas C 6 H 6 se distribuyen aleatoriamente entre las moléculas CH 3 OH, estas últimas no pueden formar enlaces de hidrógeno de manera efectiva. Las moléculas pueden escapar más fácilmente de la solución, y la presión de vapor es mayor de lo que predeciría la ley de Raoult.
Colaboradores
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, and Adam Hahn.

