2.5: Coordinación Pi- Donación de Alquenos
- Page ID
- 79600
Los pares solitarios son los donantes de electrones más comunes en los complejos de coordinación. Los iones cloruro, amoníaco y fosfinas donan un par solitario a los metales para formar complejos. Los pares solitarios ya no se estabilizan por interacciones de unión. La formación de un enlace disminuye la energía de los electrones del par solitario. Por otro lado, los pares de unión ya son más bajos en energía y por lo tanto es menos probable que se donen.
Sin embargo, los enlaces pi también pueden donar a los ácidos de Lewis. Sin embargo, la donación de los bonos sigma sigue siendo mucho menos probable. Los enlaces sigma están enterrados entre átomos y son difíciles de alcanzar.
- Los enlaces Pi suelen ser más altos en energía que los enlaces sigma correspondientes
- Los enlaces Pi son más accesibles espacialmente que los enlaces sigma
Un ejemplo sencillo de donación a partir de un enlace pi es el tratamiento de sales de plata (I) con alquenos, mostrado en la figura\(\PageIndex{1}\).

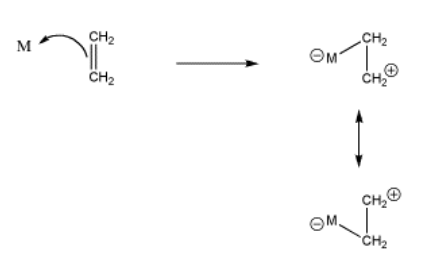
Estrictamente hablando, si un alqueno dona sus electrones de unión pi a un metal, podríamos dibujarlo como se muestra en la Figura CC4.2. Los electrones se comparten entre dos átomos de carbono en el alqueno. Dado que un enlace generalmente se considera como un par de electrones compartidos entre dos átomos, entonces una vez que los electrones pi son donados al metal, se comparten entre el metal y uno de los carbonos, pero no ambos. Si estás haciendo un seguimiento de los electrones con cuidado, eso deja a uno de los carbonos corto en electrones. Debe ser un catión. Por supuesto, cualquiera de los dos carbonos podría ser el catiónico, por lo que podemos dibujar estructuras de resonancia mostrando ambos estados posibles.
- donación de electrones pi a un metal puede “activar” un alqueno
- el alqueno puede llegar a ser positivo y electrofílico
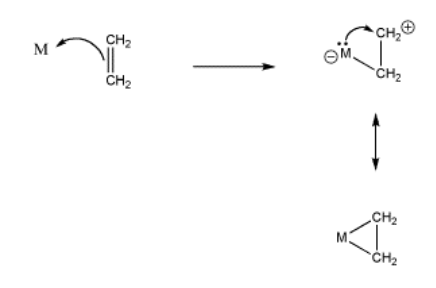
Sin embargo, si un metal tiene electrones de valencia propios, podría donar estos electrones de nuevo al “catión” que se está formando en uno de los carbonos alquenos. El complejo alqueno se puede considerar como un “metalaciclo” o un “metalaciclopropano”, un anillo de tres miembros que contiene dos carbonos y el átomo de metal de transición.
- coordinación de alquenos también implica la donación de metal a alqueno
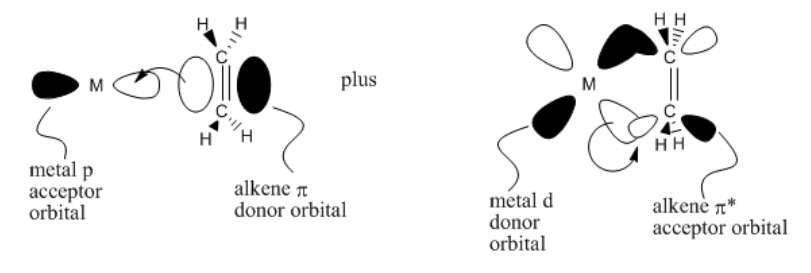
La idea de la retrodonación también se apoya desde el punto de vista orbital molecular. El enlace alqueno pi puede donar electrones a un orbital vacío en el metal, como un orbital p. A su vez, un metal ocupado d orbital tiene la simetría correcta para superponerse con un orbital pi* en el alqueno. Al hacerlo, pensaríamos en el vínculo pi como una ruptura. También pensaríamos en dos pares de electrones de unión entre el metal y los alquenos. Esta situación encaja bastante bien con la imagen de un metalacilo.
- La donación de alqueno a metal y la donación de metal a alqueno están respaldadas por cálculos orbitales moleculares
- sin ambos componentes, los alquenos no se unen muy bien a los metales
- sin embargo, el enlace sigma formado por la donación del alqueno sigue siendo el principal evento formador de enlaces.
Recuerde que los formalismos pueden ser complicados en los complejos de coordinación. Por un lado, no solemos sacar cargas formales positivas sobre el átomo donante o cargas formales negativas sobre el átomo metálico en el complejo (a menos que se ilustre específicamente un punto). En los complejos alquenos, la unión se suele ilustrar con una línea entre el enlace pi y el metal, como en la Figura CC4.5. Esa línea podría leerse como un par de electrones, pero no lo es, en realidad. El par de electrones está en el enlace pi. Están siendo compartidos con el metal.
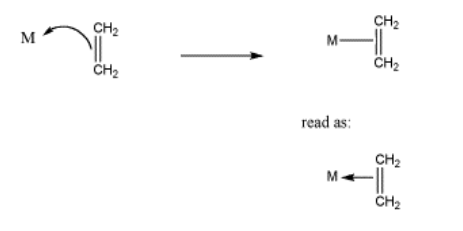
Figura\(\PageIndex{5}\): Representación típica de complejos alquenos.
La unión de alquenos es una de las primeras etapas realizadas por catalizadores de hidrogenación como el catalizador de Wilkinson, que catalizan la adición de dihidrógeno a través de un doble enlace alqueno para formar un alcano.
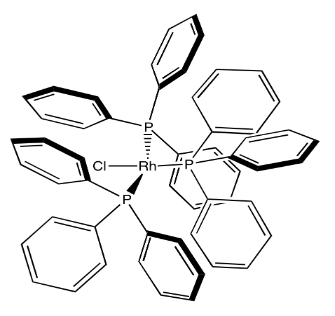
Mostrar, con flechas, la coordinación del ciclohexeno al catalizador de Wilkinson, (PPh 3) 3 rHCl.
- Contestar
-
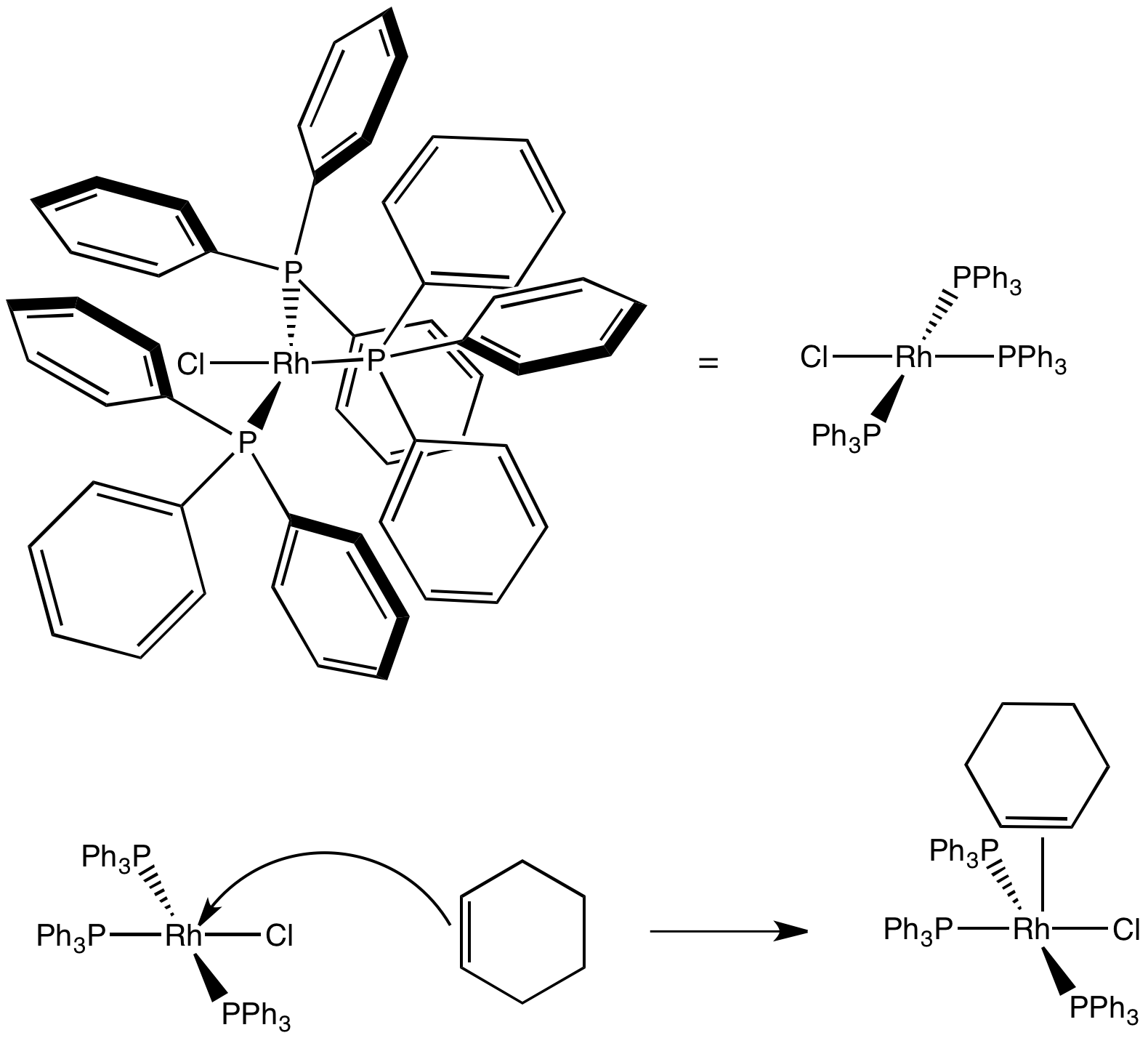
El primer ejemplo de un alqueno coordinado a un metal de transición fue preparado por el químico farmacéutico W. C. Ziese en la Universidad de Copenhague en 1827. Su estructura fue confirmada por difracción de rayos X aproximadamente un siglo después. Su fórmula es K [PtcL 3 (CH 2 CH 2)]. Dibuja la estructura.
- Contestar
-
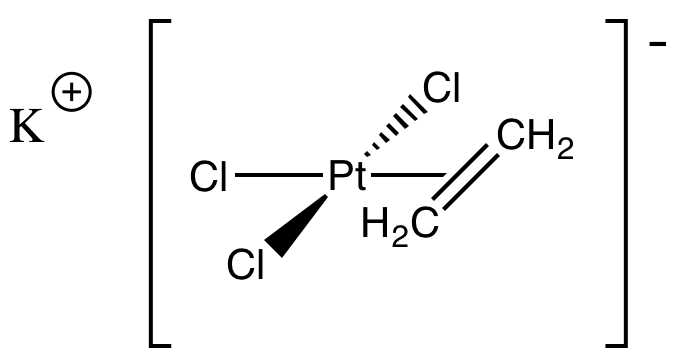
El catalizador de Crabtree es un catalizador de hidrogenación con fórmula [(COD) (py) (PCy 3) Ir] PF 6. Nótese que DQO = 1,4-ciclooctadieno; py = piridina; Cy = ciclohexilo. Dibuja la estructura de este complejo de iridio plano cuadrado.
- Contestar
-
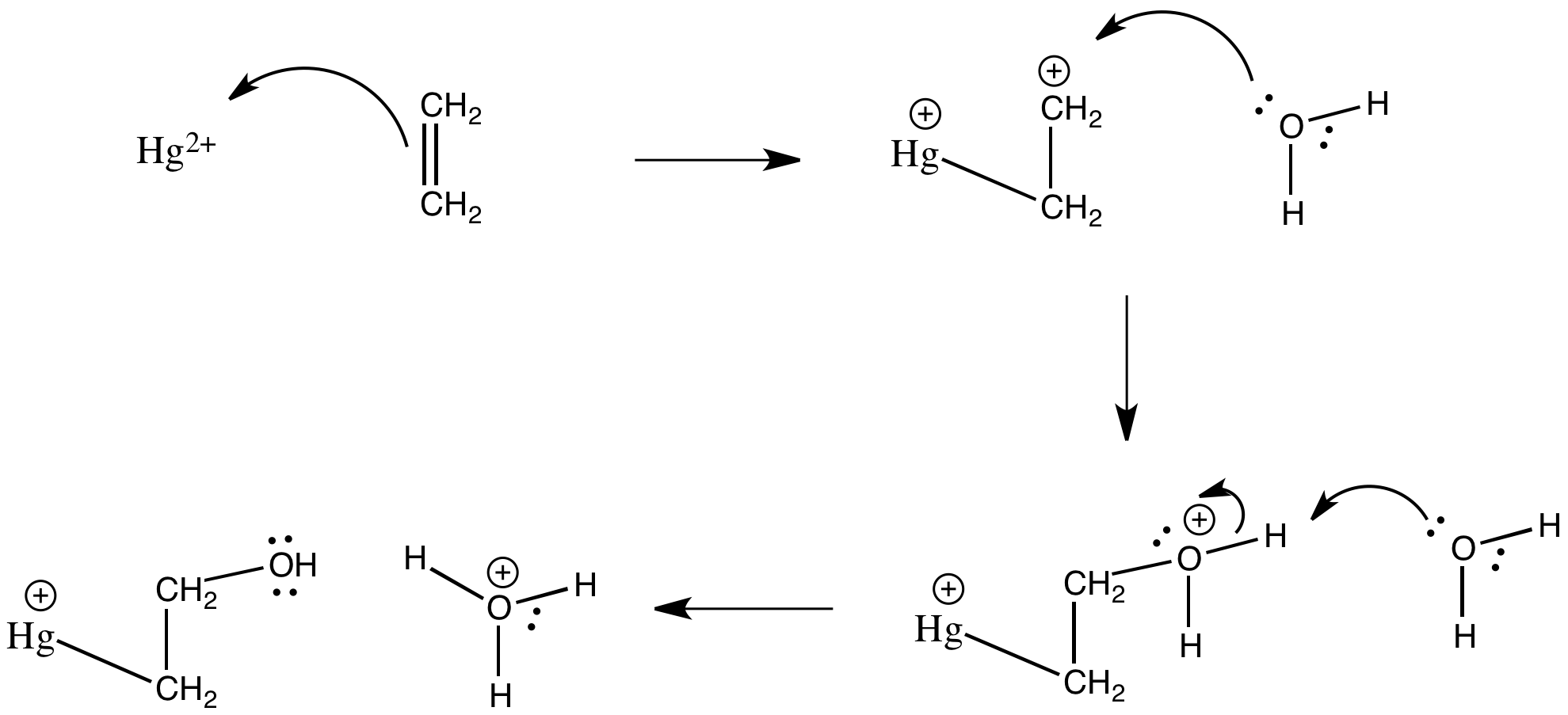
El tratamiento de alquenos con Hg (II) en agua da como resultado la adición de una molécula solvente (un nucleófilo) a un extremo del alqueno “activado”. Dibujar, con flechas, el mecanismo para la formación de un ion hidroxietilmercurio, HgCH 2 CH 2 OH +, a partir de eteno bajo estas condiciones.
- Contestar
-
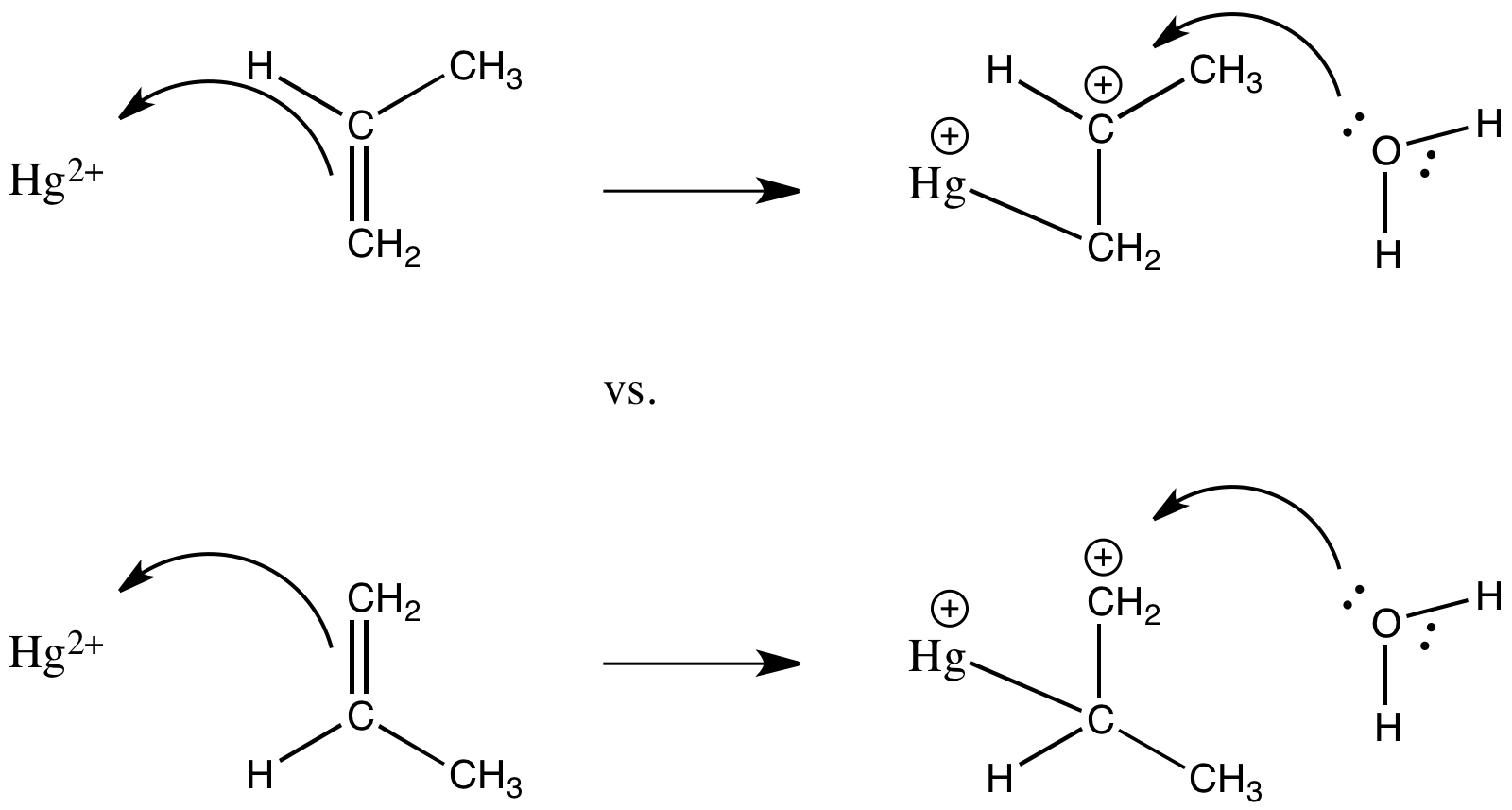
El tratamiento de 2-metilpropeno con Hg (II) en agua da como resultado la formación del ion, HgCH 2 C (CH 3) 2 OH +. Es posible un segundo producto de adición de disolvente, pero no se observa. Mostrar el otro producto posible y proporcionar una posible explicación de la selectividad de la reacción.
- Contestar
-
Los alquenos se coordinan con muchos metales lo suficientemente apretados como para que los complejos de alquenos puedan aislarse Sin embargo, aunque se cree que los iones metálicos tempranos como el Zr (IV) se unen a los alquenos, no se coordinan lo suficiente como para formar compuestos estables que puedan aislarse y caracterizarse. Explique por qué.
- Contestar
-
Zr (IV) o Zr 4+ no tiene valencia d electrones. Eso significa que, aunque un alqueno ciertamente podría donar su enlace pi al átomo de circonio, el circonio no tiene electrones con los que pueda estabilizar el complejo alqueno a través de la “donación posterior” al orbital antienlace pi en el alqueno.
Sin embargo, los metales d 0 como Zr (IV) y Ti (IV) pueden ser utilizados como catalizadores de polimerización de alquenos para hacer plásticos comunes como HDPE, LDPE y polipropileno. Eso significa que, aunque un complejo alqueno no se observa directamente con estos iones metálicos, estos metales evidentemente pueden unir alquenos brevemente y hacer que reaccionen con otros alquenos para formar cadenas largas. Aun así, la mayoría de los catalizadores industriales de polimerización de olefinas utilizan Ti (III).
Los alquinos también pueden coordinarse con átomos metálicos. Dibujar los orbitales moleculares involucrados en:
a) Donación de alquinos al metal
b) donación de metal al alquino
- Contestar
-
Agrega textos aquí. No borre primero este texto.
Explicar las diferencias observadas en las constantes de equilibrio para la formación de complejos de plata (I) con los siguientes alquenos:
a) CH 2 CH 2: K = 22.3
b) cis-CH 3 CHCHCH 2 CH 2 CH 3: K = 3.1
c) Trans-CH 3 CHCHCH 2 CH 2 CH 3: K = 0.8
- Contestar
-
Utilizaremos (a), la constante de unión entre Ag (I) y etileno o eteno (CH 2 =CH 2), como nuestro valor basal. Otras constantes se compararán con esta para buscar una tendencia.
En (b), la constante de unión es mucho menor, por lo que el ion plata se une a cis -2-hexeno mucho menos fuertemente que al eteno. Este es solo otro alqueno, como el eteno, pero en lugar de tener solo átomos de hidrógeno unidos a la unidad C=C, el cis-2-hexeno tiene algunas otras cosas. Tal vez esta otra cosa cause algún problema para la unión de alquenos. La diferencia obvia entre los átomos de hidrógeno y esta otra cosa es que esta otra cosa es más grande. Tal vez el complejo se llena demasiado cuando el cis-2-hexeno se une al ion plata.
Muy a menudo cuando vemos iones metálicos en el papel, no estamos tratando con iones metálicos desnudos en la realidad. El ion a menudo tiene otros ligandos ya unidos a él al principio, como las moléculas de agua, y lo que a veces estamos viendo es el reemplazo de un viejo ligando por un nuevo ligando. Otros ligandos unidos a la plata podrían empeorar aún más los problemas de hacinamiento.
También hay una explicación alternativa. Si compara dos alquenos que difieren sólo en el número de hidrógenos unidos al doble enlace, como 1-buteno, CH 2 =CHCH 2 CH 3, y 2-buteno, CH 3 CH=CHCH 3, invariablemente encuentras que el alqueno con menos hidrógenos unidos al doble enlace (y más otras cosas) es más estable. Los “alquenos terminales”, con dobles enlaces en los extremos de la cadena, son siempre menos estables que los “alquenos internos”, con dobles enlaces en algún lugar a lo largo de la mitad de la cadena. Esta diferencia se puede explicar mirando algunos cálculos mecánicos cuánticos, pero no vamos a hacer eso ahora mismo.
El punto es que la diferencia en esta reacción podría ser causada, no por los complejos alquenos, sino por los propios alquenos, del otro lado del perfil de reacción. Es importante recordar que las constantes de equilibrio siempre comparan dos lados de una reacción. El eteno, que tiene menos sustituyentes en el doble enlace que el cis-2-hexeno (“sustituyentes” es una palabra de cuatro sílabas para “otras cosas”), puede ser simplemente menos estable y más reactivo.
¿Alguna de estas ideas se sostiene en los otros ejemplos?
En (c), el trans -2-hexeno se une incluso con menos fuerza que el cis-2-hexeno. Podríamos argumentar que en un complejo cis-2-hexeno, los sustituyentes, que están en el mismo lado del doble enlace, podrían mantenerse alejados de otros ligandos en el metal que pueden exacerbar los problemas de hacinamiento. Eso sería más difícil de hacer con el trans-2-hexeno, ya que un sustituyente está a cada lado del doble enlace. Puede ser posible alejar un sustituyente del hacinamiento, pero probablemente no ambos.
Una vez más, aquí también se sostiene la explicación alternativa. cis -2-hexeno es menos estable que el trans -2-hexeno, debido a que los sustituyentes en el doble enlace se agolpan entre sí en cis-2-hexeno, pero se mantienen alejados entre sí en trans -2-hexeno. Entonces tal vez el cis -2-hexeno se une más fácilmente al ion plata porque es más reactivo.

