2.6: Hapticidad
- Page ID
- 79610
Cuando un par solitario está unido a un metal de transición, entonces el átomo con el par solitario está formando un enlace con el metal. Cuando se coordina un enlace pi, ¿qué átomo está unido al metal? Ambos. Tres átomos están involucrados en esta situación de unión, en lugar de solo dos. Ambos carbonos que forman el enlace pi original ahora están donando ese enlace pi al metal.
Cuando los ligandos se unen a un metal a través de un sistema pi conjugado, describir el modo de unión puede parecer aún más complicado. Si hay dos dobles enlaces seguidos, entonces los cuatro átomos que forman esos dos enlaces pi están donando al metal. Además, debido a que el enlace está conjugado, podemos pensar en esto como un enlace pi largo. El enlace del enlace pi al metal involucra los cuatro átomos donantes, más el átomo metálico.
Contraste esa situación con dos enlaces pi separados que no estén conjugados. Si un ligando contiene dos enlaces pi separados, es un donante bidentado. Los ligandos bidentados se unen a través de dos sitios donantes. Pensamos en un ligando como 1,2-etanodiamina como unión a través de los pares solitarios en ambos átomos de nitrógeno. Pensaríamos en 1,5-hexadieno como unión a través del enlace pi en cada extremo de la cadena. Sin embargo, el 1,3-butadieno es un poco diferente, debido a la participación de los cuatro carbonos en la unión al metal a través de un enlace conjugado.
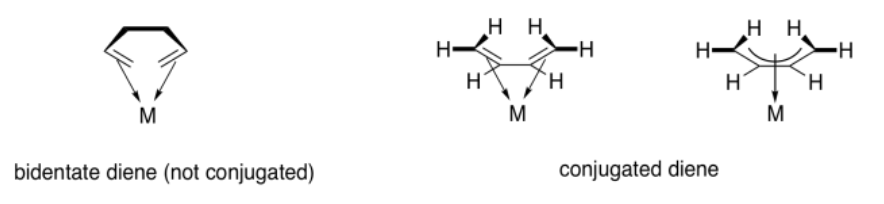
El término utilizado para describir la participación de múltiples átomos simultáneamente durante la coordinación pi es hapticidad. Un alqueno regular, como el eteno o el propeno, es un donante diháptico; dos carbonos participan en la donación de un enlace al metal. Un alqueno conjugado, como el 1,3-butadieno, es un donante tetraháptico. Cuatro carbonos participan en la donación de un enlace pi conjugado al metal. Por supuesto, este dieno conjugado puede donar cuatro electrones a la vez, formando algo un poco como un doble enlace al metal.
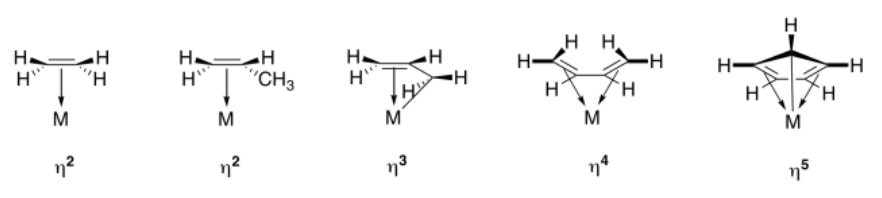
En los dibujos anteriores, los símbolos, η 2 o η 3, etc. (léase “eta-dos” o “eta-tres”) se refieren a la hapticidad del ligando. Un ligando η 2 es diháptico, con dos átomos que comparten la donación del sistema pi; un ligando η 3 es triháptico, con tres átomos que comparten la donación del sistema pi conjugado.
Los siguientes alquenos forman complejos con plata. Describir su probable modo de encuadernación como η 2, etc.:
- CH 2 CHCHCH 2
- CH 2 CHCH 2 CHCH 2
- CH 2 CHCH 2 CH 2 CHCH 2
- CH 2 CHCHCHCHCH 2
- Contestar a
-
Aquí hay dos dobles enlaces, y están conjugados: CH 2 =CH-CH=CH 2. El doble enlace conjugado permitiría que el ligando se uniera a η 4.
- Respuesta b
-
Aquí hay dos dobles enlaces, pero no están conjugados: CH 2 =CH-CH 2 -CH=CH 2. Cada doble enlace se uniría a η 2, y el ligando sería capaz de unirse de manera bidentado, pero como los dobles enlaces no están conjugados y se unen todos en una fila, no se describiría la unión como η 4. Lo más comúnmente sería descrito como η 2, η 2; eso simplemente significa que cada doble enlace es un η 2 -donante, y hay dos de ellos. También podría considerarse donante de κ 2 por su denticidad.
- Respuesta c
-
Este es otro caso no conjugado: CH 2 =CH-CH 2 -CH 2 -CH=CH 2. En términos de hapticidad, podría describirse como η 2, η 2.
- Respuesta d
-
Aquí hay tres dobles enlaces, y están conjugados: CH 2 =CH-CH=CH-CH=CH 2. El doble enlace conjugado permitiría que el ligando se uniera a η 6.
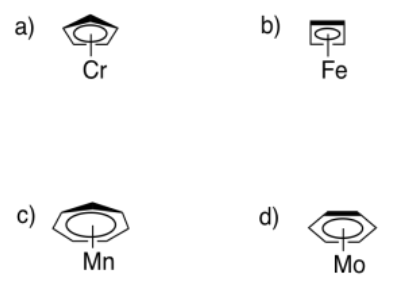
Los sistemas cíclicos conjugados hacen buenos ligandos para metales de transición. En cada uno de los siguientes casos,
- describir la hapticidad.
- indicar el número de electrones donados al metal.
- indican la carga en el ligando.
- Contestar a
-
El ligando está unido η 5; dona 6 electrones, de dos dobles enlaces y un par solitario; el ligando tiene una carga de -1.
- Respuesta b
-
El ligando está unido η 4; dona 4 electrones, a partir de dos dobles enlaces; el ligando no tiene carga.
- Respuesta c
-
El ligando está unido η 7; dona 8 electrones, de tres dobles enlaces y un par solitario; el ligando tiene una carga de -1.
- Respuesta d
-
El ligando está unido η 6; dona 6 electrones, de tres dobles enlaces; el ligando no tiene carga.
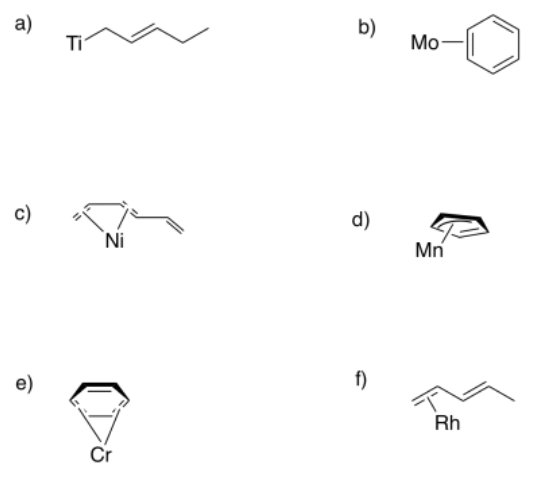
En ocasiones, los ligandos conjugados pueden “deslizarse”, donando menos del número máximo de electrones al metal. En los siguientes casos, indicar:
i) la hapticidad mostrada en la imagen.
ii) la máxima hapticidad posible con el ligando.
- Contestar a
-
El ligando está unido η 1; dona un par solitario; sin embargo, podría donar un enlace pi adicional y luego uniría η 3.
- Respuesta b
-
El ligando está unido η 2; dona un enlace pi; sin embargo, podría donar dos enlaces pi más y luego uniría η 6.
- Respuesta c
-
El ligando está unido η 4; dona dos enlaces pi; sin embargo, podría donar un enlace pi más y luego uniría η 6.
- Respuesta d
-
El ligando está unido η 3; dona un par solitario y un enlace pi; sin embargo, podría donar un enlace pi adicional y luego uniría η 5.
- Respuesta e
-
El ligando está unido η 4; dona dos enlaces pi; sin embargo, podría donar un enlace pi más y luego uniría η 6.
- Respuesta f
-
El ligando está unido η 2; dona un enlace pi; sin embargo, podría donar un enlace pi más y luego uniría η 4.
Uno de los ligandos multidentados más comunes es el anión ciclopentadienilo, a menudo abreviado Cp.

- CPh es fácilmente desprotonado para formar Cp -. Explique por qué.
- ¿Cuántos electrones dona Cp a un metal?
- El arquetípico complejo Cp es ferroceno, Cp 2 Fe, cuya estructura fue determinada por Geoff Wilkinson, en obra que lo llevó a ser galardonado con el Premio Nobel en 1973. Dibujar la estructura del ferroceno.
- Contar los electrones sobre el hierro en ferroceno.
- Contestar a
-
El anión resultante tiene estabilidad aromática. Es cíclico, totalmente conjugado, plano y tiene un número impar de pares de electrones.
- Respuesta b
-
El anión Cp podría unirse a un metal a través de solo un par o a través de dos pares, pero en la mayoría de los casos se unirá a través de tres pares de electrones.
- Respuesta d
-
Recuento de valencia en metal: 8
Cuenta con metal, corrigiendo para +2 carga: 6
Donado de ligandos: 2 x 6 = 12
Total: 18
Predecir los modos de unión más probables de los siguientes ligandos (monodentado, triháptico, etc.).
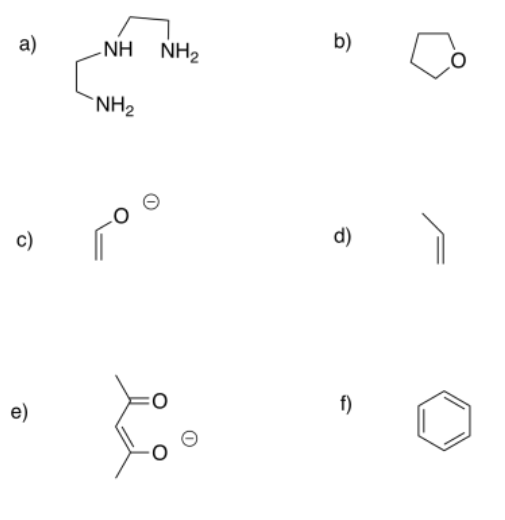
- Responder
-

Utilizando ideas de denticidad, explicar las diferencias observadas en las constantes de equilibrio para la formación de complejos de plata (I) de los siguientes alquenos:
- CH 2 =CHCH=CH 2; K = 4.2
- CH 2 =CHCH 2 CH=CH 2; K = 10.2
- CH 2 =CHCH 2 CH 2 CH=CH 2; K = 28.8
- Responder
-
Este problema se ocupa del “ángulo de mordida” del ligando. Recuerde, una cadena de átomos se vuelve más flexible cuanto más se alarga, debido a la posibilidad de rotación alrededor de cada enlace a lo largo de la cadena. A medida que los dos dobles enlaces se alejan entre sí (uno se separa en (a), dos enlaces separados en (b) y tres enlaces separados en (c), la cadena puede “abrirse” y unirse con una superposición más óptima con el metal.

