2.7: Conceptos ácidos y bases duros y blandos
- Page ID
- 79583
No todos los metales forman complejos de coordinación con todos los ligandos posibles. Algunos metales tienen más probabilidades de formar compuestos con ciertos ligandos. Esta observación finalmente ha llevado a un sistema de clasificación llamado Ácidos y Bases Duros y Blandos (HSAB).
En pocas palabras, los iones metálicos más pequeños o con mayor carga se denominan ácidos duros. Es más probable que se unan a bases duras, que suelen tener pequeños átomos donadores como el oxígeno o el nitrógeno. Los ácidos duros típicos son el titanio (IV), el tántalo (V), el magnesio (II) y el litio (I). Óxido, hidróxido y carbonato (CO 3 2-) son algunas bases duras típicas.
Los iones metálicos más grandes y polarizables con cargas más bajas se denominan ácidos blandos. “Polarizable” significa que tienen grandes nubes de electrones fácilmente distorsionadas. Es más probable que se unan a bases blandas, que suelen ser aniones grandes como sulfuro o seleniuro.
- Los ácidos “duros” son pequeños o están muy cargados
- Los ácidos “blandos” son más grandes o más polarizables o tienen una carga más baja
- Las bases “duras” contienen átomos donantes más pequeños y menos polarizables, generalmente oxígeno o nitrógeno
- Las bases “blandas” contienen átomos donantes más grandes y polarizables, como azufre o fósforo
- los iones duros tienden a unirse bien entre sí; los iones blandos tienden a unirse bien
Sugiera cuál de los siguientes iones es más duro.
a) zinc (II) o mercurio (II) b) potasio (I) o cobre (I) c) hierro (II) o hierro (III)
- Contestar a
-
Zn (II), porque es más pequeño y menos polarizable.
- Respuesta b
-
K +, porque es menos electronegativo.
- Respuesta c
-
Fe (III), por la mayor carga.
Sugiera cuál de las siguientes bases es más suave.
a) Me 3 P o Me 3 N b) cloruro o yoduro c) amida (NH 2 -) o azida (N 3 -)
- Contestar a
-
Me 3 P, porque el fósforo es más grande y más polarizable que el nitrógeno.
- Respuesta b
-
El yoduro, que es más grande y más polarizable que el cloruro.
- Respuesta c
-
Azida, que tiene un sistema de unión pi más polarizable y deslocalizado.
Hay algunas aplicaciones obvias de HSAB en metalurgia y geología. Algunos minerales comunes de los metales duros son rutilo (óxido de titanio, TiO 2), dolomita (carbonato de magnesio y calcio CaMg (CO 3) 2) y cromita (óxido de hierro y cromo, FeCrO 4). Fluoruros, carbonatos, óxidos, fosfatos y sulfatos son ejemplos de bases duras.
Algunos minerales prevalentes de los metales blandos son la galena (sulfuro de plomo, PbS 2) y el cinabrio (sulfuro de mercurio, HG). Los sulfuros son las bases blandas más comunes en geología, aunque los haluros más grandes, como el bromuro y el yoduro, también son blandos.
Algunos metales pueden emparejarse con bases duras o blandas, particularmente aquellos metales de la mitad del grupo de metales de transición. Por ejemplo, el hierro (III) a menudo se encuentra como hematita (óxido de hierro, Fe 2 O 3), mientras que el hierro (II) también se puede encontrar como pirita (sulfuro de hierro, FeS). El molibdeno (VI) se puede encontrar como powellita (óxido de calcio y molibdeno, CaMoO 4), pero el mineral más comúnmente extraído contiene molibdeno (IV), que se encuentra en molibdenita (MoS 2).
Proponer una fórmula para un mineral plausible que contenga cada uno de los siguientes iones.
a) circonio (IV) b) cadmio (II) c) tungsteno (VI)
d) zinc (II) e) cobre (I)
- Contestar a
-
ZrO 2
- Respuesta b
-
CDs
- Respuesta c
-
WO 3
- Respuesta d
-
ZnS
- Respuesta e
-
Cu 2 S
En biología, los metales muestran aspectos de la química de ácidos y bases duros y blandos. Los iones de potasio relativamente duros se unen a los átomos de oxígeno en el ADN para ayudar a estabilizar la estructura de la hélice. La calmodulina, utilizada para ayudar en la absorción de calcio, utiliza donantes de oxígeno duro en aspartato y glutamato para unirse al Ca 2+.
Por otro lado, el cobre (I) es un ácido blando. En la plastocianina de álamo, que ayuda a transferir electrones durante las reacciones en la célula vegetal, el ion cobre se coordina con dos histidinas donadoras de nitrógeno y dos donantes de azufre, una cisteína y una metionina.
Muchos iones metálicos biológicamente importantes caen dentro de la categoría “límite” entre duros y blandos. El hierro es uno de los elementos más abundantes en la tierra, y muchos compuestos de hierro juegan un papel importante en la biología. Muchos compuestos biológicos contienen hierro (II), que es capaz de unirse bien tanto a ligandos duros como blandos. En consecuencia, se encuentra con donantes aniónicos de carboxilato de oxígeno en metano monooxigenasa, donadores de porfirina de nitrógeno neutro y aniónico en proteínas hemo, y cisteínas y sulfuros de azufre en ferridoxinas y otros conglomerados de hierro-azufre.
Los fenómenos ácidos y bases duros y blandos se han estudiado utilizando la teoría orbital molecular y otros enfoques cuantitativos. En la teoría MO, se ha demostrado que las interacciones entre aniones duros y cationes se caracterizan por grandes separaciones HOMO-LUMO, mientras que las interacciones entre aniones blandos y cationes se caracterizan por pequeñas separaciones HOMO-LUMO. En otras palabras, las interacciones ácido-base duras están dominadas por un carácter más fuertemente iónico, pero las interacciones ácido-base blandas están dominadas por un carácter más fuertemente covalente.
Los iones de mercurio, Hg (I) y Hg (II), son particularmente venenosos. Pueden desplazar otros metales de las enzimas, para que las enzimas dejen de funcionar.
a) ¿Estos iones son duros o blandos?
b) ¿qué residuos de aminoácidos probablemente se unirían a ellos?
- Contestar a
-
Hg (I) y Hg (II) son iones grandes y polarizables. Son cationes blandos y deben unirse bien a los donantes blandos.
- Respuesta b
-
El donante blando más común es un átomo de azufre o ion sulfuro; en aminoácidos, eso sugiere cisteína o metionina.
La enterobactina (abajo) es una molécula utilizada por ciertas bacterias para unirse al hierro (III) y transportarlo a la célula. La constante de formación para el complejo hierro (III) -enterobactina es de aproximadamente 10 49. Proporcionar razones por las que la constante de formación es tan alta.
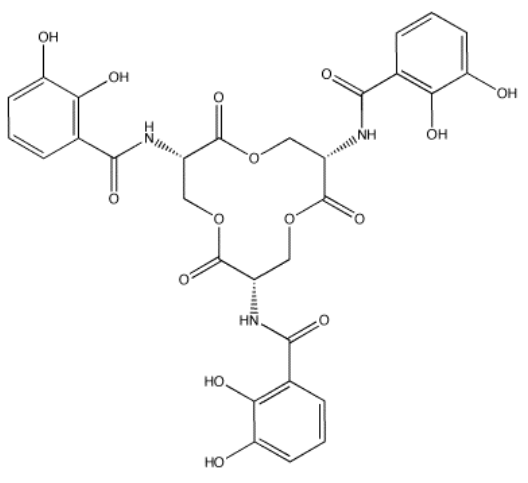
- Contestar
-
El Fe (III) es un catión duro y debe unirse bien a los donantes de oxígeno. La enterobactina tiene varios donantes de oxígeno que podría proporcionar al hierro. De hecho, hay un par de grupos OH en cada uno de los anillos de benceno en la enterobactina. Estos anillos de benceno con dos grupos OH uno al lado del otro se llaman “catecoles”. Debido a que hay tres de estos grupos en la enterobactina, y hay suficiente espacio en el medio para que los grupos se plieguen alrededor de un átomo central, la enterobactina es un donante quelante (hexadentado) con una alta constante de unión.

