2.8: Teoría de Campo de Ligando
- Page ID
- 79598
Los conceptos de la teoría orbital molecular son útiles para comprender la reactividad de los compuestos de coordinación. Una de las formas básicas de aplicar los conceptos MO a la química de coordinación es en la Teoría de Campo de Ligando. La Teoría del Campo de Ligando analiza el efecto de los átomos donantes sobre la energía de d orbitales en el complejo metálico.
Hay dos formas en las que a veces pensamos en el efecto de los ligandos sobre los electrones d sobre un metal. Sobre la base de la simple repulsión electrón-electrón, la donación de un par solitario podría elevar un orbital d ocupado en energía. Alternativamente, podemos pensar en interacciones de unión entre orbitales de ligandos y orbitales d. Esta segunda forma de pensar sobre las cosas es un poco más útil, y ese es el enfoque en el que nos centraremos, aquí.
De cualquier manera, existen interacciones entre los electrones ligando y los electrones d, que generalmente terminan elevando los electrones d en energía. El efecto depende de la geometría de coordinación de los ligandos. Los ligandos en una esfera de coordinación tetraédrica tendrán un efecto diferente al de los ligandos en una esfera de coordinación octaédrica, ya que interactuarán con los diferentes orbitales d de diferentes maneras.
La Teoría del Campo de Ligando analiza el efecto de los átomos donantes sobre la energía de d orbitales en el complejo metálico. El efecto depende de la geometría de la geometría de coordinación de los ligandos.
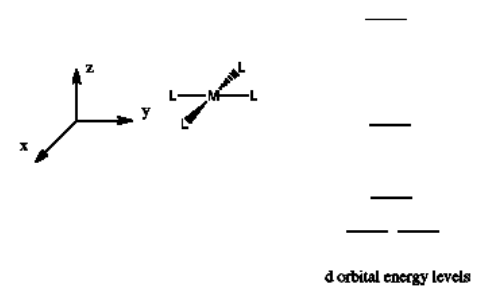
Estuche octaédrico
Supongamos que un complejo tiene una esfera de coordinación octaédrica. Supongamos que los seis ligandos se encuentran a lo largo de los ejes x, y y z.
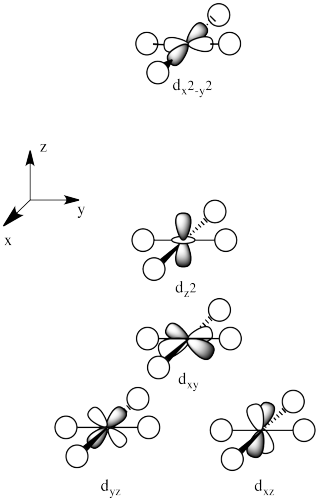
Hay dos orbitales d que interaccionarán muy fuertemente con estos ligandos: el d x 2 -y 2, que se encuentra directamente sobre los ejes x e y, y el d z 2, que se encuentra directamente sobre el eje z. Juntos, estos dos orbitales metálicos y los orbitales ligando que interactúan con ellos formarán nuevos orbitales moleculares de unión y antiunión.
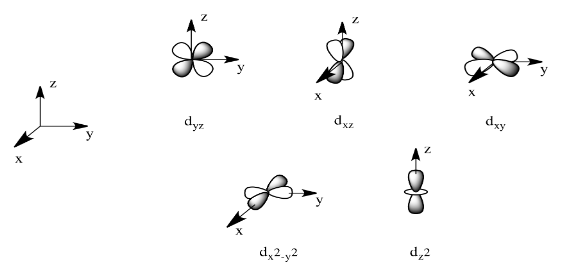
El dibujo a continuación se simplifica. Los ligandos también interactuarán con los orbitales s y p, pero de momento no nos vamos a preocupar por ellos. Tampoco nos preocuparemos por las interacciones de los otros cuatro ligandos con los orbitales d (posible por consideraciones de simetría, pero también por una imagen más complicada).
Ahora bien, recuerde que los metales suelen tener d electrones que son mucho más altos en energía que los de los átomos donadores típicos (como oxígeno, azufre, nitrógeno o fósforo). Eso significa que las combinaciones antiadherentes estarán mucho más cercanas en energía a los orbitales d originales, porque ambas son relativamente altas en energía. La combinación de unión será mucho más cercana en energía a los orbitales del ligando original, porque estos son todos relativamente bajos en energía.
Esa similitud energética generalmente se traduce en una similitud en forma y ubicación también. En otras palabras, la combinación antiunión entre un orbital d y un orbital ligando es muy similar al orbital d original. La combinación de unión se parece más al orbital del ligando original que al orbital d original. Debido a esas similitudes, los químicos inorgánicos suelen referirse a esos orbitales antiadherentes como si todavía fueran los orbitales d originales.
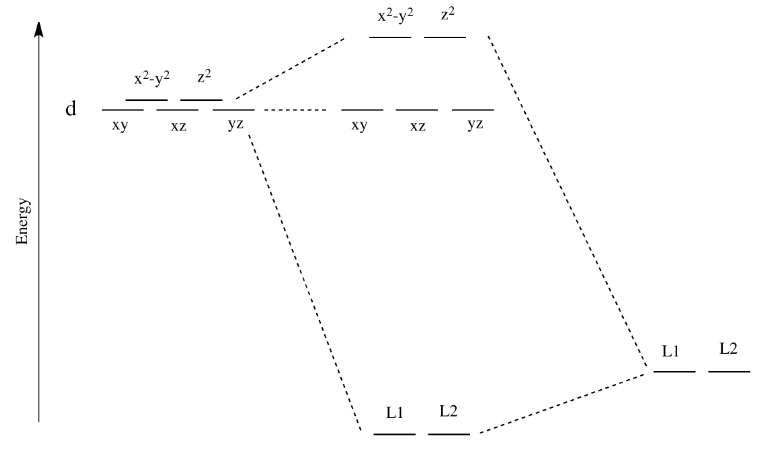
Estos dos orbitales serán elevados relativamente altos en energía por interacciones de unión sigma con los orbitales donantes. Si hay electrones en la imagen, podría verse algo así:
- Supongamos que los seis ligandos se encuentran a lo largo de los ejes x, y y z.
- Los orbitales d x 2 -y 2 y d z 2 se encuentran a lo largo de los ejes de enlace.
- Estos dos orbitales serán elevados relativamente altos en energía.
- Estos orbitales son como niveles antiadherentes.
- A estos orbitales se les llama a veces el conjunto "e g" de orbitales. El término “e g" proviene de las matemáticas de la simetría.
Por otro lado, los otros tres orbitales d, los d xy, d xz y d yz, se encuentran todos entre los ligandos donantes, en lugar de golpearlos de frente. Estos orbitales interactuarán menos fuertemente con los electrones donantes.
- Los orbitales d xy, d xz y d yz se encuentran entre los ejes de enlace.
- Estos tres orbitales serán cambiados en energía sólo un poco.
- Estos orbitales se parecen más a orbitales no ligantes.
- A estos orbitales se les llama a veces el conjunto de orbitales "t 2g".
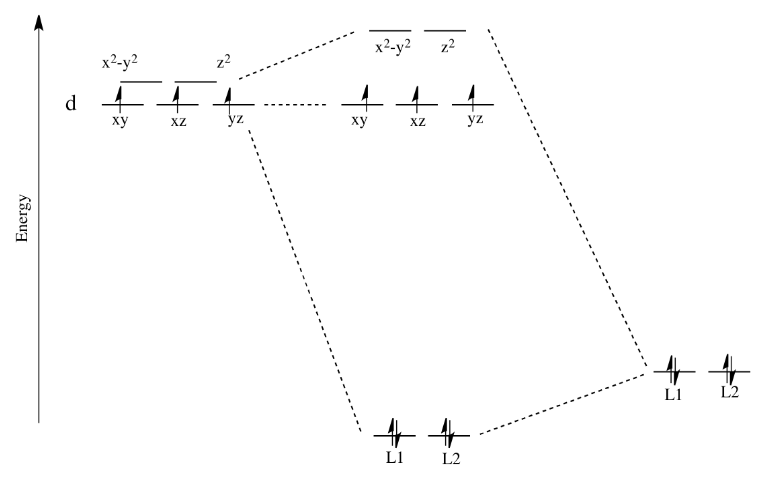
Recuerde, solo la energía de los electrones afecta a la energía general del sistema. Los orbitales d desocupados se elevan en energía, pero los orbitales ocupados bajan en energía (o de lo contrario permanecen iguales).
Aparte de la estabilización del complejo, hay otra consecuencia de este panorama. Lo que nos queda son dos conjuntos distintos de d niveles de energía, uno más bajo que el otro. Eso tendrá un efecto sobre la configuración electrónica en el átomo metálico en el complejo. Eso significa que habrá casos en los que los electrones podrían estar emparejados o desapareados, dependiendo de cómo se ocupen estos orbitales.
Tomemos el caso del ion hierro (II) biológicamente importante. Tiene una configuración de electrones de valencia d 6. En el lenguaje menos formal de la química inorgánica, “el hierro (II) es d 6”. En un ion hierro (II) solo en el espacio, todos los d-obitales tendrían el mismo nivel de energía. Pondríamos un electrón en cada orbital, y nos quedaría uno. Tendría que emparejarse en uno de los orbitales d. (Observe que, en la química de los iones de metales de transición, siempre se asume que los orbitales de valencia s y p están desocupados).
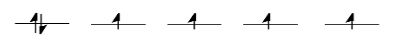
Las cosas son muy diferentes en un complejo octaédrico, como K 4 [Fe (CN) 6]. En ese caso, los d orbitales ya no están al mismo nivel de energía. Hay dos configuraciones posibles a considerar.
En un caso, un electrón entraría en cada uno de los orbitales d de menor energía. Se haría una elección para el cuarto electrón. ¿Entra en el orbital d de mayor energía, o se empareja con uno de los electrones d de menor energía? La elección depende de cuánto más altos en energía sean los orbitales d superiores, en comparación con la cantidad de energía que cuesta poner dos electrones en el mismo orbital d.
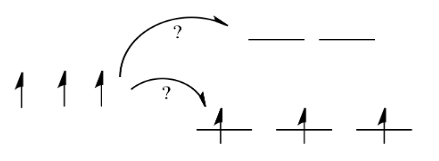
Si la “energía de división orbital d” es bastante baja, de modo que los dos conjuntos de d orbitales siguen siendo bastante similares en energía, el siguiente electrón puede entrar en un orbital superior. No se requeriría el emparejamiento hasta el electrón final. En general, eso dejaría cuatro electrones desapareados, al igual que en el caso de un ion metálico solitario en el espacio. A esto se le llama el caso de “alto espín”, porque los electrones pueden entrar fácilmente en el orbital superior.
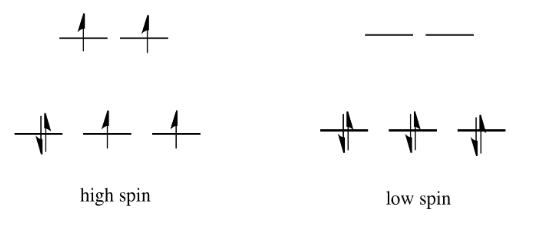
Si la energía de división orbital d es demasiado alta, el siguiente electrón debe emparejarse en un orbital inferior. Los tres electrones restantes se emparejan, por lo que no hay electrones desapareados en el complejo. A esto se le llama el caso de “bajo giro”, porque los electrones se emparejan más fácilmente en el orbital.
Entonces la regla general es que si la energía para emparejar los electrones es mayor que la energía necesaria para llegar al siguiente nivel, el electrón seguirá adelante y ocupará el siguiente nivel.
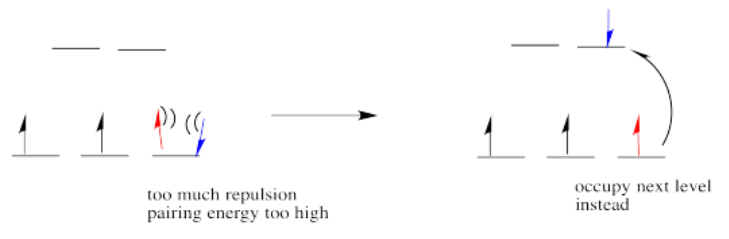
Sin embargo, si la energía que se necesita para llegar al siguiente nivel es más de lo que costaría emparejarse, los electrones simplemente se emparejarán en su lugar.
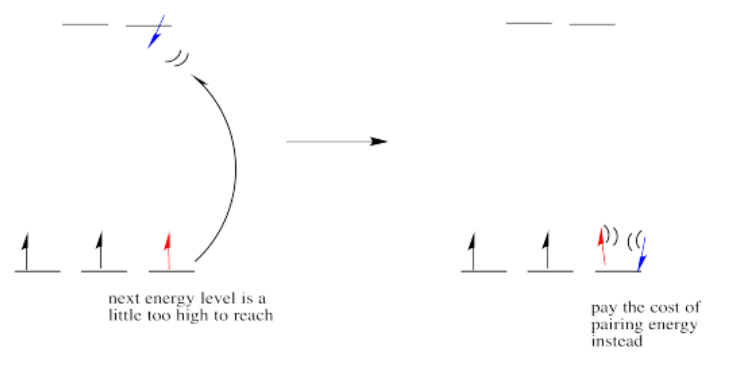
La configuración electrónica puede ser de “espín alto” o “bajo espín”, dependiendo de qué tan grande sea la división de energía entre los dos conjuntos de d orbitales.
La diferencia entre el caso de espín alto y el caso de espín bajo es significativa, ya que los electrones desapareados afectan las propiedades magnéticas de un material. El caso de bajo giro sería diamagnético, no resultando en interacción con un campo magnético. Sin embargo, el caso de alto giro sería paramagnético y sería atraído por un campo magnético.
Resulta que K 4 [Fe (CN) 6] es diamagnético. Por lo tanto, es bastante claro que se trata de un complejo de bajo giro. La diferencia de energía entre los dos niveles orbitales d es relativamente grande en este caso.
Además de influir en las propiedades magnéticas, si un complejo es de alto o bajo espín también influye en la reactividad. Los compuestos con electrones d de alta energía son generalmente más lábiles, lo que significa que dejan ir los ligandos más fácilmente.
- la configuración de electrones influye en las propiedades magnéticas
- la configuración electrónica influye en la labilidad (con qué facilidad se liberan los ligandos)
Razones para el centrifugado bajo vs. alto centrifugado: el efecto del ion metálico
Existen algunos factores que determinan la magnitud de la división orbital d, y si un electrón puede ocupar el conjunto de orbitales de mayor energía, en lugar de emparejarse. Se basa en parte en la fuerza del campo del ligando, que se explora en la página siguiente. También depende de la carga del ion metálico, y de si el metal está en la primera, segunda o tercera fila de los metales de transición.
Cuanto mayor sea la carga sobre el metal, mayor será la división entre los d niveles de energía orbitales. Por ejemplo, el Fe (II) suele ser de alto giro. Tiene una división menor entre los niveles orbitales d inferior y superior, por lo que los electrones pueden ir más fácilmente al nivel superior en lugar de emparejarse un nivel inferior.
Por otro lado, el Fe (III) suele ser de bajo giro. Tiene una división mayor entre los niveles d. En ese caso, cuesta menos energía que los electrones se emparejen en el nivel inferior que subir al nivel superior.
- Los casos de giro alto versus giro bajo implican una compensación entre la energía de división orbital d y la energía de emparejamiento.
- Los metales de transición de la segunda y tercera fila suelen ser de bajo giro
- Los metales de transición de la 1ª fila suelen ser de alto giro
- Sin embargo, los metales de transición de la 1ª fila y tienen un giro bajo si son muy positivos (generalmente 3+ o mayores)
Están pasando muchas cosas en los iones metálicos, pero tomaremos una visión simplificada de las cosas. Pensando sólo en electrostática, podemos tratar de imaginar qué sucede con esos electrones cuando cambia la carga sobre el ion metálico.
Primero necesitamos saber sobre la ley de Coulomb. La ley de Coulomb establece que la fuerza de atracción entre el electrón y el núcleo depende únicamente de dos factores: la cantidad de carga positiva en el núcleo, y la distancia entre el núcleo y el electrón.
Cuanto mayor es la carga sobre el núcleo, mayor es la atracción entre el electrón y el núcleo.
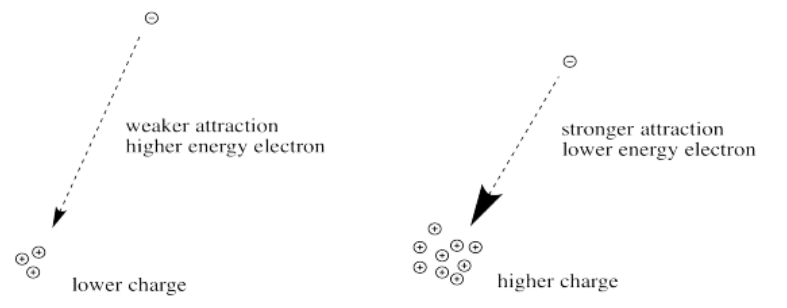
Cuanto más lejos está un electrón del núcleo, más débil es la atracción entre el electrón y el núcleo.
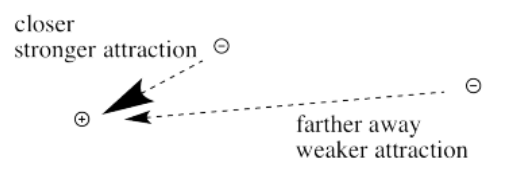
La ley de Coulomb puede ser utilizada para evaluar la energía potencial del electrón. Es uno de los factores que determina qué tan altos o bajos son esos niveles de energía electrónica que vemos en los diagramas de niveles de energía para átomos, iones y moléculas. La energía del electrón varía de una manera más o menos similar: cuanto mayor es la carga en el núcleo, menor es la energía del electrón. Además, cuanto más cerca está el electrón del núcleo, menor es su energía.
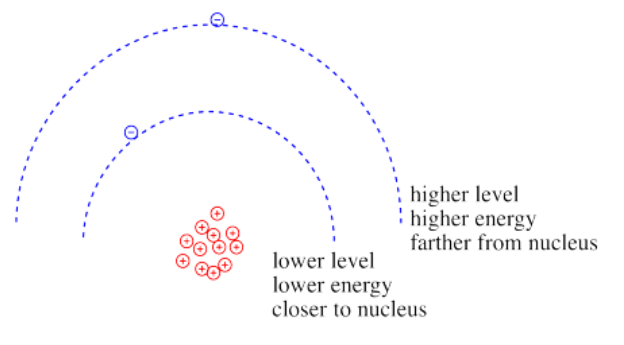
En términos generales, los electrones a mayor energía están más lejos del núcleo. Los electrones a menor energía están más cerca del núcleo.
¿Qué pasa si aumenta la carga? A lo mejor se agregan muchos más protones al núcleo. A lo mejor se pierden algunos electrones, de modo que a los electrones restantes simplemente se siente como si la carga del núcleo hubiera aumentado. Entonces los electrones deberían ser más atraídos por el núcleo. Se acercan un poco más. Su energía potencial cae.
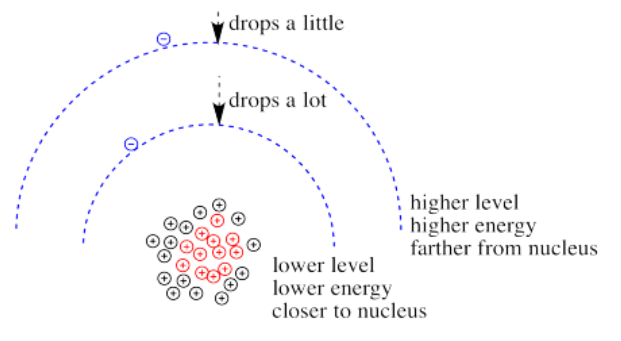
Por supuesto, si un electrón ya está más cerca del núcleo, se siente ese incremento en la carga positiva con más fuerza que un electrón que está más lejos. En consecuencia, cae más en energía que un electrón que está más lejos.
Si traducimos esa idea en una imagen de los d niveles de energía orbitales en una geometría octaédrica, se ve así:
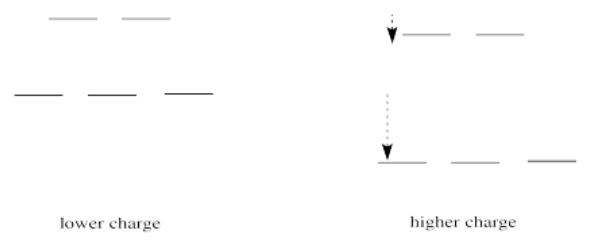
Cuando se incrementa la carga sobre el ion metálico, tanto los niveles superiores como los inferiores bajan de energía. Sin embargo, el nivel inferior baja más. Así, la brecha entre los niveles se hace más amplia.
Los metales en la segunda y tercera fila de la tabla periódica casi nunca forman complejos de alto espín. La división de energía orbital d en estos casos es mayor que para los metales de la primera fila. Desde un punto de vista muy simple, estos metales tienen muchos más protones en sus núcleos que los metales de transición de la primera fila, dejando caer ese conjunto inferior de electrones d más bajo con respecto al conjunto superior.
Sin embargo, ese no es el panorama completo de los metales de transición de la segunda y tercera fila. Recuerden, estamos simplificando, y hay factores en los que no vamos a entrar. Sin embargo, es importante saber que las resistencias de enlace metal-ligando son mucho mayores en la segunda y tercera fila que en la primera. Ahora veremos todo el diagrama de interacción para un complejo octaédrico, incluidas las contribuciones de los orbitales s y p metálicos.
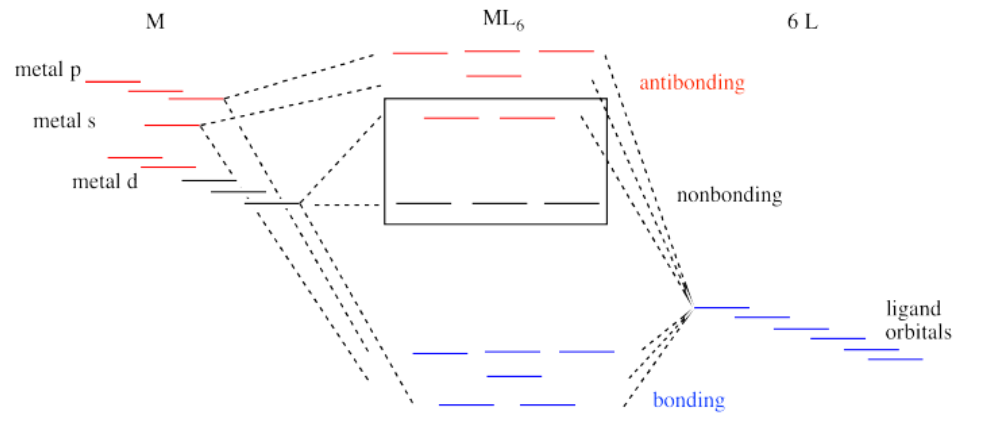
Como todos los diagramas de interacción ligando-metal, los niveles de energía de los ligandos por sí mismos se muestran en un lado. Los niveles de energía electrónica del metal se muestran en el otro lado. El resultado de su interacción, un complejo metal-ligando, se muestra en el medio. El diagrama de división orbital d se muestra en una caja.
Supongamos que el diagrama anterior es para un metal de transición de primera fila. El diagrama para un metal de segunda o tercera fila es similar, pero con uniones más fuertes.
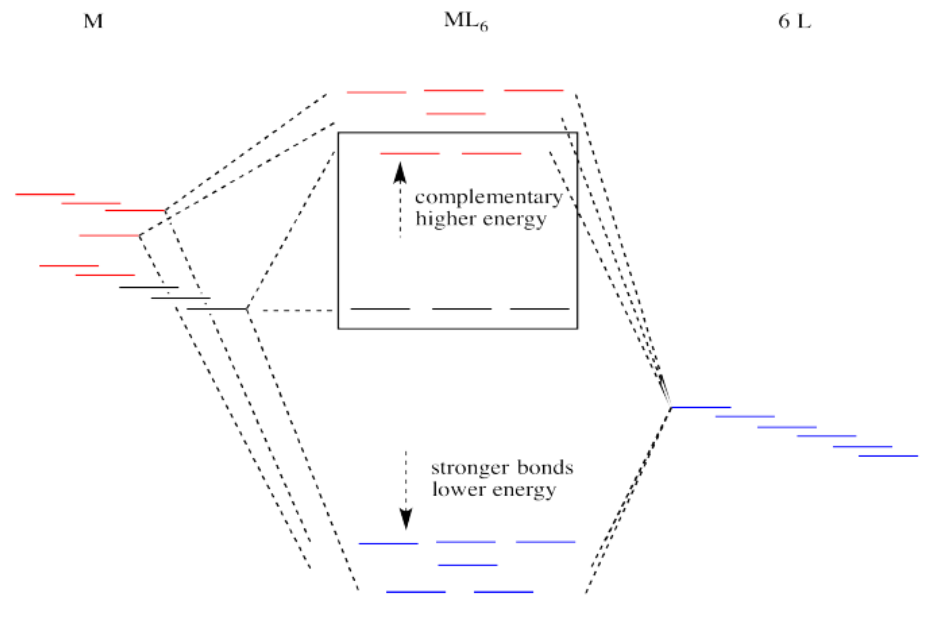
Si la interacción de unión es más fuerte entre el metal y el ligando, entonces también lo es la interacción antiunión. Los niveles de antiadherencia son más altos en energía a medida que los niveles de unión se hunden más bajos. Generalmente eso está bien, porque cuando se rellenan los electrones, se encontrarán preferentemente en los niveles inferiores, no en los superiores. Habrá un descenso neto de la energía electrónica.
¿Por qué los metales de transición de segunda y tercera fila forman enlaces tan fuertes? Las fortalezas de unión son muy complicadas. En general, existe una mayor covalencia entre estos metales y sus ligandos debido al mayor solapamiento espacial y energético. En lugar de entrar en esos factores, solo pensaremos en todos esos protones adicionales en el núcleo que están atrayendo más fuertemente a los electrones ligandos.
Hay una distinción más importante que hace que los metales de transición de segunda y tercera fila tengan un bajo giro. Además, la energía de emparejamiento es menor en estos metales debido a que los orbitales son más grandes. Hay más espacio para dos electrones en un orbital, con menos repulsión. Como resultado, es mucho más probable que los electrones se emparejen que ocupen el siguiente nivel de energía.
- Los metales de transición de segunda y tercera fila tienen enlaces más fuertes, lo que lleva a un mayor espacio entre los niveles orbitales d
- Los metales de transición de la 2ª y 3ª fila tienen orbitales más difusos, lo que lleva a una menor energía de emparejamiento
Es significativo que los iones de metales de transición más importantes en biología sean de la primera fila del bloque de transición y sean bastante lábiles. Ese hecho juega un papel importante en la facilidad de formación y deconstrucción de proteínas que contienen metales de transición. En términos de formación, si el metal es liberado más fácilmente por sus ligandos anteriores (ya sea agua o algún compuesto que entregue el metal al sitio de construcción de la proteína), puede formar la proteína necesaria más rápidamente. Sin embargo, incluso si una enzima que contiene metal juega un papel útil, no debe ser demasiado estable, porque necesitamos ser capaces de regular el nivel de concentración de proteína para una actividad óptima, o desensamblar la proteína si se daña. Por lo tanto, es importante que el ion metálico se pueda eliminar fácilmente.
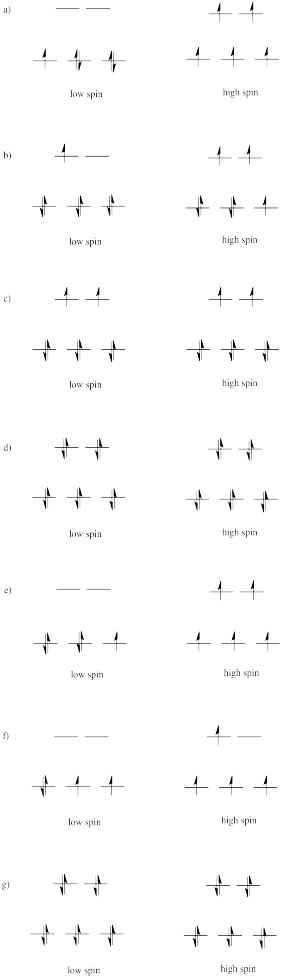
Dibuje diagramas de división orbital d-orbital de alto y bajo espín para los siguientes iones en un ambiente octaédrico y determine el número de electrones desapareados en cada caso.
a) Mn 2+ b) Co 2+ c) Ni 2+ d) Cu + e) Fe 3+ f) Cr 2+ g) Zn 2+
- Responder
-
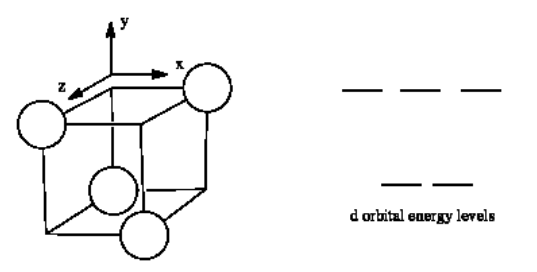
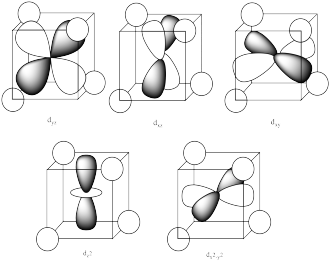
A continuación se muestra el diagrama de división orbital d para un entorno de coordinación tetraédrica. Dado este diagrama, y los ejes en la imagen que lo acompaña, identificar qué d orbitales se encuentran en qué nivel. En la imagen, el átomo metálico está en el centro del cubo, y el círculo representa los ligandos.
- Responder
-
Los tres orbitales mostrados arriba interactúan un poco más fuertemente con los ligandos. Los tres orbitales que se muestran a continuación interactúan un poco más débilmente.
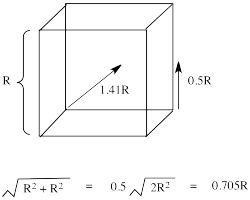
La razón de la diferencia en la interacción tiene que ver con lo cerca que el lóbulo más cercano de un orbital d llega a un ligando. Realmente hay dos posiciones posibles: la cara de un cubo o el borde de un cubo. Si los ligandos están en esquinas alternas del cubo, entonces los orbitales que apuntan a los bordes están un poco más cerca que los que apuntan a las caras del cubo.
Por lo general, la energía de división orbital d en el caso tetraédrico es solo aproximadamente 4/9 tan grande como la energía de división en el caso octaédrico análogo. Explique por qué es más pequeño para el caso tetraédrico.
- Responder
-
Los ligandos no se solapan con los orbitales d así como en los complejos tetraédricos como en los complejos octaédricos. Así, existe una interacción de unión más débil en el caso tetraédrico. Eso significa que el orbital antienlace que involucra a los electrones d no se eleva tan alto en energía, por lo que la división entre los dos niveles d es menor.
Supongamos que cada uno de los iones en el Ejercicio\(\PageIndex{1}\) (CC8.1) estaban en ambientes de coordinación tetraédricos, más que octaédricos. Dibuja los diagramas orbitales d para el giro alto y el caso de espín bajo para cada ion.
- Responder
-
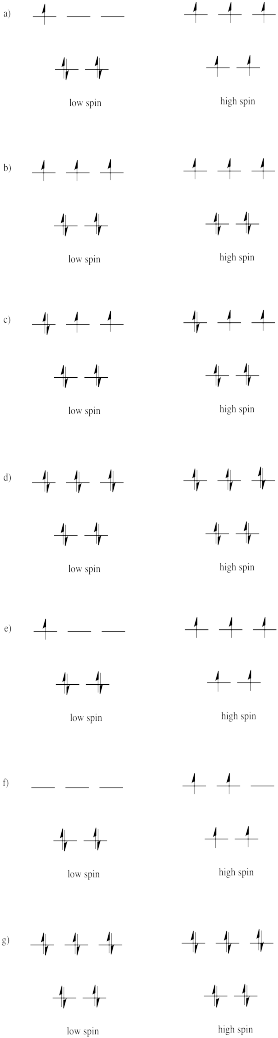
Por lo general, los iones tetraédricos son de alto espín en lugar de de bajo Explique por qué.
- Responder
-
Debido a que la división orbital d es mucho menor en el caso tetraédrico, es probable que la energía requerida para emparejar dos electrones en el mismo orbital sea mayor que la energía requerida para promover un electrón al siguiente nivel de energía. En la mayoría de los casos, el complejo será de alto giro.
A continuación se muestra el diagrama de división orbital d para un entorno plano cuadrado. Dado este diagrama, y los ejes en la imagen que lo acompaña, identificar qué d orbitales se encuentran en qué nivel.
- Responder
-
Los orbitales se muestran en orden de energía.
Predecir si cada compuesto tendrá un giro alto o bajo.
- [Fe (py) 6] 2+
- [Fe (H 2 O) 6] 2+
- [FeBr 6] 3-
- [Co (NH 3) 6] 3+
- [Cu (NH 3) 6] 2+
- [Rh (CO) 6] 3+
- [Cr (CO) 6] 3+
- [PtcL 6] 2-
- Contestar a
-
[Fe (py) 6] 2+ 3d metal, M +2, ligando aceptor pi → bajo espín
- Respuesta b
-
[Fe (H 2 O) 6] 2+ 3d metal, M +2, ligando donante pi → alto espín
- Respuesta c
-
[FeBr 6] 3- metal 3d, M +3, ligando donante pi → alto giro
- Respuesta d
-
[Co (NH 3) 6] 3+ 3d metal, M +3, ligando donante sigma → bajo espín
- Respuesta e
-
[Cu (NH 3) 6] 2+ 3d metal, M +2, ligando donante sigma → bajo espín
- Respuesta f
-
[Rh (CO) 6] 3+ 4d metal, M +3 → giro bajo
- Respuesta g
-
[Cr (CO) 6] 3+ 3d metal, M +3, ligando aceptor pi → bajo espín
- Respuesta h
-
[PtcL 6] 2- 5d metal, M +4 → bajo giro
Predecir si cada compuesto será plano cuadrado o tetraédrico.
- [Zn (NH 3) 4] 2+
- [NiCl 4] 2+
- [Ni (CN) 4] 2-
- [Ir (CO) (OH) (PCy 3) 2] 2+; Cy = ciclohexilo
- [Ag (dppb) 2] +; dppb = 1,4-bis (difenilfosfino) butano
- PTCl 2 (NH 3) 2
- PdCl 2 (NH 3) 2
- [CoCl 4] 2—
- Rh (PPh 3) 3 Cl
- Contestar a
-
[Zn (NH 3) 4] 2+ 3d metal, d 10, ligando donante sigma → tetraédrico
- Respuesta b
-
[NiCl 4] 2+ 3d metal, d 8, ligando donante pi → tetraédrico
- Respuesta c
-
[Ni (CN) 4] 2- 3d metal, d 8, ligando aceptor pi → plano cuadrado
- Respuesta d
-
[Ir (CO) (OH) (PCy 3) 2] 2+ 5d metal, d 8 → plano cuadrado
- Respuesta e
-
[Ag (dppb) 2] 1+ 4d metal, d 10, ligando donante sigma → tetraédrico
- Respuesta f
-
[PtcL 2 (NH 3) 2] 5d metal, d 8 → plano cuadrado
- Respuesta g
-
[PdCl 2 (NH 3) 2] 4d metal, d 8, M +2, ligando donante sigma → plano cuadrado
- Respuesta h
-
[CoCl 4] 2— 3d metal, d 7, ligando donante sigma → tetraédrico
- Respuesta i
-
[Rh (PPh 3) 3 Cl] 5d metal, d 8 → plano cuadrado

