2.10: Serie Espectroquímica
- Page ID
- 79561
Otro factor que juega un papel clave en si un complejo de metal de transición es de alto o bajo espín es la naturaleza de los ligandos. La división de energía orbital d está influenciada por la fuerza que el ligando interactúa con el metal. Los ligandos que interactúan solo débilmente producen pocos cambios en los niveles de energía orbital d, mientras que los ligandos que interactúan fuertemente producen un cambio mayor en los niveles de energía orbital d.
La serie espectroquímica es una lista de ligandos basada en la fuerza de su interacción con iones metálicos. A menudo se enumera, desde ligandos más débiles hasta más fuertes, algo como esto:
I − < Br − < S 2− < S CN − < Cl − < NO 3 − < N 3 − < F − < OH − < C 2 O 4 2− < H 2 O < N CS − < CH 3 CN < py < NH 3 < en < bipy < phen < NO 2 − < PPh 3 < CN − < CO
en el que py = piridina; en = etilendiamina; bipy = 2,2'-bipiridina; phen = 1,10-fenantrolina; S CN significa que el ligando está unido vía azufre y N CS vía nitrógeno.
La lista puede variar de un ión metálico a otro, ya que algunos ligandos se unen preferentemente a ciertos metales (como se ve en la química de ácidos y bases duros y blandos).
¿Qué tendencias empíricas puedes ver dentro de la serie espectroquímica? ¿Hay algún factor que haga de algo un ligando de campo más fuerte?
- Contestar
-
Los donantes más débiles incluyen haluros y donantes de oxígeno. Los donantes de átomos de nitrógeno son en su mayoría un poco más fuertes que eso. Los donantes más fuertes incluyen los donantes de carbono, especialmente con enlaces pi.
Los orbitales d que se elevan en energía en presencia de un ligando pueden ser pensados como formando una combinación orbital molecular antienlace con un orbital en el ligando. Además, también habría una combinación de vinculación para esta interacción. Ese orbital de unión sería más como el orbital ligando inicial. Esta premisa se basa en la idea de que un ligando orbital es inicialmente menor en energía que el orbital metálico, por lo que una combinación de unión entre estos dos orbitales se parece más al orbital del ligando inicial, tanto en energía como en ubicación. El orbital d es inicialmente mayor en energía que el orbital ligando, por lo que una combinación antiunión entre estos dos orbitales se parece más al orbital d inicial, tanto en energía como en ubicación.
- Cuando se combinan orbitales en dos tipos diferentes de átomos, se considera que el orbital antienlace se parece más al orbital que inicialmente estaba a mayor energía.
- En este caso, todavía está cerca de una órbita d en energía, ubicación y forma.
- Cuando se combinan orbitales en dos tipos diferentes de átomos, se considera que el orbital de enlace se parece más al orbital que inicialmente estaba a menor energía.
Supongamos que un ligando tiene más de un par solitario en el átomo donante. El átomo donante podría compartir un par extra de electrones con el metal, para formar un doble enlace. Este tipo de interacción se llama pi-donación, debido a que se forma un enlace pi (que no debe confundirse con la donación sigma de un enlace pi, como en la unión alqueno). Muestre un ejemplo usando Ti (O i Pr) 4.
- Contestar
-
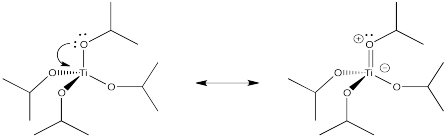
En un ambiente octaédrico, tres de los orbitales d no fueron afectados por la donación sigma de los ligandos. Mostrar lo que sucede con el nivel de energía de estos d orbitales en presencia de un donante pi.
- Contestar
-
La donación de Pi eleva los electrones t 2 g (los electrones d de simetría apropiada para pi se superponen con los ligandos en una geometría octaédrica).

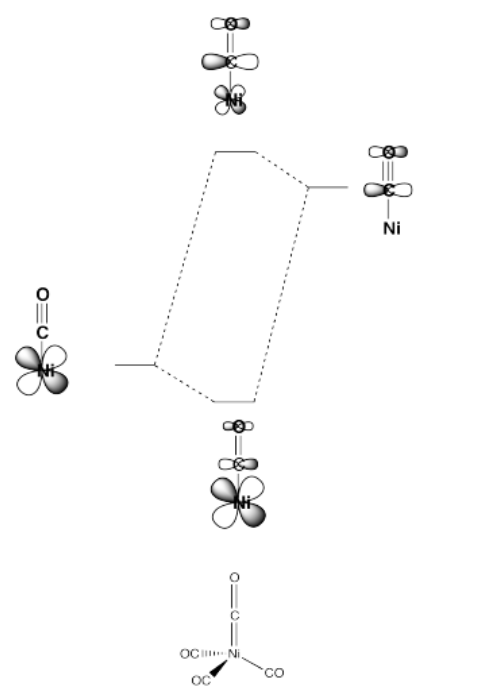
Algunos ligandos pueden aceptar un par de electrones del metal. Un ejemplo es un complejo carbonilo, que tiene un orbital antienlace C=O pi que puede interactuar con un orbital d.
- Mostrar el orbital antienlace en el ligando carbonilo (CO).
- Mostrar cómo un metal d orbital puede interactuar con este orbital.
En el problema anterior, un orbital atómico de menor energía en el metal interactúa con un orbital antienlace de mayor energía en el ligando. Mostrar lo que sucede con las energías de estos dos orbitales cuando interactúan entre sí.
- Contestar
-
Agrega textos aquí. No elimine primero este texto.
Algunas de las tendencias que vemos en las series espectroquímicas surgen de los efectos donadores de pi y aceptores de pi en el ligando. Los ligandos que tienen pares solitarios adicionales (distintos de los que dona un hat sigma) son donantes pi. Los donantes de pi elevan los orbitales t2g que de otro modo no se unen, porque el par solitario en el ligando forma un enlace pi con el metal. Los orbitales t2g y los orbitales de par solitario del ligando forman dos nuevos orbitales. El orbital antiadhesión está más cerca en energía a los orbitales d de alta energía. El orbital de unión está más cerca en energía al orbital del ligando de baja energía.
- La donación de pi eleva el conjunto t2g de d orbitales en energía.
- Como resultado, la división orbital d se hace más pequeña.
- También como resultado, un complejo con donación de pi es un poco menos estable que un complejo sin donación de pi.
Este tipo de interacción se puede ver en las siguientes imágenes (un caso tetraédrico).

Por otro lado, los ligandos en los que el átomo donador ya está unido pi a otro átomo pueden aceptar la donación de pi del metal. Esto sucede donando un par de electrones de un orbital metálico t2g a un orbital pi* en el ligando. En este caso, debido a que el pi* es un orbital antiadhesión, es mayor en energía que el orbital del metal d (o el orbital t2g). El orbital de unión resultante se parece más al orbital metálico de menor energía, mientras que el orbital antienlace resultante se parece más al orbital pi* de mayor energía en el ligando.
- Los ligandos aceptores de pi disminuyen el conjunto t2g de orbitales d en energía.
- Como resultado, la división orbital d se hace más grande.
- También como resultado, un complejo con un ligando aceptor pi es un poco más estable que un complejo sin un ligando aceptor pi.
Este tipo de interacción se puede observar en el siguiente caso (un complejo tetraédrico).
La serie espectroquímica recibe su nombre debido a un desplazamiento en una banda del espectro UV-Vis cuando se comparan dos complejos similares que tienen dos ligandos diferentes. El efecto del ligando sobre la división orbital d tiene un efecto sobre la longitud de onda de la luz asociada con una transición electrónica d orbital (llena) a d orbital (vacía). Esta transición en realidad no está asociada con una absorción mayor por parte del compuesto; d las transiciones orbitales en realidad no son tan eficientes para absorber la luz. Sin embargo, debido a que a menudo ocurren en la región de la luz visible, a menudo conducen a complejos de metales de transición coloreados.
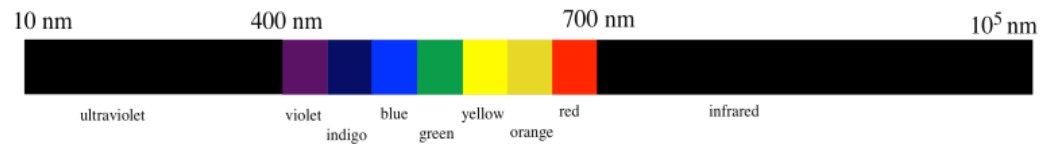
La región visible incluye fotones con longitudes de onda de aproximadamente 400 a 700 nm (realmente, un poco más bajos y un poco más altos, pero estamos redondeando). Los fotones con longitudes de onda más cortas son invisibles; si solo son un poco más cortos que la luz visible son ultravioleta. Más allá de eso, los fotones con longitudes de onda muy, muy cortas son los rayos X y los rayos gamma. Los fotones con longitudes de onda más largas también son invisibles; la región infrarroja está más allá de aproximadamente 700 nm. Más allá del infrarrojo están las microondas y las ondas de radio.
Cuando observamos un objeto, lo que vemos es la luz que rebota en el objeto. Si todas las longitudes de onda de la luz visible rebotan en el objeto, el objeto aparece blanco. Si todas las longitudes de onda de la luz visible son absorbidas por el objeto, el objeto aparece negro. Si se absorben longitudes de onda muy específicas de la luz visible, vemos las otras longitudes de onda, pero el color real que percibimos es ligeramente complicado, por la forma en que percibimos la luz.
En casos simples, el color absorbido y el color complementario que vemos se pueden mostrar usando una rueda de colores. La rueda de colores muestra los “colores complementarios”. Cuando vemos uno de estos colores, la luz que se está absorbiendo es la opuesta en la rueda de colores.

Entonces, si vemos algo que se ve azul brillante, ese objeto realmente está absorbiendo la luz mayormente naranja. Si algo absorbe la luz violeta, nos parece tener un color amarillo.
Explique qué sucede con la longitud de onda de la luz absorbida para la transición d-d cuando un ligando de cloruro en un complejo metálico es reemplazado por un ligando de hidróxido.
- Contestar
-
Debido a que el cloruro es un ligando más débil que el hidróxido, la división orbital d se hace más pequeña. Una transición d-d implicaría menos energía, por lo que se movería a una longitud de onda más larga (desplazamiento al rojo).
El ion [Cu (OH 2) 6] 2+ aparece azul-verde, mientras que el ion [Cu (NH 3) 2 (OH 2) 4] 2+ aparece violeta índigo.
- ¿Qué colores absorbe cada uno de estos complejos?
- ¿Qué complejo absorbe los fotones de mayor energía?
- Si esta absorción se debe a una transición d-d, ¿qué complejo tiene una brecha d-d más grande?
- ¿Qué compuesto tiene ligandos de campo más fuertes?
- Contestar
- Contestar a
-
El ion [Cu (OH 2) 6] 2+ aparece azul-verde, por lo que absorbe un naranja rojizo, alrededor de 650 nm; mientras que el ion [Cu (NH 3) 2 (OH 2) 4] 2+ aparece índigo-violeta, por lo que absorbe amarillo, alrededor de 600 nm.
- Respuesta b
-
La longitud de onda más corta es mayor energía, según la relación Planck-Einstein: E = h c/λ (en la que h = constante de Planck, c = velocidad de la luz, λ = longitud de onda del fotón). El ion [Cu (NH 3) 2 (OH 2) 4] 2+ absorbe el fotón de mayor energía y longitud de onda más corta.
- Respuesta c
-
El ion [Cu (NH 3) 2 (OH 2) 4] 2+ tiene la mayor brecha d-d.
- Respuesta d
-
El amoníaco debe ser un ligando de campo más fuerte que el agua. En términos generales podríamos pensar en eso como resultado de que el amoníaco es solo un donante sigma, mientras que el agua también es un donador pi.
El ion [Cr (NH 3) 6] 3+ aparece amarillo, mientras que el ion [Cr (NH 3) 5 Cl] 2+ aparece rosado.
- ¿Qué colores absorbe cada uno de estos complejos?
- ¿Qué complejo absorbe los fotones de mayor energía?
- Si esta absorción se debe a una transición d-d, ¿qué complejo tiene una brecha d-d más grande?
- ¿Qué compuesto tiene ligandos de campo más fuertes?
- Contestar
- Contestar a
-
El ion [Cu (NH 3) 6] 3+ aparece amarillo, por lo que absorbe violeta, alrededor de 400 nm; mientras que el ion [Cu (NH 3) 5 Cl] 2+ aparece rosado, por lo que absorbe verde, alrededor de 550 nm.
- Respuesta b
-
La longitud de onda más corta es mayor energía, según la relación Planck-Einstein: E = h c/λ (en la que h = constante de Planck, c = velocidad de la luz, λ = longitud de onda del fotón). El ion [Cu (NH 3) 6] 3+ absorbe el fotón de mayor energía y longitud de onda más corta.
- Respuesta c
-
El ion [Cu (NH 3) 6] 3+ tiene la mayor brecha d-d.
- Respuesta d
-
El amoníaco debe ser un ligando de campo más fuerte que el cloruro. En términos generales podríamos pensar en eso como resultado de que el amoníaco es solo un donante sigma, mientras que el cloruro también es un donador pi.
Un TA está preparando algunas muestras de cobalto para laboratorio: una contiene [Cr (OH 2) 6] 3+, una contiene [Cr (CN) 6] 3- y otra contiene [CrF 6] 3-. Desafortunadamente, los mezcla. Simplemente tiene un vaso de precipitados con polvo verde, un vaso con polvo amarillo y un vaso con polvo violeta. ¿Puedes ayudarle a decidir cuál es cuál?
- Contestar
-
El compuesto verde absorbe rojo; el compuesto violeta absorbe amarillo; el compuesto amarillo absorbe violeta.
En términos de energía estas absorbancias se pueden clasificar:
(alta energía) fotón violeta > fotón amarillo > fotón rojo (baja energía)
o en términos de brecha d-d:
gran brecha > brecha media > pequeña brecha
En la serie espectroquímica, esperaríamos que el orden de los ligandos correspondientes fuera:
- CN > H 2 O > F -
El compuesto ciano absorbe violeta y aparece amarillo; el compuesto aquo absorbe amarillo y aparece violeta; el compuesto fluoro absorbe rojo y aparece verde.
El ion [V (OH 2) 6] 3+ aparece amarillo, mientras que el ion [V (OH 2) 6] 2+ aparece rosado.
- ¿Qué colores absorbe cada uno de estos complejos?
- ¿Qué complejo absorbe los fotones de mayor energía?
- Si esta absorción se debe a una transición d-d, ¿qué complejo tiene una brecha d-d más grande?
- Ambos compuestos contienen los mismos ligandos. ¿Por qué uno tiene una brecha más grande?
- Contestar
- Contestar a
-
El ion [V (OH 2) 6] 3+ aparece amarillo, por lo que absorbe violeta, alrededor de 400 nm; mientras que el ion [V (OH 2) 6] 2+ aparece rosado, por lo que absorbe el verde, alrededor de 550 nm.
- Respuesta b
-
La longitud de onda más corta es mayor energía, según la relación Planck-Einstein: E = h c/λ (en la que h = constante de Planck, c = velocidad de la luz, λ = longitud de onda del fotón). El ion [V (OH 2) 6] 3+ absorbe la longitud de onda más corta, fotón de mayor energía.
- Respuesta c
-
El ion [V (OH 2) 6] 3+ tiene la mayor brecha d-d.
- Respuesta d
-
Un ion contiene V 3+, mientras que el otro ion contiene V 2+. A medida que aumenta la carga en un ion, los electrones se contraen hacia el núcleo. Sin embargo, los electrones de baja altitud, que están más cerca del núcleo para empezar, son atraídos incluso más que los electrones de alta mentira. Así, a medida que aumenta la carga en el ion, aumenta la división d-d.
Predecir si cada uno de estos complejos de coordinación tiene un giro bajo o un giro alto.
a) [Co (NH 3) 6] +3 b) [Fe (CN) 6] -4 c) [CoF 6] -4
d) [Rh (CN) 6] -3 e) [V (OH 2) 6] +3 f) [Fe (py) 6] +2
g) [MnCl 6] -4 h) [Ru (NH 3) 6] +2
- Contestar
- Contestar a
-
[Co (NH 3) 6] +3
El metal es +3 lo que sugiere una gran Δ 0
Los ligandos son donantes sigma, por lo que los ligandos de campo medio
La energía de división es grande, por lo tanto, bajo giro.
- Respuesta b
-
[Fe (CN) 6] -4
El metal es la primera fila, +2 sugiriendo intermedio Δ 0
Los ligandos son aceptores pi, así que ligandos de campo fuertes
La energía de división es grande, por lo tanto, bajo giro.
- Respuesta c
-
[CoF 6] -4
El metal es la primera fila, +2 lo que sugiere una gran Δ 0
Los ligandos son donantes pi, por lo que ligandos de campo débiles
La energía de división es pequeña, por lo tanto, alto giro.
- Respuesta d
-
[Rh (CN) 6] -3
El metal es 2da fila (4d) y +3 lo que sugiere una gran Δ 0
Los ligandos son aceptores pi, así que ligandos de campo fuertes
La energía de división es grande, por lo tanto, bajo giro.
- Respuesta e
-
[V (OH 2) 6] +3
El complejo es d 2, por lo que solo hay un posible estado de giro.
- Respuesta f
-
[Fe (py) 6] +2
El metal es la primera fila, +2 sugiriendo intermedio Δ 0
Los ligandos son aceptores pi, así que ligandos de campo fuertes
La energía de división es grande, por lo tanto, bajo giro.
- Respuesta g
-
[MnCl 6] -4
El metal es la primera fila, +2 sugiriendo intermedio Δ 0
Los ligandos son donantes pi, por lo que ligandos de campo débiles
La energía de división es grande, por lo tanto, alto giro.
- Respuesta h
-
[Ru (NH 3) 6] +2
El metal es 2da fila (4d) y +2 lo que sugiere una gran Δ 0
Los ligandos son donantes sigma, por lo que los ligandos de campo medio
La energía de división es grande, por lo tanto, bajo giro.

