2.11: Labilidad del Ligando
- Page ID
- 79517
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)La labilidad se refiere a la facilidad con la que los ligandos son reemplazados en los complejos de coordinación. El escandio se denomina “lábil” en el siguiente ejemplo.
[Sc (OH 2) 6] Cl 3 + 6 NASCN —> Na 3 [Sc (SCN) 6] + 3 NaCl (¡muy rápido!)
La labilidad se refiere a la facilidad con la que se rompen los enlaces metal-ligando. “Un compuesto en el que los enlaces metal-ligando se rompen fácilmente se denomina “" lábil "”.” “Un compuesto en el que los enlaces metal-ligando son más difíciles de romper se denomina “" inerte "”.”
Henry Taube (Premio Nobel, 1983) intentó comprender la labilidad comparando los factores que gobiernan las fuerzas de enlace en los complejos iónicos con observaciones sobre las velocidades de reacción de los complejos de coordinación. Vio algunas cosas que no eran sorprendentes. También sacó algunas conclusiones nuevas basadas en la teoría del campo de ligandos.
¿En qué compuesto de cada par esperarías los enlaces iónicos más fuertes? ¿Por qué?
a) LiF vs KBr
b) CaCl 2 vs KCl
- Contestar
- Contestar a
-
Los iones en LiF son ambos más pequeños que en KBr, por lo que la fuerza de atracción entre los iones en LiF es mayor debido a la menor separación entre las cargas.
- Respuesta b
-
El calcio tiene una carga 2+ en CaCl 2, mientras que el potasio solo tiene una carga +, por lo que los iones cloruro son más fuertemente atraídos por el calcio que por el potasio.
Taube observó que muchos iones M +1 (M = metal) son más lábiles que muchos iones M +3, en general. Eso no es demasiado sorprendente, ya que los iones metálicos funcionan como electrófilos o ácidos de Lewis y los ligandos funcionan como nucleófilos o bases de Lewis en la formación de complejos de coordinación. En otras palabras, los metales con cargas más altas deberían ser ácidos de Lewis más fuertes, por lo que deberían unirse a los ligandos con mayor fuerza.
No obstante, hubo excepciones a esa regla general. Por ejemplo, Taube también observó que los compuestos de Mo (V) son más lábiles que los compuestos de Mo (III). Eso significa que aquí está pasando más que solo efectos de carga.
Otro factor que gobierna las fuerzas de enlace iónico es el tamaño del ion. Típicamente, los iones con radios atómicos más pequeños forman enlaces más fuertes que los iones con radios más grandes. Taube observó que los iones Al 3+, V 3+, Fe 3+ y Ga 3+ tienen aproximadamente el mismo tamaño. Todos estos iones intercambian ligandos aproximadamente a la misma velocidad. Eso no es sorprendente, porque tienen la misma carga y el mismo radio.
Sin embargo, el Cr 3+ también tiene aproximadamente el mismo tamaño que esos iones y también tiene la misma carga, pero es mucho menos lábil. Una vez más, hay excepciones a nuestras expectativas regulares basadas en simples consideraciones electrostáticas.
Además, los metales de transición de la segunda y tercera fila (Y-Cd y Ac-Hg) son mucho más inertes que los metales de transición de primera fila (Sc-Zn). Eso es un poco sorprendente, ya que esos metales inferiores son mucho más grandes que los metales de la primera fila.
Sin embargo, nos da una pista sobre otros factores que están jugando un papel en la labilidad. En la teoría del campo de ligandos, los metales de la segunda y tercera fila tienen energías de división orbital d mucho más grandes que los metales de la primera fila. Eso a veces se explica en términos de orbitales difusos sobre estos átomos más grandes formando enlaces más fuertes a ligandos, y nos recuerda que no solo estamos lidiando con interacciones electrostáticas.
Taube se preguntó si la configuración del electrón d influía en si un compuesto es lábil o inerte. Esa idea forma la base de las reglas de Taube sobre labilidad.
Por ejemplo, metales como Ni 2+ y Cu 2+ son muy lábiles. Los diagramas de división orbital d para esos compuestos tendrían d electrones en el conjunto e g. Recuerde, el conjunto de e g surge de la interacción con los orbitales donantes de ligandos; este conjunto corresponde a un nivel de antiunión σ.
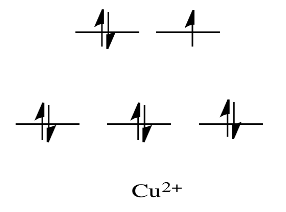
En comparación, V 2+ es bastante inerte. El diagrama de división orbital d en este caso tiene electrones en el conjunto t 2g, pero ninguno en el conjunto e g.
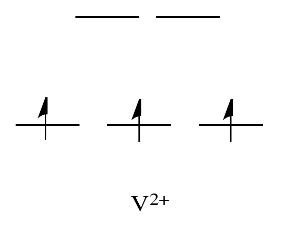
Entonces, al tener electrones en la mayor energía, el nivel de e g antiunión debilita el enlace al ligando, por lo que el ligando puede reemplazarse más fácilmente. En ausencia de esos electrones de mayor energía, el enlace al ligando es más fuerte, y el ligando no se reemplaza tan fácilmente.
Por otro lado, metales como Ca 2+, Sc 3+ y Ti 4+ son bastante lábiles. Los diagramas de división orbital d en esos casos son bastante simples: no hay electrones d en absoluto en estos iones.
Eso significa que no tener electrones en estos niveles en su mayoría no enlazantes deja al complejo susceptible al reemplazo del ligando. Pero es difícil ver por qué la población de un orbital que en su mayoría no está unido tendría un efecto sobre la fuerza del enlace del ligando.
En cambio, este factor probablemente tenga algo que ver con la parte de sustitución de ligandos que hasta ahora hemos ignorado. No sólo necesita salir un ligando, sino que un segundo necesita unirse en su lugar. Entonces, tener un orbital vacío para que el ligando done electrones en (o, dicho de otra manera, no tener electrones en la forma que pueda complicar la donación del ligando) facilita esa parte de la reacción.
Algunos metales, como Mn 2+, pueden ser lábiles o inertes, dependiendo de si son de alto espín o de bajo espín. Explicar por qué usar d diagramas de división orbital.
- Contestar
-
Agrega textos aquí. No borre primero este texto.
Predecir si los siguientes metales, en complejos octaédricos, son lábiles o no.
a) Co 3+ (alto giro)
b) Co 3+ (centrifugado bajo)
c) Fe 2+ (bajo giro)
d) Fe 2+ (alto giro)
e) Zn 2+
- Contestar
- Contestar a
-
lábil (electrones en el conjunto orbital d de mayor energía)
- Respuesta b
-
no lábil (todos los electrones en orbitales d de menor energía)
- Respuesta c
-
no lábil (todos los electrones en orbitales d de menor energía)
- Respuesta d
-
lábil (electrones en el conjunto orbital d de mayor energía)
- Respuesta e
-
lábil (electrones en el conjunto orbital d de mayor energía)

