2.12: Distorsión Jahn-Teller
- Page ID
- 79527
La labilidad a menudo se puede entender en términos del recuento de electrones d en el metal. En ocasiones, hay un electrón elevado en un orbital formalmente σ* que desestabiliza el complejo y debilita un enlace a un ligando. Como resultado, se puede acelerar una ruta de sustitución disociativa. En ocasiones, hay una vacante de baja altitud en un nivel formalmente no vinculado. Como resultado, se puede acelerar una vía de sustitución asociativa.
En algunos casos, el recuento de electrones d puede tener una influencia sutil en la geometría de un complejo. Por ejemplo, un complejo octaédrico podría estar distorsionado, ya sea estirado a lo largo de un eje o bien comprimido. En Jahn-Teller Distortion, este efecto surge de electrones distribuidos de manera desigual en el mismo nivel (degeneración). Aunque este fenómeno es estructural, a veces puede influir en la estabilidad de los complejos que se traduce en sustituciones aceleradas de ligandos.
La degeneración se refiere a un número desigual de electrones en los orbitales al mismo nivel de energía; a veces se describe como una situación en la que existen diferentes formas posibles de rellenar los electrones.

Un ejemplo de esta distorsión se puede ver en el complejo de coordinación, (bpy) Cu (II) (hfacac) 2, que se muestra a continuación. En este complejo, uno esperaría que las distancias Cu-N fueran distintas de las distancias Cu-O. No obstante, las dos distancias Cu-O deberían ser bastante similares.
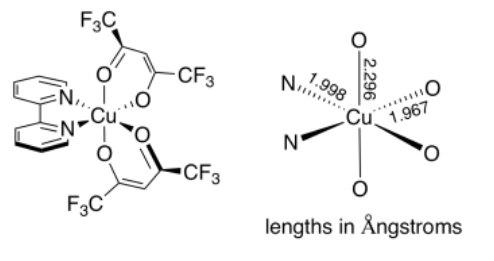
En contraste, resulta que las dos distancias axiales de Cu-O son 17% más largas que las dos distancias ecuatoriales de Cu-O. 1 Podría haber diferentes razones para esto (tal vez los donantes de nitrógeno vecinos influyen en las distancias Cu-O), pero la principal resulta ser un efecto Jahn-Teller. El mismo efecto se puede observar incluso en complejos como Cu (II) (OH 2) 6 2+, en los que todos los ligandos son iguales, pero en los que dos de los enlaces Cu-O que son trans entre sí son significativamente más largos que el resto.
El origen de la distorsión se puede observar en el diagrama de división orbital d para una especie octaédrica. Cu (II) es un ion d 9. En su diagrama de división orbital d, el conjunto superior e g de orbitales está ocupado de manera desigual: uno orbital contiene dos electrones, mientras que el otro contiene solo uno. No parece haber nada intrínsecamente malo en eso; más bien, simplemente hay una ventaja en la distorsión.
Supongamos que los dos ligandos axiales en el octaedro se alejan del metal. Imagina que están interactuando con el orbital d z 2. Su interacción con ese orbital dio como resultado que el d z 2 aumentara de energía porque es el contribuyente dominante al orbital σ*. En consecuencia, si el ligando retrocede, interactúa menos fuertemente con el d z 2, y el d z 2 cae ligeramente en energía. En general, las interacciones orbitales obedecen a la conservación de la energía, por lo que si el d z 2 cae en energía, entonces el d x 2 - y 2 se eleva en energía.
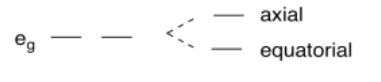
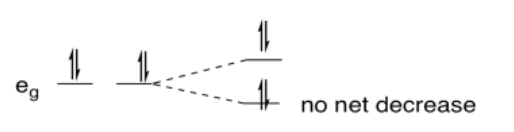
Entonces, ¿por qué tiene algo que ver con una distribución desigual de electrones? En el caso de Cu (II), que es d 9, hay dos electrones en uno orbital e g y uno en el otro. Si uno de los orbitales baja en energía y el otro sube, puede que no haya ningún cambio general en la energía de los orbitales, pero hay una disminución neta de la energía electrónica porque dos electrones están bajando y sólo uno está subiendo.
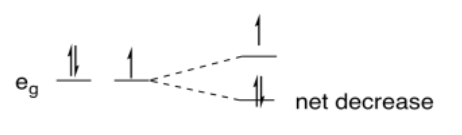
En comparación, si el metal fuera d 10, dos electrones bajarían de energía y dos subirían hacia arriba. No habría ningún cambio general en la energía y ninguna ventaja en sufrir una distorsión.
¿Habría ventaja en sufrir una distorsión en los siguientes casos?
- giro bajo d 7
- giro bajo d 8
- Contestar a
-
sí; giro bajo (ls) d 7 es por ejemplo 1, por lo que un nivel tiene un electrón y el otro no tiene ninguno - disminución neta de energía tras la distorsión
- Respuesta b
-
no; d 8 es por ejemplo 2, por lo que ambos niveles tienen un electrón, sin cambio neto en la energía tras la distorsión
¿En cuál de los siguientes iones esperarías ver una distorsión de Jahn-Teller?
- Co (OH 2) 6 2+
- Ag (OH 2) 6 2+
- Ni (OH 2) 6 2+
- Mn (OH 2) 6 2+
- Ag (OH 2) 6 +
- Contestar
- Contestar a
-
Co 2+ sí; d 7 entonces e g 1
- Respuesta b
-
Ag 2+ sí; d 9 entonces e g 3
- Respuesta c
-
Ni 2+ no; d 8 así que e g 2
- Respuesta d
-
Mn 2+ no si hs; d 5 entonces e g 2. Sin embargo, si fuera de bajo giro (poco probable con un metal de primera fila en un estado de oxidación moderadamente bajo y donadores π), entonces habría degeneración y distorsión.
- Respuesta e
-
Ag + no; d 10 así que e g 4
Distorsiones similares ocurren cuando hay degeneración en el nivel inferior, t 2g. Sin embargo, las distorsiones son más sutiles porque los orbitales d en este nivel interactúan mucho menos fuertemente con los ligandos. Por ejemplo, se ha demostrado que en el complejo d 1 hexacyano titanio, [Ti (CN) 6] 3-, las longitudes de enlace Ti-C ecuatorial son 2.168 Å, mientras que las longitudes de enlace axial son 2.199 Å, una diferencia de aproximadamente 13%.
¿En cuál de los siguientes iones esperarías ver una distorsión de Jahn-Teller?
- [V (CN) 6] 3-
- [Cr (CN) 6] 3-
- [Mn (CN) 6] 3-
- [Fe (CN) 6] 3-
- [Cr (CN) 6] 4-
- [Mn (CN) 6] 4-
- [Fe (CN) 6] 4-
- Contestar
- Contestar a
-
[V (CN) 6] 3- sí d 2 t 2g 2
- Respuesta b
-
[Cr (CN) 6] 3- no d 3 t 2g 3
- Respuesta c
-
[Mn (CN) 6] 3- sí d 4 t 2g 4
- Respuesta d
-
[Fe (CN) 6] 3- sí d 5 t 2g 5
- Respuesta e
-
[Cr (CN) 6] 4- sí d 4 t 2g 4
- Respuesta f
-
[Mn (CN) 6] 4- sí d 5 t 2g 5
- Respuesta g
-
[Fe (CN) 6] 4- no d 6 t 2g 6
Aunque hemos observado una distorsión a través del alargamiento del par axial de ligandos, también podríamos obtener un caso complementario en el que el octaedro se comprime a lo largo de un eje y se estira a lo largo del plano ecuatorial. No obstante, las razones de tal distorsión son muy parecidas a las que miramos.
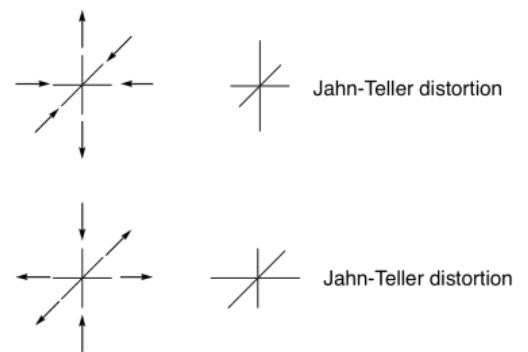
En la práctica, ambas distorsiones son posibles, y es difícil predecir cuál ocurrirá realmente.
- Datos estructurales para (bpy) Cu (II) (hfacac) 2 de: Veidis, M. V.; Schreiber, G. H.; Gough, T. E.; Palenik, G. J. Am. Chem. Soc. , 1969, 91 (7), 1859—1860.
- Datos computacionales para el ion [Ti (CN) 6] 3- de: Atanasov, M.; Comba, P.; Daul, C. A.; Hauser, A. J. Phys. Chem. A, 2007, 111 (37), 9145—9163.

